가재붙이(갑각강, 가재붙이과) 서식굴 내 영양염의 일간 변화


초록
본 연구의 목적은 큰 규모의 서식굴(가재붙이) 내부에서의 조석에 따른 산소 및 영양염 변동을 파악하고, 갯벌 퇴적물의 영양염 순환에 있어 큰 서식굴이 미치는 영향 정도를 파악하는 것이다. 이를 위해 서식굴을 파괴하지 않으면서 굴 내부의 환경을 측정할 수 있는 관찰구를 근소만 갯벌 현장퇴적물 속에 설치하고, 서식굴 내부의 산소 및 영양염의 일간 변동을 조사하였다. 가재붙이(L. astacina) 서식굴 내부의 영양염 농도는 노출시와 침수시 그리고 낮과 밤 동안에 뚜렷한 차이를 나타내며 일변화를 보였다. 특히 용존성무기질소의 경우에 그러한 경향이 뚜렷하였으며, 이는 굴 내부의 온도와 산소농도 조건에 따라 암모늄화, 질산화, 탈질산화 작용이 선택적으로 일어나고 있음을 지시하였다. 가재붙이 서식굴을 통한 영양염의 플럭스도 하루 중 밀물과 썰물 그리고 낮과 밤 간에 뚜렷한 일변화를 보였으며, 그 양은 갯벌 표층(자연상태의 대형저서동물 개체수 유지)을 통한 플럭스의 23∼224% 범위에 있었다. 가재붙이와 같이 큰 굴을 가지며 활발하게 관개활동을 하는 생물의 서식굴이 갯벌 퇴적물과 해수 간의 영양염 순환에 보다 중요한 의미를 가질 수 있음을 시사하였다. 동일 조사지역에서 각기 다른 방법으로 측정된 영양염 플럭스 결과 비교에서 현장에서 직접 측정한 본 조사의 경우에 기존에 일반적으로 사용되고 있던 챔버를 이용한 퇴적물 배양법이나 미세전극을 이용한 플럭스 계산법에 비해 훨씬 높은 플럭스가 계산되었다. 기존의 방법을 통한 플럭스 계산에는 일정 이상의 규모를 가진 생물에 의한 플럭스 영향을 충분히 고려하지 못했기 때문인 것으로 판단되었다. 이로부터 가재붙이와 같이 큰 규모의 서식굴을 가지는 종이 갯벌 퇴적물의 영양염 순환에 미치는 영향이 지대함을 알 수 있었다. 따라서 조석 변동과 큰 규모의 서식굴을 반영하지 않은 갯벌의 영양염 플럭스 산출은 과소평가 될 수 있었다.
Abstract
This study aimed to investigate the variations of oxygen and nutrient in the burrows of Laomedia astacina with a huge burrow system and to understand its effect on the nutrient circulation in the tidal flat sediments. For this purpose, the observatory was installed in the sediments of Geunso tidal flat, and diurnal fluctuations of oxygen and nutrient in the burrow were directly measured. The nutrient concentrations in the burrow of L. astacina were significantly different between the exposure and submergence periods and between daytime and nighttime. This tendency was especially pronounced in the case of dissolved inorganic nitrogen, indicating that ammoniumation, nitrification, and denitrification selectively take place depending on the temperature and oxygen concentration in the burrow. The nutrient flux through the burrows of the L. astacina ia also showed clear diurnal variations between high and low tides and between daytime and nighttime, and the amount varied between 23 and 224% of the flux through the surface layer of the tidal flat (when the benthic population in natural conditions is maintained). These results suggest that the burrows of the organisms which have a large burrow and perform active irrigation activities, such as L. astacina, may play a very significant role in the nutrient circulation between intertidal sediments and seawater. As a result of comparing the results of this study with the measurements of the nutrient flux by different methods in the same study area, values of nutrient flux calculated by direct field measurements in this study were much higher than those obtained by the generally used conventional methods, such as the sediment incubation method using a chamber or the flux calculation method using microelectrodes. This contrast is believed to show that the calculation of the nutrient flux by the conventional methods did not sufficiently take into account the influence of the organisms on the nutrient flux with a scale above a certain level. These results showed that species with a large-scale burrow such as L. astacina have a great effect on the nutrient circulation of the tidal flat sediments. Therefore, it is likely that the calculation of the nutrient flux of tidal flats which does not reflect tidal fluctuations and large-scale burrows will produce underestimated results.
Keywords:
Burrow, Nutrient, Oxygen, Flux, Laomedia astacina, Tidal flat키워드:
서식굴, 영양염, 산소, 플럭스, 가재붙이, 갯벌1. 서 론
연안 환경에서 영양염과 유기물은 수층과 퇴적층의 프로세스(일차생산과 분해)에 의해 생성되고 제거된다. 연안에서 일차생산에 의해 생성된 유기물은 외해로 유출되는 양도 있으나 일차적으로는 연안의 퇴적물로 유입되어 갯벌을 포함하는 연안역 생물의 신진대사에 이용된다. 퇴적물 내에서는 생물의 신진대사 산물로서 영양염이 재생산되어 수층의 일차생산을 지지한다. Cowan et al.[1996]은 연안의 수층에서 생산된 유기물 양의 50%가 저층의 퇴적물 내에서 분해되며, 이 과정에서 재생산된 영양염은 최대 94%까지 수층의 일차생산을 지지할 수 있다고 하였다. 생물교란 활동이 활발한 갯벌에서 퇴적물-물 경계면(sediment-water interface)을 통한 물질 교환은 연안 생태계 내 영양염 순환에 중요한 역할을 하는 것으로 알려져 있다(Cowan et al.[1996]; Koo and Koh[2013]; Kristensen and Kostka[2005]; Wahyudi et al.[2015]). 생물교란 활동을 통해 혐기성 환경으로 산소가 공급되어지고, 이는 호기성 유기물 분해뿐 만 아니라 준호기성 및 혐기성 유기물 분해까지도 촉진하기 때문이다(Aller and Aller[1998]). 이러한 관계는 수심이 5 m 이하의 얕은 연안에서 특히 중요하다(Kemp et al.[1992]). 우리나라 서해안과 같이 얕은 수심을 가지며 넓은 갯벌이 잘 발달된 환경에서 수층과 퇴적물 경계면에서의 물질순환은 연안환경에 지대한 영향을 미칠 것으로 예상된다. 결과적으로 생물교란은 퇴적물 내 유기물 분해를 배가하는 역할을 하며(Ziebis et al.[1996]), 특히, 큰 규모의 서식굴을 만드는 쏙 상과(Thalassinidae)의 무척추동물은 이러한 측면에서 중요할 수 있다.
대상종인 가재붙이(Laomedia astacina)는 절지동물문의 갑각강(Class Crustacea) 십각목(Order Decapoda) 가재붙이과(Family Laomediidae)에 해당하는 펄새우(mud shrimp)류의 일종으로 다자란 성체의 몸길이는 10 cm에 약간 못 미치는 정도이다. 아직 이종의 생태학적 특징에 대해서는 알려진 바가 거의 없으나 서식굴의 크기는 깊이 기준으로 2 m에 달하기도 한다(Koo[2017]). 이 종은 서해안과 남해안의 해안 중 상부 갯벌의 염습지가 보존되어 있는 곳에 주로 서식하며, 강화 동검리 염습지, 강화 창후리 염습지, 월곶 염습지, 대부 남사리 염습지, 태안 근소만 염습지, 새만금 동진강 염습지, 남해도 북서쪽에 위치한 설천면 해안 염습지, 그리고 창선도 동대만 염습지 등에 분포한다.
대형저서동물에 의한 생물교란이 갯벌 퇴적물과 수층의 경계면에서 물질순환에 영향을 미칠 수 있는 근간은 생물활동에 의해 깊은 퇴적물 속으로 산소 및 신선한 유기물이 공급되어질 수 있기 때문이다. 특히 산소는 퇴적물-물 경계면에서의 물질순환에 있어 가장 중요한 요소이다(Rabouille et al. 2003). 따라서 갯벌 퇴적물 내 산소농도의 분포를 파악하는 것은 물질순환의 과정을 이해하기 위한 가장 기본적인 항목이다. 갯벌 퇴적물 내 산소농도의 분포와 산소에 의존적인 분포를 보이는 미생물 군집 및 지화학 요소의 분포는 미세전극(electrode)과 광학센서(optic sensor) 등의 미세 측정기구의 개발과 함께 많은 연구가 진행되었다. 그러나 갯벌 저서동물이 만든 서식굴 내부에서의 조석주기에 따른 산소농도와 영양염 거동과 관련하여 현장에서 직접 측정한 자료는 아직까지 보고된 바 없다. 이는 퇴적물을 교란하지 않으면서 생물활동을 고려한 체 측정하기가 어렵기 때문이다.
본 연구의 목적은 큰 규모의 서식굴(가재붙이) 내부에서의 조석에 따른 산소 및 영양염 변동을 파악하는 것이다. 이를 위해 서식굴을 파괴하지 않으면서 굴 내부의 환경을 측정할 수 있는 관찰구를 현장 퇴적물 속에 설치하고, 이를 통해 서식굴 내부의 산소 및 영양염의 변동을 현장에서 직접 측정하였다. 한편, 기존의 영양염 플럭스 산출에 이용되었던 챔버 내 퇴적물 배양에 의한 방법과 미세전극을 이용한 영양염 플럭스 계산법의 결과를 현장에서 직접 측정한 본 조사 결과와 비교를 통해 갯벌 퇴적물을 통한 영양염의 플럭스에 가재붙이(L. astacina)가 만드는 것과 같은 큰 규모의 서식굴이 생태학적으로 어떤 의의를 가지는지에 대해 고찰한다.
2. 재료 및 방법
2.1 연구지역
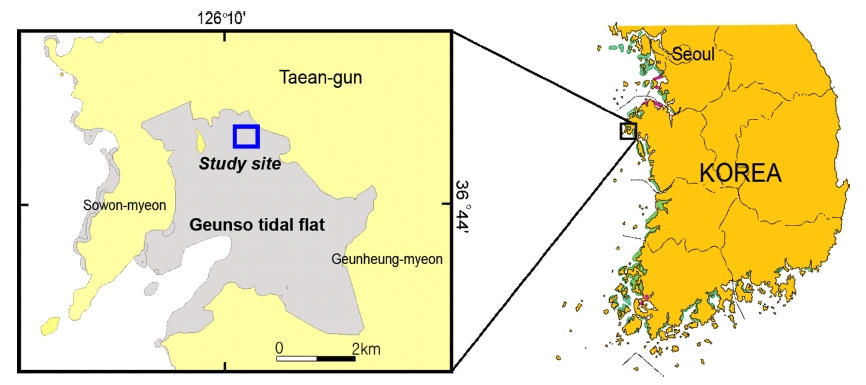
본 연구는 충청남도 태안반도에 위치한 근소만 갯벌에서 수행되었다(Fig. 1). 근소만은 조석의 영향을 받는 반폐쇄성 만으로 총면적은 30 km2이며(Kim and Kim[2008]), 이중 갯벌의 면적은 23.8 km2에 이른다. 조사지역으로 유입되는 하천이 없어 만 외부와 내부의 해수교환은 약 2 km 폭의 만 입구를 통해서만 이루어진다. 만 입구에서 계절별로 측정한 수온의 평균은 6.07∼21.4 oC이고, 평균 염분은 31.7∼32.3 psu이다(Kim and Kim[2008]). 조사지역은 평균해수면 기준 약 125 cm 조고에 위치하며, 일년 중 약 68% 빈도로 대기에 노출되며 고조시 최대 수심은 2.2 m 이다. 이 지역의 퇴적물은 주로 실트질(65%)로 구성되었으며 평균입도는 5.5~6.5Φ 범위에 있다. 근소만 갯벌의 저서동물 우점종은 가재붙이(Laomedia astacina)와 칠게(Macrophthalmus japonicus)이다.
2.2 현장 관찰구 설치
가재붙이(L. astacina) 서식굴 내 해수(burrow water) 중의 영양염, 산소 및 온도 측정을 위하여 2007년 3월 근소만 갯벌 가재붙이 서식지에 현장 관찰구를 설치하였다(Fig. 2). 한 면의 크기가 60 cm×100 cm(가로×세로)인 6개의 아크릴 판(두께 12 mm)을 서로 연결하고 그 아랫면에는 육각형의 아크릴판으로 고정한 현장 서식굴 관찰용 수조를 갯벌 퇴적물 속에 두 개를 설치하였다. 관찰용 수조의 윗면에는 사람이 드나들 수 있도록 육각향의 나무판(두께 20 mm)을 고정하여 개폐가 가능하도록 하였다. 관찰구는 윗면과 갯벌 표층이 수평이 되도록 퇴적물 내에 설치하였다. 갯벌 퇴적물과 접하는 여섯 면에는 일정 간격을 두고서 각 면당 62개의 직사각형 구멍(15 mm×60 mm)을 뚫고 퇴적물 속에 설치하기 전에 탄력성 있는 실리콘으로 막았다. 실리콘은 수조로부터 탈부착이 가능하도록 했다(Fig. 2). 실리콘으로 막았을 때 틈으로 해수 및 공기가 새어 나올 가능성을 고려하여 설치 전 실험실에서 그 가능성을 테스트 하였다. 사방이 막힌 육면체의 아크릴에 관찰구와 동일한 크기의 구멍을 뚫고 증류수를 넣어 실리콘으로 막았다. 실리콘을 통해 산소광학센서를 넣고서 빛이 완전히 차단된 항온실에서 두 시간 동안 산소농도 변화를 관찰했다. 이 때 사용된 모든 도구는 멸균기에서 30분간 멸균된 것을 이용하였다. 측정 결과 산소농도는 두 시간동안 변화를 보이지 않았고, 이로부터 실리콘을 통한 공기 및 해수의 이동은 없음을 확인하였다.
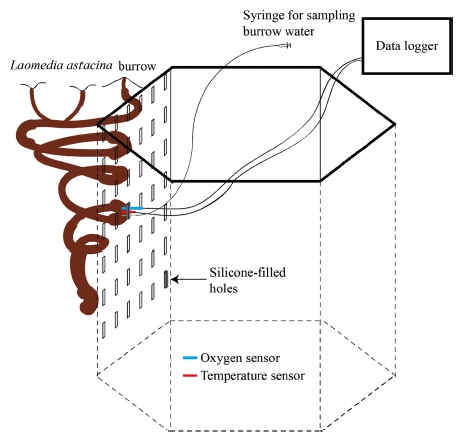
diagram for sampling the water for nutrients and measuring the oxygen concentration in the burrow water of Laomedia astacina. Optode oxygen sensors were inserted into burrow lumen through silicone-filled holes on the observatory wall.
관찰구 설치 후에는 주변 갯벌에서 잡은 가재붙이(L. astacina)를 관찰구 주변 퇴적물에 열 개체 이식하였다. 관찰구 설치 약 6개월 후(9월)에 수조의 벽면에는 가재붙이가 만든 서식굴의 연장선이 지나가게 되었고(Fig. 2), 실리콘으로 막아 놓은 곳에 서식굴이 지나간 곳을 선택하여(표층으로부터 25 cm 깊이) 산소광학센서와 온도센서(Fibox-3 optode sensor, Presens Co Ltd)를 실리콘을 통해 꽂을 위치를 선정하였다. 광학센서의 보정은 실험 전·후에 0%와 100%에서 보정하였다. 10 ml의 현장 해수를 보정통에 넣고 아황산나트륨(Na2SO3) 1g을 첨가하여 녹인 후 0% 보정을 하였으며, 현장 해수를 기포기로 충분히 환기 후 100% 보정을 하였다. 산소농도 측정을 위해서는 장비의 방수가 요구되었다. 이를 위해 밀물 시에도 침수되지 않는 높이로 타워를 갯벌 상에 세우고 그 위에 산소측정기(Fibox-3 oxygen meter, Presens Co Ltd)와 자료 백업장치를 두었다.
2.3 영양염 측정
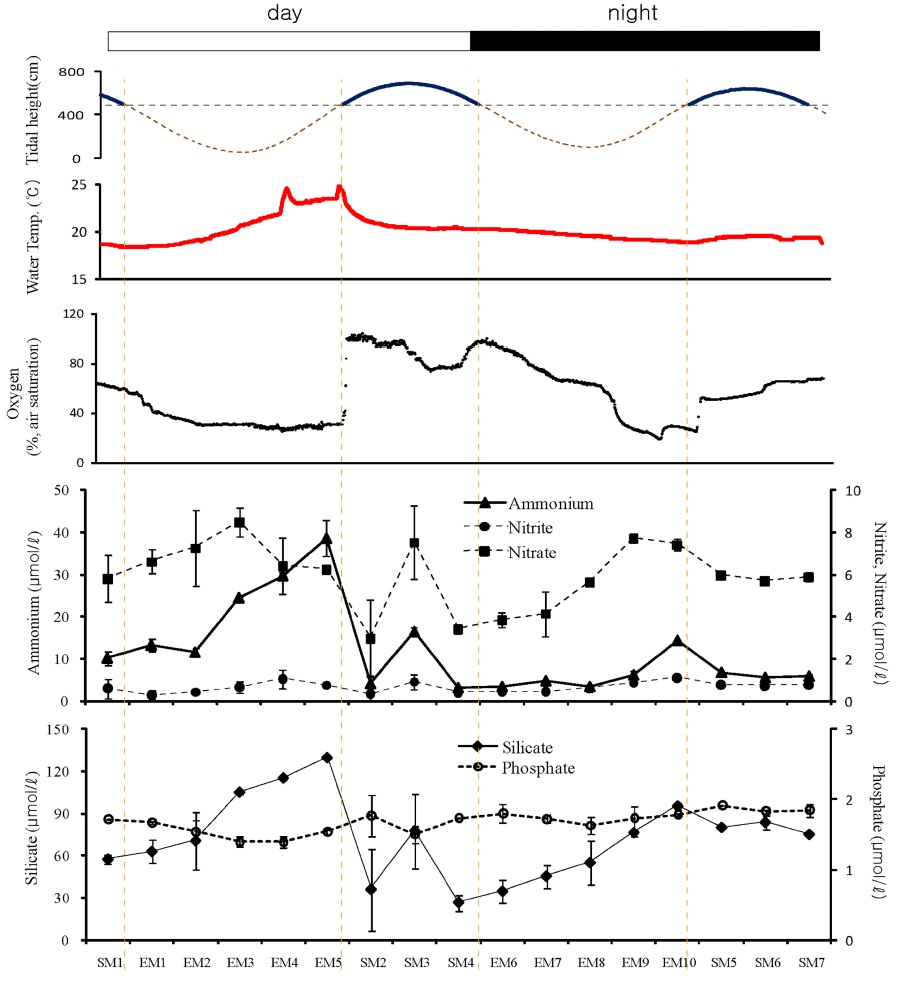
가재붙이 서식굴 내에서 조수 움직임에 따른 산소농도와 영양염 농도의 변동을 조사하였다. 현장 관찰구의 벽면 실리콘 안쪽에 서식굴이 형성되어 있는 곳(퇴적물 표층으로부터 25 cm 깊이)의 굴내 해수를 대상으로 조석에 따른 염양염 변동을 측정하였다. 굴 내 해수는 실리콘을 통해 주사바늘을 주입하여 한번에 10 ml씩 채수하였으며 매회 두 번 반복 채수하였다. 채수 시에는 굴 내부가 교란되지 않게 아주 천천히 채수하였다. 관찰구 내에는 대기에 노출시에도 해수가 채워져 있다. 그래서 굴 내 해수 시료는 항상 SCUBA 장비를 착용 한 상태로 채수하였다. 조사지역이 노출되기 직전에 첫 번째 시료를 채취하였으며, 이후 노출 및 침수가 두 번씩 반복되는 동안 일정 간격으로 총 17회 약 24 시간 동안 시료를 채취하였다(Fig. 3; Fig. 4C). 실험이 진행되기 하루 전에 해수 시료를 채취할 곳을 선정하였으며, 동시에 산소 광학센서와 온도센서를 설치하여 현장 실험이 끝날 때까지 산소농도와 수온을 함께 연속 측정하였다. 실험이 끝나고 난 후에는 관찰 구내 해수를 모두 제거 한 후 서식굴 내 해수 채취 깊이까지의 부피를 측정하였다. 부피는 해당 깊이의 실리콘을 통해 얇은 실리콘 관을 집어 넣어 굴 내부로부터 빠져 나온 해수 양으로 계산하였다. 그리고 관찰구 가장 아래 쪽에 구멍을 뚫어 동일한 방법으로 전체 서식굴의 부피를 측정하였으며, 그 부피는 9.5 l 였다. 실험 시작 직전에 계수한 가재붙이의 평균 서식밀도는 6.0 ± 1.2 개체(N=10) 이었다.
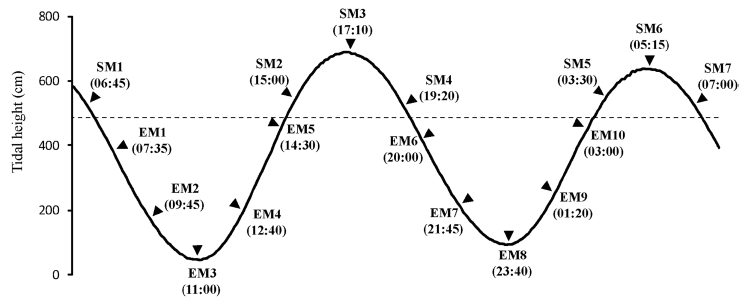
Water sampling occasions for nutrients with tides. Water samples were taken from Laomedia burrow, a tidal pool with the natural density of macrofauna, and a pool insulated from the sediments by acryl (see Fig. 4). A dotted line represents tidal height of study site. SM and EM represent periods of submergence and emergence, respectively.
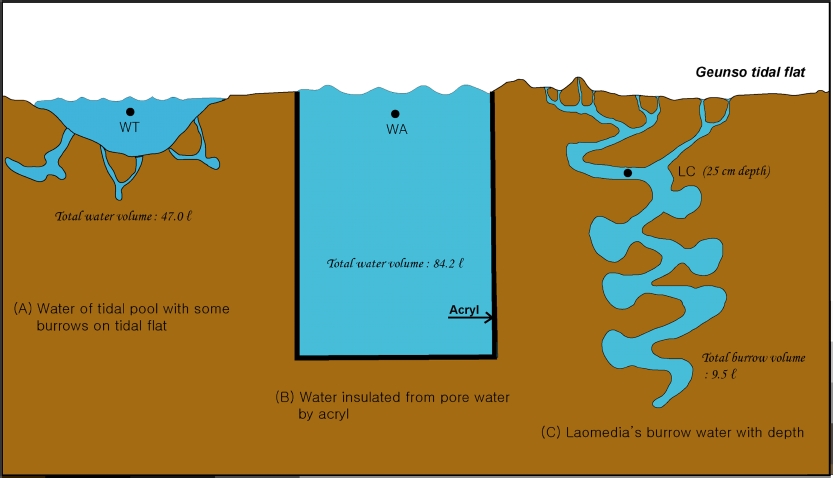
Water sampling design for nutrients in three different sites. seventeen times of the sampling was done with tide. Tidal height here is 125 cm from mean sea level.
서식굴 내 영양염 변동과의 비교를 위해 관찰구와 동일한 조고에 위치한 또 다른 두 곳(WA, WT; Fig. 4)에서도 동일한 시기에 해수를 채수하였다. 두 비교 실험구는 큰 서식굴에 의한 영양염 플럭스 영향을 관찰구(LC)와 비교하기 위해 설정되었다. WT는 큰 규모의 서식굴이 없는 자연상태의 갯벌퇴적물을, 그리고 WA는 절연체(실리콘)로 차단되어 퇴적물과 접촉이 되지 않는 환경으로 설정하였다. 갯벌 상에 약 110 cm 직경 크기의 면적으로 흙을 파낸 곳에 고여 있는 해수(WT: Fig. 4A)와 실리콘으로 주변 퇴적물 및 공극수로부터 완전 차단된 해수(WA: Fig. 4B)에서도 주사기를 이용하여 동일한 양의 해수를 채수하였다. 흙을 파내어 웅덩이를 만든 곳은 실험 시작 한 달 전에 미리 위치를 설정하고 흙을 파내었으며, 이 때는 가재붙이가 서식하지 않는 곳을 선택하였다. 이 웅덩이 내에서 굴을 형성한 종은 칠게(Macrophthalmus japonicus)와 흰이빨참갯지렁이(Periserrula leucophryna) 였으며, 각각 11 개체와 1 개체의 서식굴이 웅덩이 내에서 확인되었다. 이때 웅덩이의 표층 면적은 약 0.8 m2 이었으며, 최대수심은 약 10 cm 이었다. 이곳에서도 실험 종료 후 부피를 측정하였다. 웅덩이와 웅덩이 아래로 형성된 칠게(M. japonicus)와 흰이빨참갯지렁이(P. leucophryna) 서식굴로 경화제를 첨가한 액상 폴리에스테르 레진을 갯벌 표층과 수평이 될 때까지 부었다. 4일 후 굳어진 레진을 파내고 그 부피와 표면적을 계산하였다. 웅덩이와 서식굴에 의한 부피는 총 47 cm3 였으며, 서식굴 만의 표면적과 전체 표면적은 각각 5,726 cm2, 15,803 cm2 였다. 또 다른 해수채취 위치는 주변 퇴적물과 공극수로부터 아크릴에 의해 차단된 두 개의 관찰구 중 나머지 하나에 고여진 물을 대상으로 하였다(WA; Fig. 4B). 실험 시작 전날 뚜껑을 열어 관찰구 내에 고여 있던 물과 흙을 완전히 제거하였으며, 다음 밀물 시 새로운 물이 들어올 수 있도록 뚜껑을 열어 두었다. 실험지역에는 CTD (SBE-19)를 설치하여 실험 기간 중 밀물 시 수심, 수온, 염분을 측정하였다. 그리고 썰물 시에는 YSI-85 계측기를 이용하여 WA와 WT 위치에서 용존산소, 수온, 염분을 매회 각각 측정하였다.
채집한 해수는 현장에서 질소가스로 충진된 혐기성 박스 안에서 시린지 필터(MFS-25, CA, 0.2 μm)로 부유물을 제거한 다음 6 ml의 시료에 수은용액(HgCl2) 125 mM을 60 μl 가하여 냉동 보관하였다. 영양염 분석은 자동분석기(Proxima, Alliance Instruments)를 이용하였으며(Parson et al.[1984]), 각각의 측정값은 표준해수시료(CSK standard solution, Wako Pure Chemical Industries)로 정확도를 검정하였다.
2.4 영양염 플럭스(nutrient flux) 계산
갯벌상에 설정한 웅덩이(WT)와 가재붙이 서식굴(LC)에서 영양염의 시간에 따른 농도 변화량을 이용하여 아래의 식에 의해 갯벌퇴적물 혹은 가재붙이 서식굴과 수층간의 암모늄, 질산염, 용존성무기질소 (DIN), 인산염, 규산염의 플럭스를 계산하였다.
F = [(CE – CS)V/TA]
F: 영양염 플럭스
CS와 CE: 분석에 이용된 시간동안 처음과 마지막의 영양염 농도
V: 가재붙이 서식굴 내 해수부피 혹은 갯벌 상 웅덩이에 고인 해수부피
T: 시간, A: 갯벌 면적
조사지역은 갯벌 상에 위치하며 조석의 영향을 받기 때문에 영양염 농도는 조석에 따라 크게 변화된다. 그래서 조사지역이 대기에 노출된 시간동안(EM)과 해수에 덮힌 시간(SM)을 구분하여 영양염 플럭스를 각각 계산하였다. 그리고 낮과 밤의 노출과 해수침범 시간을 각각 구분하여 계산하였다. 조사지역이 대기에 노출되면서부터 WT와 LC의 해수 중 영양염 농도는 해수가 다시 유입되기 직전까지 선형적으로 증가 혹은 감소하였으며, 해수가 유입되면서 농도는 희석되었다. 따라서 대기에 노출된 시기 동안 LC와 WT의 해수 중에 농축된 영양염이 해수유입에 의해 희석된 정도(CE-CS)를 퇴적물 혹은 서식굴 내부에서 수층으로 유출된 양으로 계산하였다. 그리고 해수가 유입된 상태에서도 영양염의 농도는 변화를 보였으며, 이때는 해수가 유입되고부터 최고조위에 이를 때까지의 농도 변화(SM-a)와 최고조위에서 조사지역이 노출되기 직전까지의 농도 변화(SM-d)를 구분하여 영양염 플럭스를 계산하였다. ‘+’ 값은 퇴적물 혹은 서식굴에서 수층으로 유출된 양으로 그리고 ‘-’ 값은 해수로부터 유입된 양으로 표현하였다. 그리고 노출되었을 시 시료채취(회당 20 ml)에 의한 해수부피의 변화는 전체 부피(각각 47 l와 9.5 l)에 비해 미약하여 영양염 플럭스 계산에는 고려하지 않았다.
3. 결 과
3.1 영양염 변동
영양염의 변동을 각 측정 지역별로 낮과 밤, 노출과 침수 기간으로 구분하여 비교하였다. 아크릴에 의해 퇴적물 및 공극수로부터 차단된 해수(WA)에서 측정한 영양염의 농도는 시간에 따른 큰 변화를 보이지 않았다(Fig. 5). 다만, 암모늄의 농도는 낮 동안의 간조시에는 4~5 μmol/l로 상대적으로 높은 값을 보였으나, 밤에는 노출시기에도 약 2 μmol/l 농도로 일정하게 유지되었다. 아질산염의 농도도 암모늄과 유사한 분포 경향을 보였으나, 질산염은 뚜렷한 패턴없이 일정한 농도를 유지하였다. 인산염과 규산염의 농도는 조사 기간 동안 큰 변화를 보이지 않았다. 노출시기 동안 밤과 낮의 용존산소 함유량은 상반된 분포를 보였다. 낮에는 시간에 따라 약간 증가하는 경향을 보였으나, 밤에는 뚜렷이 감소하는 경향을 보였다. 낮 동안 노출시 수온은 21~23 oC로 밤에 비해 약 3 oC 가량 높았다.
Diurnal variations of nutrients and environments with tide at WA site (a water reservoir insulated from sediments by acryl). SM and EM represent periods of submergence and emergence, respectively.
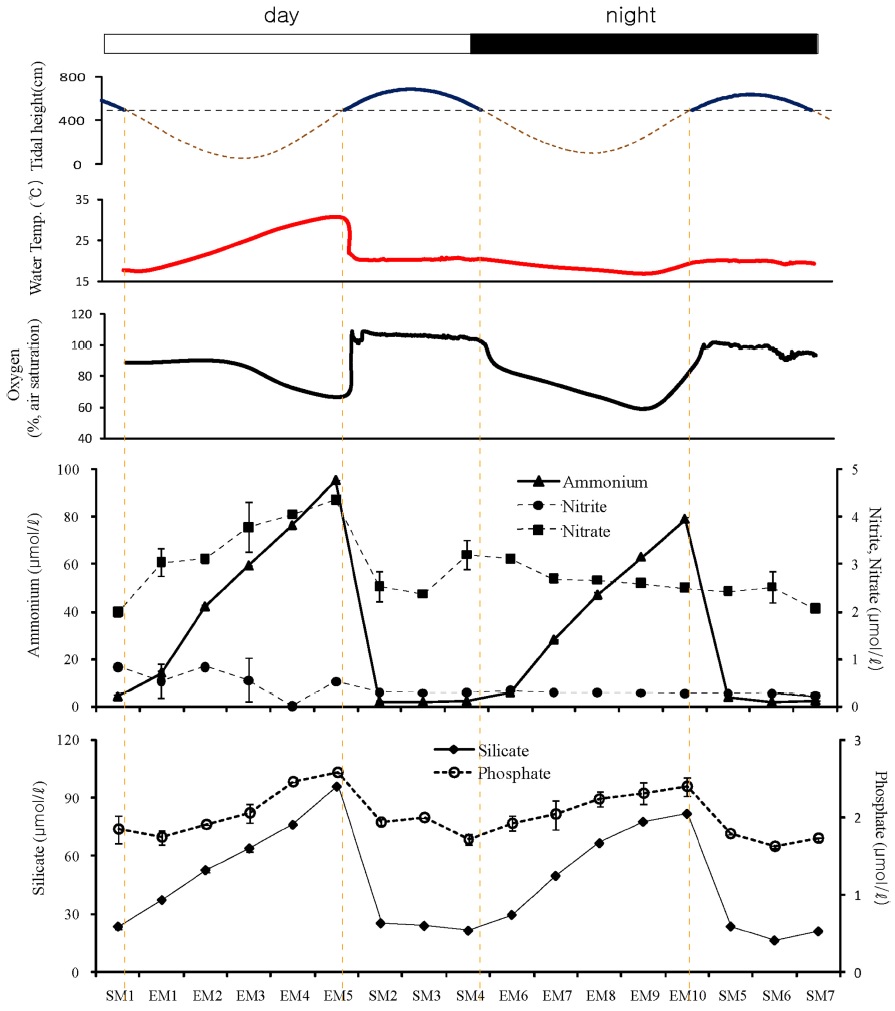
갯벌 상에 흙을 파 웅덩이를 만든 곳(WT)에서의 영양염 변동은 낮과 밤 그리고 노출 시와 침수 시에 뚜렷하게 대비되는 양상을 보였다(Fig. 6). 특히, 암모늄은 낮과 밤 동안의 노출 시에 크게 증가되었다. 낮에는 노출 전 해수에 잠겨져 있을 때와 비교하여 암모늄 농도는 최대 91 μmol/l가 증가하였으며, 밤에는 최대 77 μmol/l 증가되었다. 낮과 밤 동안의 노출시 암모늄의 증가량에는 차이가 있었다. 이 곳은 갯벌 상에 웅덩이(부피 47 l)를 만들어 놓은 곳이기 때문에 해수 침범 시에는 노출시에 생성된 영양염이 해수에 희석된다. 그래서 이러한 큰 농도의 변화가 나타난다. 그러나 질산염의 경우는 낮에는 암모늄 농도 증가와 함께 노출시에 꾸준히 증가하였으나, 밤 동안의 노출시에는 오히려 감소하였다. 아질산염의 농도는 조사기간 동안 큰 변화를 보이지 않았다. 인산염과 규산염의 농도도 노출 시에 크게 증가하였으나, 낮에 비해 밤 동안에는 그 증 가폭이 축소되었다. 수온은 낮 동안의 노출시에는 노출 직전과 비교해 최대 12 oC 증가하였으며 밤 동안에는 오히려 노출 시에 3 oC 정도 감소되었다. 용존산소 농도는 낮과 밤 동안의 노출 시에 밀물 시에 비해 약 30%까지 감소하였다.
Diurnal variations of nutrients and environments with tide at WT site (a pool scooped out on tidal flat). SM and EM represent periods of submergence and emergence, respectively.
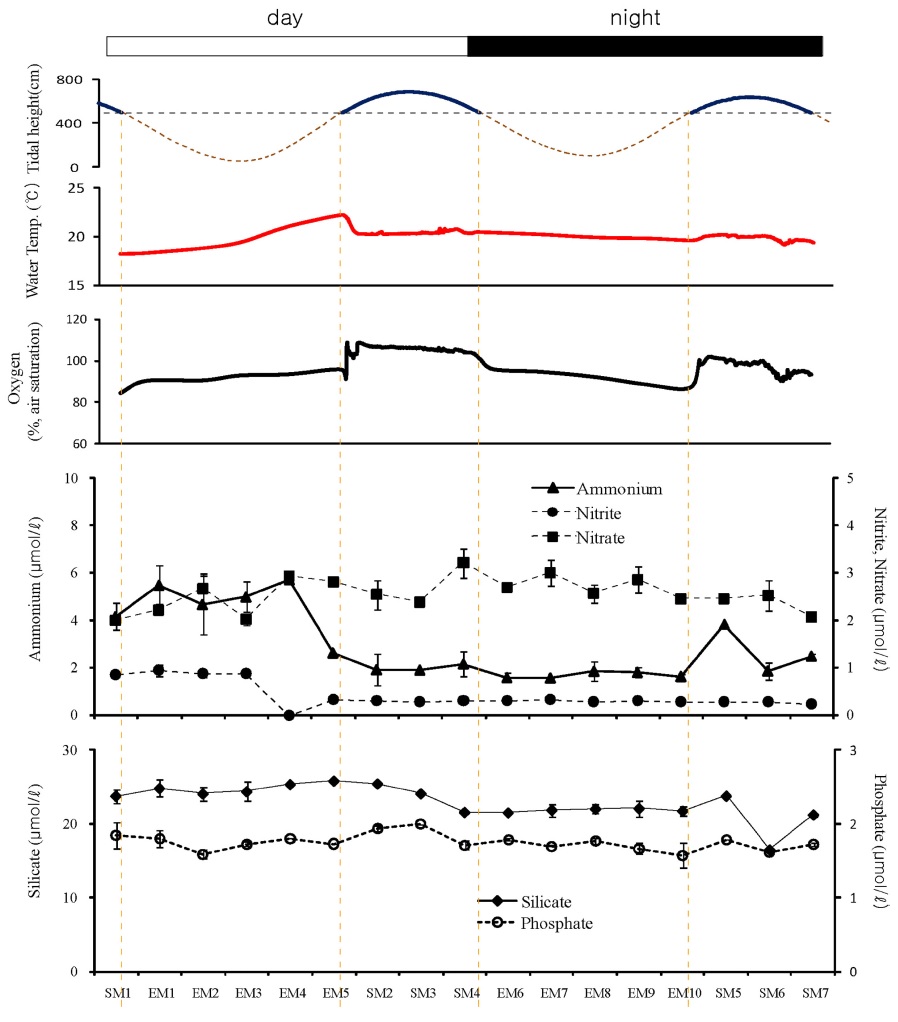
가재붙이(L. astacina)의 서식굴 내 25 cm 깊이(LC)에서 측정한 영양염의 변동 양상은 두 지역에서 보인 양상과는 또 다른 것이었다. 암모늄의 농도는 낮 동안의 간조시에는 WT에서와 마찬가지로 크게 증가하였으나 밤 동안의 노출시에는 그러한 증가 양상을 보이지 않았다(Fig. 7). 또한 질산염의 변동 패턴에서도 WT와는 차이를 보였다. 낮 동안의 간조시 서식굴 내 질산염 농도는 EM3 까지는 증가하였으나 이후 다시 감소하는 경향을 보였으며, 질산염의 감소와 함께 아질산염의 농도는 증가하는 경향을 보였다. 이는 굴내 산소 농도와 연관되어 있는 것으로 판단되었다. 산소농도 약 40%를 기준으로 그러한 농도 증가와 감소 현상이 있었다. 낮 동안의 침수시기에도 암모늄과 질산염의 농도는 증가한 후 감소하는 경향을 보였다. 밤 동안의 노출시에는 암모늄 농도의 큰 증가 없이 질산염의 농도는 증가하는 경향을 보였다. 인산염과 규산염의 변동도 WT에서와는 다른 패턴을 보였다. 특히, 인산염의 경우에는 낮 동안의 노출시에 오히려 농도가 감소되었으며, 밤에는 큰 변화를 보이지 않았다. 규산염의 경우에는 두 번의 노출시에 모두 굴 내에서 증가하였다. 서식굴 내 수온은 노출시 낮 동안에는 18.5 oC에서 해수 침범 직전에는 24.5 oC로 약 6 oC 증가하였으며, 밤 동안의 노출시에는 20.3 oC~18.9 oC로 변화 폭이 작았다. 그리고 낮 동안의 해수 침범시에는 산소농도가 100%까지 증가되었으나 밤에는 60% 정도까지 증가되었다.
3.2 영양염 플럭스
영양염의 농도 변화는 노출과 침수, 그리고 주간과 야간에 따라 상이한 분포를 보였으며, 해수 유입시와 유출시에도 다른 경향을 보였다. 따라서 영양염 플럭스는 주간과 야간의 노출시와 침수시, 그리고 침수기간 동안의 해수 유입 시기와 해수 유출 시기를 구분하여 계산하였다. 이때는 각 시기별 영양염 농도 변화, 부피, 시간을 고려하여 계산하였다. 갯벌 상에 설정한 웅덩이(WT)에서의 플럭스 양과 가재붙이 서식굴(LC)에서의 영양염 플럭스 양을 비교하였다(Table 1). 암모늄, 질산염, 용존무기질소, 인산염, 규산염은 모두 갯벌 퇴적물(WT)에서 생성되어 유출되는 플럭스를 보였다. 특히, 암모늄과 규산염의 유출 플럭스가 상대적으로 컸다. 암모늄, 질산염, 아질산염을 합친 용존무기질소의 플럭스는 9.986 mmol m-2 day-1 였으며, 이중 암모늄이 9.845 mmol m-2day-1로 가장 많은 부분을 차지하였다. 질산염의 경우에는 0.058 mmol m-2day-1로 암모늄에 비해 낮은 값을 보였다. 규산염도 7.453 mmol m-2day-1로 많은 양이 해수로 유출되었다. 조사지역 갯벌에서의 인삼염 플럭스는 상대적으로 낮았다.
갯벌 퇴적물(WT)에서의 영양염 플럭스는 낮과 밤 동안에 차이를 보였다. 인산염을 제외하고는 모두 낮 동안의 플럭스가 밤에 비해 높았다. 그리고 해수에 침범되었을 때는 노출되었을 때와 비교하여 낮은 플럭스를 보였다. 침수기간 동안 중 해수가 유입되는 시기와 해수가 빠지는 동안의 플럭스는 방향이 반대인 경우가 많았다. 무기질소 요소들은 해수가 빠지는 시기에는 해수로 유출되는 양이 많았으나, 해수가 유입되는 동안에는 반대로 퇴적물로 유입되는 양이 있었다. 인산염의 경우에는 해수가 들고 남에 따라 큰 차이를 보이지는 않았다. 규산염의 경우에는 노출시에 퇴적물로부터 많은 양이 생성되어 해수로 유출되었으나, 물에 잠긴 동안에는 퇴적물로 유입되는 양이 많았다.
가재붙이(L. astacina) 서식굴(LC)에서의 암모늄, 용존무기질소, 규산염은 낮 동안에 대부분이 해수로 유출되었으며, 밤에는 플럭스 양이 WT와 비교해 상당히 적었다. 가재붙이(L. astacina) 한 개 서식굴로부터 유출되는 암모늄과 용존무기질소는 갯벌 퇴적물의 약 1/4 정도였다. 그러나 질산염의 경우에는 가재붙이 서식굴을 통한 플럭스가 갯벌 상에서의 그것 보다 더 많았다. 가재붙이 서식굴을 통한 규산염의 플럭스는 갯벌 상에서 보여지는 플럭스의 약 70%를 차지하는 많은 양이었다. 인산염은 가재붙이 서식굴 내에서 퇴적물로 유입되는 플럭스를 보였다. 가재붙이 서식굴 내 영양염 플럭스는 갯벌 퇴적물에서의 경향과 달리 노출 기간 보다는 침수 기간 중에 더 높았다. 특히 이런 경향은 낮 동안에 더 뚜렷하였다(Table 1).
Daily nutrient fluxes from a Laomedia burrow (LC) and the tidal sediment (WT) in Geunso tidal flat. Negative values indicate influx and positive values mean efflux. *: tidal period of water level ascended, **: tidal period of water level descended. ***: Average density (6 ind.m-2) of Laomedia astacina in the study site was applied
4. 고 찰
4.1 영양염의 일변화
아크릴에 의해 퇴적물과 접촉되지 않았던 해수(WA)에서는 하루 중 영양염 농도의 변화가 거의 없었다(Fig. 5). 단지, 낮 동안의 노출 시기에는 다른 때와 비교해 암모늄의 농도가 약간 높았다. 낮 동안의 증가된 수온의 영향으로 미생물에 의한 유기물 분해가 증가되면서 암모늄의 농도도 증가된 것으로 판단된다. 그러나 갯벌 상의 해수가 고인 웅덩이(WT)와 가재붙이(L. astacina) 서식굴(LC) 내에서는 노출시와 침수시 그리고 낮과 밤 사이에는 뚜렷한 영양염 농도의 차이가 있었다. 특히, 암모늄은 노출시와 침수시 간에 큰 농도 차이를 보였으며, 노출시기 동안의 비교에서는 밤에 비해 낮 동안에 농도가 더 증가되었다. 노출과 침수 동안의 차이는 해수에 의한 희석과 가재붙이 서식굴을 통한 관개활동 때문이었다. 퇴적물내에서 암모늄은 유기물 분해와 생물 배설에 의해 공극수에 축적되고 확산에 의해 해수로 용출된다. 퇴적물 내에서는 산소량과 온도에 따라 암모늄화(ammonification), 질산화(nitrification), 탈질산화(denitrification) 중 어느 작용이 활발하게 일어나는지가 결정되며, 온도가 높고 용존산소 농도가 낮을 때 암모늄의 생성이 활발하게 일어난다(Cowan [1996]). 밤 동안의 암모늄 농도 증가 폭의 감소는 하강한 온도의 영향으로 미생물의 활동성이 감소되어 나타난 것으로 해석된다.
그러나 WT와 LC 간에는 암모늄 및 질산염 농도의 시간에 따른 차이가 있었다. WT의 경우에는 낮 동안의 노출시기 동안에 암모늄의 증가와 함께 질산염의 농도도 증가하는 경향을 보였으며, 밤에는 암모늄의 농도는 증가함에 비해 질산염 농도는 감소하는 경향이 있었다. 낮 동안에는 고여진 해수에서 일차생산자에 의해 산소가 공급되었고(Fig. 6) 이에 따라 질산화 작용이 활발하게 일어났으나, 밤에는 해수 중의 산소가 빠르게 소비되면서 질산화가 덜 일어나 질산염 농도의 밤과 낮의 차이가 발생한 것으로 여겨진다. 한편, LC에서는 보다 복잡한 프로세스가 있었다. 낮 동안의 노출 기간 중 산소 농도가 40% 이상으로 유지되었던 때는 질산화에 의해 질산염의 농도가 증가하였으나 굴 내 산소가 감소되면서 질산염 농도의 감소와 아질산염 농도의 증가가 있었다. 퇴적물 내에서 탈질산화 작용은 주로 혐기성 상태에서 일어나며(Canfield et al. [2005]), 때에 따라서는 준호기성(suboxic) 상태에서도 일어난다고 보고되었다(Omnes [1996]). 탈질산화 과정 중에는 질산염의 감소와 함께 아질산염의 증가가 나타난다. 가재붙이 서식굴 내 산소농도가 30% 이하로 감소하면서 탈질산화 작용이 일어난 것으로 판단된다. 밤 동안의 노출시에는 LC에서 또 다른 영양염 거동이 있었다. 낮아진 수온의 영향으로 암모늄의 농도 증가 폭은 줄어들었으나 질산염의 농도는 계속하여 증가하였다. 이는 굴 내 산소 농도와 연관된 것으로 추정된다. 낮 동안에 비해 밤에는 굴 내 산소 농도가 노출시에도 오랫동안 높게 유지되었으며, 이에 따라 질산화가 활발히 일어나 질산염이 증가한 것으로 해석된다.
규산염의 농도변화는 WT와 LC에서 유사한 변동 패턴을 보였다. 갯벌 퇴적물로 유입되는 생물기원 규소(biogenic silica)의 공급원은 부유성 규조류와 저서성 규조류이며, 퇴적된 생물기원 규소는 다른 영양염과는 달리 생물에 의해 분해되지 않고 화학적으로 용해된다(Kim and Kim [2008]). 규산염의 시간에 따른 농도 분포는 암모늄과 유사하게 노출시에 증가하며 침수시에 감소하는 경향이 있었다. 노출시에 퇴적물에서 용해된 규산염이 계속 농축되었다가 해수가 유입되면서 희석되어 나타난 결과였다. 그러나 인산염의 경우에는 WT와 LC에서 시간에 따라 다른 거동 양상을 보였다. WT에서는 노출시에 계속적인 농도의 증가가 낮과 밤에 나타났으나, LC에서는 완만한 감소 이후 다시 증가하는 경향을 보였다. 인산염은 퇴적물 내에서 유기물이 분해되어 인산염이 생성되는 정도와 퇴적물 내에서 철산화물에 흡착하여 제거되는 정도에 따라 농도가 결정된다(Froelich [1988]). 후자의 과정은 산소 농도가 낮은 환원환경에서 일어난다(Canfield et al. [2005]). 즉, 대기에 노출된 초기에는 산소농도가 높으며 밀물시 유입된 해수에 의해 희석되어 농도가 감소한 후, 점차 산소의 고갈과 함께 철산화물로부터 해리되어 농도가 증가되는 것으로 판단된다. 이와 같은 현상은 밤에도 유사하게 나타났으며 농도의 증가 폭은 낮에 비해 낮았다. 가재붙이 서식굴 내 영양염의 농도는 퇴적물 내에서 일어나는 생지화학적 프로세스에 의해 영향을 받았으며 서식굴 내 수온과 용존산소 환경에 따른 일변화를 보였다.
4.2 생물교란이 영양염 플럭스에 미치는 영향
칠게(Macrophthalmus japonicus)와 흰이빨참갯지렁이 (Periserrula leucophryna)의 서식굴을 포함하는 갯벌 퇴적물(WT)과 가재붙이 서식굴(LC)에서의 영양염의 플럭스는 낮과 밤 그리고 노출시와 침수시에 각각 차이가 있었다. 두 지역에서는 전반적으로 밤에 비해 낮 동안에 퇴적물로부터의 영양염 유출이 컸다. 특히, 암모늄을 포함하는 용존무기질소의 플럭스가 그러했다. 일반적으로 연안 환경에서 용존무기질소는 해수 중에서 퇴적물로 유입된다고 보고되었다(Ogilvie et al.[1997]; Magalhấes et al.[2002]; Thornton et al. [2007]). 그러나 연구지역에서는 이와는 다르게 용존무기질소가 퇴적물에서 해수 중으로 유출되었다. 퇴적물로 부터의 용존무기질소의 유출은 생물활동에 의한 퇴적물 교란과 관개활동 때문인 것으로 판단된다(Marinelli[1992]; Rysgaard et al.[1995]). 그리고 낮 동안의 플럭스가 밤에 비해 높은 것은 생물의 활동이 밤에는 감소하기 때문인 것으로 해석된다. 실제로 조사지역의 칠게(M. japonicus)를 포함하는 저서동물은 밤에는 활동을 하지 않았다(Yasuhisa[1984]; personal observation). 또한 밤 동안의 낮아진 수온의 영향으로 미생물 활동성이 낮에 비해 감소하였기 때문에 유기물 분해가 감소된 것으로 여겨진다. 규산염의 경우에도 암모늄과 유사한 플럭스 경향을 보였다. 퇴적물 내에서의 규산염 플럭스도 생물교란의 영향으로 촉진된다고 알려져 있다(Feuillet-Girard et al.[1997]). 낮 동안의 노출시에는 표층 퇴적물에서 흡착되는 규산염 보다 활발한 칠게(M. japonicus)의 퇴적물 교란에 의해 용해되는 양이 많아 해수 중으로 농도가 축적되는 것으로 판단된다. 그리고 낮과 밤의 차이와 침수시와 노출시의 차이도 용존질소나 암모늄과 같이 칠게(M. japonicus)의 행동 특성 때문에 영양염의 플럭스에 영향을 미치는 것으로 판단된다. 갯벌 퇴적물은 일반적으로 인산염의 공급원으로 작용하는 것으로 알려져 있으나(Cowan et al.[1996]), 본 연구에서는 인산염의 유출양과 유입량의 플럭스는 균형을 이루고 있었다. 조사지역이 위치한 근소만은 반폐쇄성 만으로 외부와 연결된 하천이나 강과 같은 큰 유기물 공급원이 없어(Kim and Kim[2008]) 퇴적물로부터 유출되는 인산염의 양이 많지 않은 것으로 판단된다.
노출과 침수 기간 동안의 영양염 플럭스는 칠게(M. japonicus) 등의 서식굴이 있는 갯벌상과 가재붙이(L. astacina) 서식굴 내에서 반대로 나타났다(Table 1). 갯벌 상에서는 노출시에는 퇴적물로부터 영양염이 유출되었으나 침수기 동안에는 대부분이 퇴적물로 유입되었다. 그러나 가재붙이(L. astacina) 서식굴 내에서는 침수기 동안의 시간당 영양염 유출량이 노출시에 비해 더 많았다. 이는 서식하는 생물의 활동과 관련이 있는 것으로 여겨진다. 칠게(M. japonicus)는 주로 갯벌이 노출되었을 시에 활발한 행동을 하며 해수에 침수되었을 때는 포식자로부터의 위협을 피해 굴로 피신한다. 한편, 가재붙이(L. astacina)는 산소가 충분히 공급되는 밀물시기에 굴 내에서 활발한 관개활동을 한다. 이러한 생물의 생태적 특성 차이가 서식지별 영양염 플럭스에 영향을 주는 것으로 판단된다. 그러나 가재붙이(L. astacina) 굴에서도 밤에는 영양염이 퇴적물로 유입되었다. 이는 앞에서 설명한 것처럼 미생물의 활동성 감소와 가재붙이(L. astacina)에 의한 관개활동의 감소와 연관된 것으로 추정된다. 낮과 밤 동안의 해수 침수시 가재붙이(L. astacina) 서식굴의 관개에는 차이가 있었다. 낮에 비해 밤의 서식굴 내 산소농도는 현저히 낮았으며(Fig. 7), 이러한 요인이 영양염의 플럭스에 영향을 미친 것으로 해석된다.
WT에서의 영얌염 플럭스 결과는 이곳 퇴적물에 서식하는 칠게(M. japonicus)와 흰이빨참갯지렁이의(P. leucophryna) 서식굴과 함께 갯벌 표층에서 유출입 양을 함께 포함하고 있다. 이와는 달리 LC의 경우에는 가재붙이 서식굴 내부를 통해 유출입 되는 양 만을 포함한다. 그럼에도 불구하고 가재붙이 굴을 통한 하루 동안의 플럭스 양은 WT의 플럭스 양과 비교해 23~224% 범위에 있었다. 이는 큰 굴을 가지며 활발하게 관개활동을 하는 생물의 서식굴이 갯벌퇴적물과 해수 간의 영양염 순환에 보다 중요한 의미를 가질 수 있음을 시사한다.
본 조사지역과 동일한 지역에서는 각각 다른 방법에 의해 갯벌퇴적물에서의 영양염 플럭스가 계산되었다. Kim and Kim[2008]은 10 cm 깊이까지의 현장 퇴적물을 저층챔버(benthic chamber)에 놓고 실험실에서 12시간 배양하며 계절별로 영양염의 플럭스를 계산하였으며, 현(unpublished data)은 미세전극을 이용하여 퇴적물 내 깊이별 농도차이에 의한 확산계수를 이용하여 암모늄 플럭스를 계산하였다(Table 2). 본 조사 결과와 비교하여 이들 자료에서 보인 영양염 플럭스는 크게 작았다. 이러한 차이는 생물활동이 영양염 플럭스에 미치는 영향에 대한 고려 정도에서 기인하는 것으로 여겨진다. 대상지역 갯벌에는 가재붙이(L. astacina), 칠게(M. japonicus), 흰이빨참갯지렁이(P. leucophryna) 등 서식굴을 가진 대형저서동물이 우점하고 있다. 그럼에도 불구하고 두 측정 방법에서는 이들 생물활동에 의한 효과가 고려되지 않았거나 혹은 얕은 표층 근처에 서식하는 생물 만을 고려하였기 때문에 생물교란에 의한 영양염의 플럭스를 제대로 반영하지 못하고 있다. 본 조사에서는 생물 활동의 결과로부터 플럭스되는 영양염을 직접 측정하였기 때문에 그 결과는 실제 갯벌에서 나타나는 영양염 플럭스와 보다 가까운 것이라 판단된다. 그러나 실제로 대부분의 영양염 플럭스 관련된 연구는 지금까지 상기에서 언급한 두 방법에 의해 측정되어 왔다. 이는 퇴적물을 교란하지 않으면서 생물활동을 고려한 현장 측정을 하기가 어렵기 때문이었다. 이러한 사실로부터 많은 연구에서 발표된 영양염 플럭스 관련 결과는 자연에서 일어나는 사실 그대로를 담고 있지 못하며 대부분은 실제 보다 크게 과소평가되어 있다고 할 수 있다. 특히, 가재붙이(L. astacina)와 같이 큰 규모의 서식굴을 가지는 종이 갯벌 퇴적물의 영양염 순환에 미치는 영향이 지대함에도 불구하고 고려되지 못했기 때문에 더욱 그러하다. 이러한 이유로 본 연구의 결과는 중요한 의의를 가진다.

Comparison of nutrient fluxes from different kinds of measurements investigated in this study area of Geunso tidal flat. Negative values indicate uptake by sediments and positive values mean release from sediments
본 연구에서 가재붙이 서식굴을 통한 영양염 플럭스 결과는 서식굴 내 25 cm 깊이의 영양염 측정값으로부터 수층과의 농도 차이에 의해 계산되었다. 영양염이 표층으로 확산, 이류되는 과정에서 필연적으로 여러 생지화학적 프로세스를 겪을 것으로 예상된다. 따라서 이는 실제 갯벌 퇴적물 표층에서의 퇴적물-수층 간 플럭스를 대표하기에는 다소 부족한 결과이다. 그러므로 본 연구의 결과는 가재붙이 서식굴을 통한 영양염 플럭스를 대표하는 값 이라기보다는 기여한 값으로 판단하는 것이 타당할 것이다.
Acknowledgments
본 연구는 한국해양과학기술원(PE99605)과 한국연구재단(PN67620)의 지원을 받아 수행하였습니다. 저자는 영양염 분석에 도움을 준 한국해양과학기술원의 김성한 박사에게 감사를 드립니다.
References
-
Aller, R.C., and Aller, J.Y., (1998), The effect of biogenic irrigation intensity and solute exchange on diagenetic reaction rates in marine sediments, J. Mar. Res., 56, p905-936.
[https://doi.org/10.1357/002224098321667413]

- Canfield, D.E., Thamdrup, B., and Kristensen, E., (2005), Aquatic geomicrobiology, Elsevier Academic Press.
- Cowan, J.L.W., Penock, J.R., and Boynton, W.R., (1996), Seasonal and interannual patterns of sediment-water nutrient and oxygen flux in Mobile Bay, Alabama (USA): Regulating factors and ecological significance, Mar. Ecol. Prog. Ser., 141, p229-245.
- Feuillet-Girard, M., Gouleau, D., Blanchard, G., and Joassard, L., (1997), Nutrient fluxes on an intertidal mudflat in Marennes-Oleron Bay, and influence of the emersion period, Aquat, Living Resour., 10, p49-58.
- Froelich, P.N., (1988), Kinetic control of dissolved phosphate in natural rivers and estuaries: A primer on the phosphate buffer mechanism, Limnol. Oceanogr., 33, p649-668.
- Kemp, W.M., Sampou, P.A., Garber, J., Tuttle, J., Boynton, W.R., (1992), Seasonal depletion of oxygen from bottom waters of Chesapeake Bay: roles of benthic and planktonic respiration and physical exchange processes, Geochim et Cosmochim Acta, 45, p101-121.
- Kim, D., and Kim, K.H., Tidal and seasonal variations of nutrients in Keunso Bay, the Yellow Sea, Ocean and Polar Res., 30, p1-10.
- Koo, B.J., (2017), Burrows of macroinvertebrates in the Korean tidal flat, KIOST, ISBN 978-89-444-9060-6.
-
Koo, B.J., and Koh, C.-H., (2013), Oxygen penetration through invertebrate burrow walls in Korean tidal flat, Ocean Sci. J., 48, p329-338.
[https://doi.org/10.1007/s12601-013-0031-0]

- Kristensen, E., Kostka, J.E., (2005), Macrofaunal burrows and irrigation in marine sediment: microbiological and biogeochemical interactions, In Kristensen, E., Kostka, J.E., R. Haese (Eds.), Interaction between Macro- and Microorganisms in Marine Sediments, American Geophysical Union, Washington, DC, p125-157.
- Magalhấes, C.M., Bordalo, A.A., and Wiebe, W.J., (2002), Temporal and spatial patterns of intertidal sediment-water nutrient and oxygen fluxes in the Douro River estuary, Portugal. Mar. Ecol. Prog. Ser., 233, p55-71.
-
Marinelli, R.L., (1992), Effects of polychaetes on silicate dynamics and fluxes in sediments: Importance of species, animal activity and polychaete effects on benthic diatoms, J. Mar. Res., 50, p745-779.
[https://doi.org/10.1357/002224092784797566]

-
Ogilvie, B., Nedwell, D.B., Harrison, R.M., Robinson, A., and Sage, A., (1997), High nitrate, muddy estuaries as nitrogen sinks: The nitrogen budget of the River Colne estuary (United Kingdom), Mar. Ecol. Prog. Ser., 150, p217-228.
[https://doi.org/10.3354/meps150217]

-
Omnes, P, Slawyk, G., Garcia, N., and Bonin, P., (1996), Evidence of denitrification and nitrate ammonification in the River Rhone plume (northwestern Mediterranean Sea), Mar. Ecol. Prog. Ser., 141, p275-281.
[https://doi.org/10.3354/meps141275]

- Parsons., T.R., Maita, Y., and Lalli, C.M., (1984), A manual of chemical and biological methods for seawater analysis, Pergamon Press.
- Rabouille, C., Dennis, L., Dedieu, K., Stora, G., Lansard, B., and Grenz, C., (2003), Oxygen demand in coastal sediments: comparing in situu microelectrodes and laboratory core incubations, J. Exp. Mar. Biol. Ecol., 285, p49-69.
-
Rysgaard, S., Christensen, P.B., and Nielsen, L.P., (1995), Seasonal variation in nitrification and denitrification in estuarine sediment colonized by benthic microalgae and bioturbating infauna, Mar. Ecol. Prog. Ser., 126, p111-121.
[https://doi.org/10.3354/meps126111]

- Thornton, D.C.O., Dong, L.F., Underwood, G.J.C., and Nedwell, D.B., (2007), Sediment-water inorganic nutrient exchange and nitrogen budgets in the Colne Estuary, UK, Mar. Ecol. Prog. Ser., 337, p63-77.
-
Wahyudi, A.J., Wada, S., Aoki, M., and Hama, T., (2015), Gaetice depressus (Crustacea, Varunidae): Species profile and its role in organic carbon and nitrogen flow, Ocean Sci. J., 50, p389-401.
[https://doi.org/10.1007/s12601-015-0036-y]

- Yasuhisa, H., (1984), The description of wandering behavior and occurrence varying in different tidal areas in Macrophthalmus japonicus (De Haan) (Crustacea: Ocypodidae), J. Exp. Mar. Biol. Ecol., 84, p211-224.
-
Ziebis, W., Forster, S., Huettel, M., and Jørgensen, B.B., (1996), Complex burrows of the mudshrimp Callianassa truncata and their geochemical impact in the sea bed, Nature, 382, p619-622.
[https://doi.org/10.1038/382619a0]