해양환경에서의 수동형 채집기(passive sampler) 활용: 1. 난분해성 유기오염물질(persistent organic pollutants, POPs)
초록
수동형 채집기(passive sampler)는 해양환경에서 자유롭게 용존되어 해양생물이 이용하고, 생물 농축 및 독성에 직접적인 영향을 줄 수 있는 자유용존상 농도(freely dissolved concentration, Cfree)에 대한 정보를 제공한다. 수동형 채집기는 해수 및 퇴적물 공극수 중의 매우 낮은 농도의 오염물질에 대해 검출이 가능하며, 용존상에 포함되는 콜로이드나 용존유기탄소(dissolved organic carbon, DOC)의 간섭 없이 자유용존상 농도를 직접 측정할 수 있다. 또한 노출기간 동안의 오염물질 평균농도를 제시할 수 있다. 본 논문에서는 보다 효율적인 해양환경 관리를 위한 수동형 채집기의 필요성 및 장점에 대해 파악하고, 다양한 해양환경에서 난분해성 유기오염물질을 분석대상으로 한 수동형 채집기가 적용된 연구사례들에 대해 고찰하였다.
Abstract
Passive samplers provide the freely dissolved concentration (Cfree), which exists as a freely dissolved and bioavailable phase in the marine environment and is used by marine organisms and can directly affect bioaccumulation and toxicity. The passive sampler can be used for monitoring of organic contaminants with the very low pg/L concentrations in water and sediment pore water. Using passive sampler, Cfree can be measured directly without interference from colloids or dissolved organic carbon (DOC). This method can provide time-weighted average concentrations during the period of deployment. In this paper, the necessity of a passive sampler was described for more efficient marine environmental management, and the types and principles of passive sampler were presented. We also reviewed various case studies to apply the passive sampler in a various marine environment contaminated with persistent organic pollutants.
Keywords:
Passive Sampler, Freely Dissolved Concentration, Persistent Organic Pollutants, Performance Reference Compounds, Equilibrium키워드:
수동형 채집기, 자유용존상 농도, 난분해성 유기오염물질, 실행보정물질, 평형1. 서 론
퇴적물은 과거와 현재의 오염물질 배출에 의한 영향을 받으며, 중금속 및 유기오염 물질의 저장고 역할을 한다(Di Toro et al.[1991]; Burton[1992]; Ingersoll et al.[1997]; Wenning et al.[2005]; Burgess et al.[2013]). 또한 퇴적물은 재부유, 해수용승, 공극수의 확산 등에 의해 해수 및 수층 오염물질의 거동에 영향을 주기 때문에(Larsson[1985]; Salomons et al.[1987]; Burgess and Scott[1992]), 해양환경 및 생태계 수질관리에 있어서 매우 중요한 역할을 하고 있다. 해수 중 유기오염물질 농도는 미량으로 존재하며, 매우 낮은 농도에도 불구하고 해양생물과 인간에게 심각한 위해성을 나타낼 수 있어 일부 유기오염물질의 경우 해수 중 잔류농도를 규제하고 있다(EU[2000; 2013]). 따라서 다양한 해양환경에서 보다 정확한 오염물질 관리를 평가하기 위해서는 보다 신뢰성 있는 해양환경 모니터링 방법의 개발이 필요하며, 이를 통해 해양환경 중의 오염물질 거동, 생물이용성 및 생물축적에 대한 정확한 이해가 가능하게 된다.
PCBs(polychlorinated biphenyls) 및 PAHs(polycyclic aromatic hydrocarbons)를 포함하는 난분해성 유기오염물질(persistent organic pollutants, POPs)은 친지성으로 인해 해양환경 중에서 주로 입자상과 결합되어 있으며, 일부는 용존상인 콜로이드 및 용존유기탄소(dissolved organic carbon, DOC)와 결합하여 존재한다. 나머지는 물속에서 자유롭게 용존되어 생물들에게 이용되어질 수 있는 부분 즉, 자유용존상 농도(freely dissolved concentration, Cfree)로 존재할 수 있으며, 이 부분은 실제로 생물에 이용되어 생물농축 및 독성에 영향을 줄 수 있다(Di Toro et al.[1991]; Schwarzenbach et al.[2003]; Lohmann et al.[2004]; Burgess et al.[2013]; Mayer et al.[2014]). 또한 자유용존상 농도(Cfree)는 오염물질의 화학적 활성도와 직접적인 상관관계가 있어 해수 및 퇴적물 공극수 내의 오염물질로부터 해양생물로의 오염물질의 확산 및 축적을 예측할 수 있다.
해수에서 자유용존상 농도(Cfree)를 측정하기 위한 기존의 방법은 여과를 통해 입자상을 제거한 후 용존상 농도를 측정하는 것이다. 하지만 이러한 방법의 경우 용존상에 포함되어지는 콜로이드, DOC의 영향으로 인해 측정되어진 용존상 농도는 자유용존상 농도(Cfree)를 과대평가(overestimated)하게 된다. 또한 퇴적물 공극수에서 자유용존상 농도(Cfree)를 측정하기 위해서는 퇴적물을 원심분리 또는 압착 탈수하는 추가 단계가 필요하며, 검출한계 이상의 농도를 측정하기 위해서는 충분한 양의 공극수가 필요하다. 따라서 기존의 실험방법으로는 해수나 퇴적물 공극수에서 자유용존상 농도(Cfree) 측정이 쉽지 않았다. 하지만, 최근에는 보다 간단하고 정확한 자유용존상 농도(Cfree)측정을 위해, 평형분배의 원리를 이용한 수동형 채집기(passive sampler)가 고안되었다(Booij et al.[1998]; Mayer et al.[2000]; Jonker and Koelmans[2001]; Fernandez et al.[2009]; DiFilippo and Eganhouse[2010]; Mayer et al.[2014]; Ghosh et al.[2014]).
일반적으로 퇴적물의 생물/생태학적 영향을 평가하기 위해서는 퇴적물 내의 오염물질 총농도를 사용하였다(Long and Chapman[1985]). 하지만 이는 퇴적물 조성변화나, 퇴적물과 공극수간 오염물질 분배와 같은 다양한 특성들을 모두 반영할 수는 없으며, 실제로 모래/니질의 조성비, 유기탄소, 블랙카본(black carbon) 및 수트(soot)등과 같은 퇴적물의 특성은 퇴적물, 부유물질, 생물 및 수층사이에서 오염물질 분배에 많은 영향을 준다. 그러므로 퇴적물에서 오염물질 총농도가 동일할지라도 오염물질의 이동성, 생물이용성, 생물축적에 있어서 큰 차이를 보여 생물독성이 완전히 다르게 나타나는 경우가 있다(Adams et al.[1985]; Di Toro et al.[1991]). 이러한 한계점을 극복하기 위해 퇴적물 특성을 고려하여 퇴적물 내의 유기탄소로 보정되어진 오염물질의 농도(organic carbon-normalized concentration, COC)를 총농도 대신 활용하고 있다. 최근에는 평형분배의 원리를 활용한 수동형 채집기를 이용하여 퇴적물 특성뿐만 아니라 생물독성에 영향을 주는 생물이용성 농도를 측정하여 해양환경관리에 적용하려는 노력이 활발하게 시도되고 있다.
현재, 수동형 채집기는 해양뿐만 아니라 대기에서도 자유용존상농도(Cfree)측정에 폭넓게 적용되고 있으며, 퇴적물 오염이 심각한 지역에서는 오염물질의 노출과 그에 따른 잠재적인 악영향을 평가하는데 사용되고 있다(U.S. EPA[2012; 2017]). 따라서 본 논문에서는 보다 효율적인 해양환경 관리를 위한 수동형 채집기의 필요성 및 장점에 대해 파악하고, 난분해성 유기오염물질을 대상으로 해양환경에서 수동형 채집기가 적용된 다양한 사례들에 대해 고찰하였다.
2. 수동형채집기의 종류
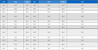
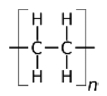
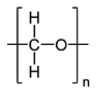
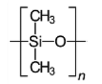
수동형 채집기는 소수성 물질의 유기 중합체(polymer)이며, 자유용존상 농도(Cfree)를 측정하기 위해 지난 20년간 급속도로 개발되어져 해양 분야에 적용되기 시작하였다(Adams et al.[2007]; Lao et al.[2016]). 현재 해양환경에 사용되어 지고 있는 수동형 채집기는 중금속과 난분해성 유기오염물질 분석용으로 구분할 수 있으며, 대표적인 중금속 분석용 수동형 채집기로는 DGT(diffusive gradients in thin films)가 있으며, 해수, 퇴적물 및 해양생물을 비롯한 다양한 해양 환경에 적용되어 가장 널리 활용되고 있다(Peijnenburg et al.[2014]; Dong et al.[2015]). 난분해성 유기오염물질을 분석대상으로 한 초기의 수동형 채집기로는 저밀도폴리에틸렌(low density polyethylene, LDPE) 이중막 사이에 트리올레인(triolein)을 채운 반투과성막 장치(semi-permeable membrane devices, SPMDs)가 있다(Huckins et al.[1990]). SPMDs의 경우 실제현장에 노출 시 LDPE가 쉽게 찢어져 트리올레인의 회수가 어려워 정확한 부피 측정이 불가능한 단점이 있어, 현재는 잘 사용되어지지 않고 있다. 이후 최근에는 이중막 형태가 아닌 단일 필름 형태의 LDPE, 폴리옥시메틸렌(polyoxymethylene, POM), 및 폴리디메틸실록산(polydimethylsiloxane, PDMS)과 같은 유기 중합체들이 널리 사용되고 있다. 현재 가장 많이 사용되고 있는 난분해성 유기오염물질 분석용 수동형 채집기의 종류 및 특징을 Table 1에 나타내었다.
일반적으로 사용되고 있는 수동형 채집기는 분석대상 화합물질에 따라 상업화 된 제품(DGT 및 POCIS)이 있는 경우도 있지만, 본 연구의 분석대상물질인 난분해성 유기오염물질 분석용 수동형 채집기는 상업화된 제품이 없으며, 현장에 노출할 경우 분석자의 의도에 따라 유기 중합체를 장착할 수 있는 틀을 자체 제작하여 사용하고, 실험실 실험을 실시할 경우 유기 중합체 자체를 사용한다. 따라서 본 연구에서 언급하고 있는 수동형 채집기는 분석대상 물질을 흡수할 수 있는 유기중합체를 말하며, 이에 대해서만 설명하고자 한다. 난분해성 유기오염물질 분석용 수동형 채집기들은 대부분 가격이 매우 저렴하고, 크기 및 모양 변형이 가능한 장점이 있다. 일반적으로 LDPE와 POM은 15~100 μm 두께의 얇은 막 형태로 주로 사용되어지며, PDMS의 경우, 대부분 직경 100 μm 이상의 유리섬유에 10~100 μm 두께로 코팅되어진 바늘형태로 1~10 cm 길이로 사용되어지거나(solid phase microextraction, SPME), 필름형태로 사용되어진다. LDPE와 POM은 분석대상물질의 검출한계에 따라 중합체의 양을 조절할 수 있어 해수와 퇴적물 적용이 용이하지만, PDMS의 경우, 다른 수동형 채집기에 비해 코팅되어진 중합체 양이 매우 작아 오염물질의 농도가 높은 퇴적물에 사용되어진다(Vrana et al.[2005]; U.S. EPA[2012]). 이 외에도 silicon rubber 및 poly(methyl methacrylate) 등이 수동형 채집기로 사용되어지고 있으며 (Smedes[2007]; Prokes et al.[ 2012]; Lao et al.[2016]), 농약 및 의약품과 같은 극성(친수성)의 유기오염물질 분석을 위한 수동형 채집기로는 POCIS(polar organic chemicals integrative samplers)가 사용되고 있다(Criquet et al.[2017]).
3. 수동형 채집기의 원리
수동형 채집기를 해수 혹은 퇴적물 에 노출시켜 일정 시간 경과하면 두 개의 상 사이에 오염물질 농도가 평형에 도달하게 된다(식 1). 수동형 채집기에 흡수된 오염물질(CPS)은 추출 및 정제 단계를 거쳐 측정되어지고, 난분해성 유기오염물질의 자유용존상 농도(Cfree)는 수동형 채집기에서의 오염물질 농도(CPS)와 분배계수(KPS)로부터 계산되어진다(식 2). 수동형 채집기의 원리는 Fig. 1과 같이 나타낼 수 있으며, 수동형 채집기와 환경 매질 간에는 물질교환에 의해 열역학적으로 조절되는 평형분배가 이루어진다. 수동형 채집기는 확산에 의해 흡수되어진 오염물질을 축적하고, 이는 1차 반응 모델식에 의해 다음과 같이 나타내어진다.
| (1) |
| (2) |
CPS: 특정시간 또는 평형일 때 수동형 채집기에서의 오염물질 농도(ug/g)
k1, k2: 오염물질의 흡수 및 탈착 계수(1/d)
KPS: 수동형채집기와 물간의 분석대상물질의 분배계수(L water/Kg passive sampler)
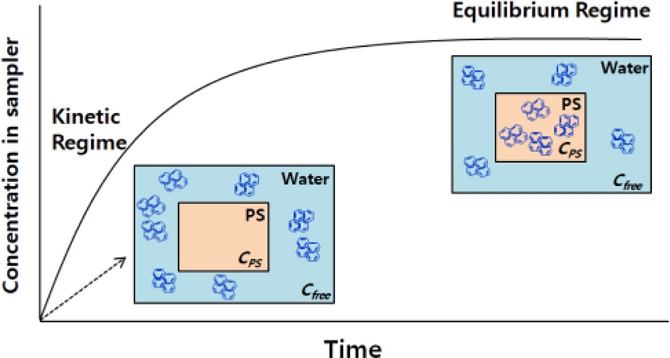
Simplified scheme of Cfree uptake by passive sampler (PS) and operating modes of passive sampler (kinetic (uptake) and equilibrium regime).
위와 같이 평형 또는 비평형 조건의 수동형 채집기로부터 자유용존상 농도(Cfree)를 계산할 수 있다. 평형(equilibrium) 조건에서의 자유용존상 농도(Cfree)는 직접 측정되어진 KPS값이나 기존 문헌에서 보고되어진 POM, PDMS 및 LDPE의 KPS값을 이용하여 식 (2)으로부터 얻어질 수 있다.
수동형 채집기의 성공적인 활용을 위해서는 다음의 요인들을 고려하여야 한다. 첫째, 수동형 채집기와 다양한 해양환경 매질 간(퇴적물 공극수, 해수, 생물)에는 평형에 도달해야한다. 소수성이 높은 화합물(예; log Kow > 6)의 경우 평형에 도달하는 시간이 수주에서 일년까지 요구되기도 하지만(Mayer et al.[2000]; Gschwend et al.[2011]; Apell and Gschwend[2014]), 상대적으로 소수성이 낮은(log Kow < 4) 화합물의 경우 보다 빠르게 평형상태에 도달한다. 평형 도달시간은 대상물질의 소수성 정도뿐만 아니라, 사용되는 수동형 채집기의 재질이나 두께의 영향을 받는다. 일반적으로 보다 얇은 두께를 가지는 25 μm LDPE나 PDMS가 코팅된 SPME는 현장(in situ) 퇴적물 노출실험에 있어서 분석대상물질이 수일에서 수주사이에 상대적으로 빨리 평형에 도달하지만, 보다 두꺼운(500 μm 이상) POM과 LDPE의 경우 분석대상물질이 평형에 도달할 때까지 더 많은 시간(수주~수개월)을 필요로 한다. 퇴적물의 경우 현장(in situ) 실험에서 평형도달 시간 단축을 위해 현장퇴적물을 실험실로 옮겨와 실험실 실험(ex situ)을 수행하여 오염물질의 흡수속도를 증가시킬 수 있으며, 이를 위해 퇴적물을 슬러리(slurry) 상태로 만들어 교반시켜 주고, 이때 수동형 채집기와 매질간의 경계층(boundary layer)이 줄어들면서 확산속도가 증가하여 빠르게 평형에 도달하게 된다. 따라서 수동형 채집기의 최적조건(예; 중합체 종류, 크기, 모양 및 두께)과 적절한 실험/환경조건을 활용하면 보다 빠르게 평형에 도달하게 되어 상대적으로 단기간의 노출에도 자유용존상 농도(Cfree) 측정이 가능하다.
한편, 긴 평형도달이 요구되어지는 일부 화합물의 경우, 실제 해양환경에서 수동형 채집기가 장기간 노출됨에 따라 부착생물에 의한 분석대상물질의 흡수 저해가 발생할 수 있다(Richardson et al.[2002]; Liu et al.[2014]). 이와 같이 현장에서는 평형에 이르지 못하는 경우가 발생하며, 이러한 비평형 상태(kinetic regime)에서도 자유용존상 농도(Cfree)를 구해야 하는 경우도 있다(Mayer et al.[2003]; Vrana et al.[2005]; Apell et al.[2015]). 이러한 경우, 현장(in situ)이나 실험실 실험(ex situ)에서 수동형 채집기를 노출하기 전 수동형 채집기에 실행보정물질(performance reference compound, PRC)을 미리 흡수시킨 후 노출하고, 일정 시간 경과 후 잔류한 PRC의 양으로부터 평형도달정도(fractional equilibration, f) 혹은 교환율 계수(exchange rate coefficient, ke)를 계산하여 평형상태일 때의 오염물질 농도를 구할 수 있다. 비평형 상태일 때, 수동형 채집기에 미리 흡수되어진 PRC는 분석대상 오염물질과 유사한 물리화학적 특성(예; 몰 부피, 확산, 분배계수)을 가지는 화합물을 사용한다. 그러므로 수동형 채집기에서 PRC의 제거속도와 오염물질의 흡수속도는 동일하다는 가정 하에 평형상태에서의 오염물질 농도를 예측할 수 있다. 평형도달 정도는 다음과 같은 식 (3)에 의해 PRC를 통해서 계산되어 질 수 있다(Fernandez et al.[2012]; Friedman et al.[2012]).
| (3) |
C0PRC: 초기에 넣어준 PRC 농도
CtPRC: 특정 시간 이후의 PRC 농도
수동형 채집기에서 PRC가 빠져나가는 것은 1차 반응식으로 나타낼 수 있으며, 이를 지수 모델(Adams et al.[2007])을 이용하여 로 나타낼 수 있다.
| (4) |
여기서 ke는 1차 반응 교환율계수이며, 최종적으로 비평형 상태에서 식 (3)을 이용하여 f를 구한 후 식 (4)와 식 (2)를 이용하여, 평형일 때의 자유용존상 농도(Cfree) 값을 계산할 수 있다.
둘째, 현장 퇴적물을 활용한 실험실 실험(ex situ)의 경우 퇴적물의 총농도에 있어서 큰 변화가 없어야 하며, 이 조건을 “no depletion”이라고 한다. 실험실 실험(ex situ)에서는 퇴적물에서 수동형 채집기로 오염물질이 이동하는 양이 퇴적물 내 오염물질의 총 양에서 무시할 정도(1% 이하)가 되어야 한다. 만약 이보다 더 많은 양의 오염물질이 수동형 채집기로 이동하였다면 depletion 상태로 정의할 수 있으며, 이렇게 되면 자유용존상 농도(Cfree)를 과소평가하게 된다. 따라서 기존 연구에서는 퇴적물 시스템에서 수동형 채집기에 의한 화학물질의 고갈(depletion)은 최대 5% 이하로 유지하도록 하였다(Jonker and Koelmans[2001]; Mayer et al.[2003]; Ghosh et al.[2014]).
4. 수동형 채집기 장점
수동형 채집기는 다음과 같은 장점이 있다. 첫째, 해수에서 매우 낮은 농도(pg/L) 수준의 물질도 검출이 가능하다. 수동형 채집기는 재질의 특성상 소수성 오염물질만 선택적으로 흡수하므로 해양생물 내의 지방과 같은 고분자 화합물이나 퇴적물에 포함된 황과 같은 방해물질을 흡수하지 않아 연안 해수를 포함한 초저농도의 외해 해수에서도 오염물질의 검출이 가능하다(Lohmann et al.[2013]; Booij et al.[2014]). 이러한 장점을 활용한 연구사례로는 대서양을 횡단하며 표층해수에서 수동형 채집기 polyethylene을 이용하여 수 pg/L 수준의 PAHs 자유용존상 농도(Cfree)를 측정한 연구가 사례가 있다(Lohmann et al.[2013])(Fig. 2).
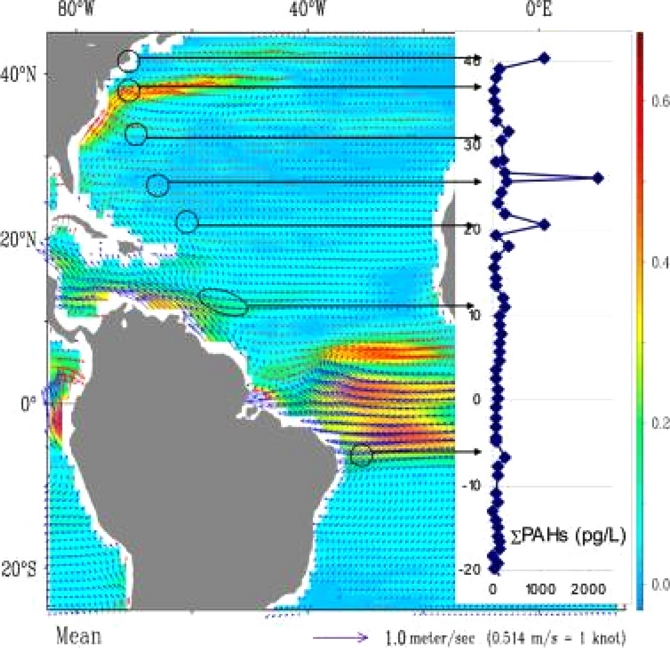
PAH concentration (pg/L) in seawater across the Atlantic ocean (Adapted from Lohmann et al. [2013], Environ. Sci. Technol., 47(6), 2570-2578, with permission of American Chemical Society).
둘째, 수동형 채집기를 이용하면 콜로이드나 용존유기탄소의 간섭 없이 해수의 자유용존상 농도(Cfree)를 직접 측정할 수 있다. 해수중에 존재하는 용존상 오염물질(Cdissolved)들은 용존유기탄소(CDOC), 콜로이드(Ccoll), 그리고 자유용존상(Cfree)으로 존재한다. 해수 중 오염물질의 자유용존상 농도(Cfree)를 측정하기 위해 기존의 평형분배모델 적용시에는 여과를 통해 용존상에서의 오염물질 농도(Cdissolved)를 측정한 후 용존유기탄소와 물간의 분배계수(KDOC-w)와 용존유기탄소함량(mDOC)을 이용하여 구한 용존유기탄소에서의 오염물질농도(CDOC)를 용존상 오염물질농도(Cdissolved)에서 제외함으로써 자유용존상 농도(Cfree)를 계산할 수 있었다(Kim and Kwon[2018]). 이러한 과정은 다량의 해수를 채수하고 여과, 농축 및 용존유기탄소 측정 등의 매우 복잡하고 오랜 분석시간을 필요로 한다. 그러므로 수동형 채집기는 이러한 단계를 필요로 하지 않으므로 분석시간뿐만 아니라, 분석비용을 대폭 절감할 수 있다.
셋째, 노출기간 동안 오염물질의 평균농도를 측정할 수 있다. 기존의 채수기를 이용하여 해수 내 오염물질을 분석하면 해수를 채취하는 특정시간대의 오염 수준에 대한 정보만을 제공하므로 월 혹은 계절의 대푯값으로 사용하기에는 한계가 있다. 하지만 수동형 채집기를 활용하면 연구지역에 하루부터 수개월까지 설치함에 따라 시간에 따른 오염물질의 평균 농도를 제시할 수 있는 장점이 있다(Chen and Pawliszyn[2003], U.S. EPA[2012]).
넷째, 수동형 채집기는 퇴적물 내 오염물질의 화학적 활성도(chemical activity)를 측정할 수 있다. 퇴적물에서 자유용존상 농도(Cfree) 측정은 화학적 활성도에 대한 정보를 제공할 수 있으며, 이는 환경매질에서의 농도뿐만 아니라, 오염물질에 노출된 생물의 오염물질 축적 및 그에 따른 생태학적 영향도 파악할 수 있다(Lydy et al.[2014]; Mayer et al.[2014]). Muijs and Jonker[2012] 연구에 의하면 유기탄소로 보정된 퇴적물의 오염물질 농도(COC)로부터 예측되어진 빈모류(Lumbriculus variegatus) 체내의 PAHs 농도는 실제 측정되어진 체내 농도 값(실측값)에 비해 약 2~200배 높은 반면(Fig. 3(A)), 대표적인 수동형 채집기 종류의 하나인 PDMS가 코팅된 SPME로부터 예측된 빈모류 체내의 농도는 실측값의 4배 이내로 근사한 값을 나타내었다(Fig. 3(B)). 또한 Hawthorne et al.[2007]는 SPME를 이용하여 오염지역 퇴적물 내의 공극수의 PAHs 자유용존상 농도(Cfree)측정을 통해 담수 단각류, Hyalella azteca의 생존과 독성을 예측할 수 있음을 증명하였다. 종합하면, 수동형 채집기의 오염물질 축적과 생물농축 간에는 통계적으로 유의한 상관관계를 나타내며, 수동형 채집기로부터 신뢰성 있는 생물농축 예측 및 퇴적물 내 오염물질의 독성을 예측할 수 있음을 나타내었다(Van der Wal et al.[2004]; Van der Heijden and Jonker[2009]; Lu et al.[2011]; Joyce et al.[2016]).
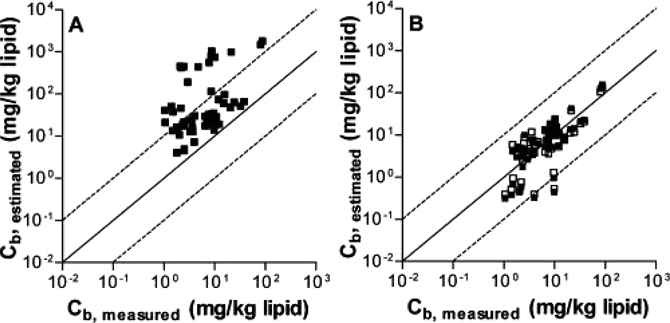
Relationships between measured and predicted PAH concentrations in situ exposed Lumbriculus variegatus. Solid squares representing non-temperature adjusted data and open squares being temperature-adjusted data (Adapted from Muijs and Jonker [2012], Environ. Sci. Technol., 46(2), 937-944, with permission of American Chemical Society).
다섯째, 수동형 채집기는 생물모니터링 생물을 대신하는 대체수단으로도 이용될 수 있으며(Vinturella et al.[2004]), 생물이 서식할 수 없는 조건(예; 저산소, 고온, 독성)에 의한 영향을 받지 않기 때문에 극한의 환경에도 설치할 수 있는 장점이 있다(U.S. EPA[2012]).
5. 다양한 해양환경에서의 수동형 채집기의 적용사례
실험실과 현장에서 해수 및 해양 퇴적물에 수동형 채집기를 이용하여 난분해성 유기오염물질의 자유용존상 농도(Cfree)를 측정한 다양한 연구사례들이 있다(Mayer et al.[2000]; Kraaij et al.[2002]; ter Laak et al.[2006]; Fernandez et al.[2009; 2014]; Friedman et al.[2009]; Maruya et al.[2009]; Witt et al.[2009]). Oen et al.[2011]과 Fernandez et al.[2014]는 해양오염이 심각한 지역의 퇴적물에 모래 등을 도포(capping)하여 정화작업을 한 뒤, 수동형 채집기를 설치하여 공극수에서 자유용존상 농도(Cfree)를 측정함으로써 퇴적물 내 오염물질 정화효율을 확인하는 지표로 활용하였다. 연안을 포함한 북 대서양, 북극 등의 외양 해수와 퇴적물에서도 수동형 채집기를 설치하여 PAHs, PCBs, 브롬계난연제 polybrominated diphenyl ethers(PBDEs) 및 유기인계 에스테르화합물(organophosphate esters, OPEs)의 깊이에 따른 자유용존상 농도(Cfree)를 측정하였다(Oen et al.[2011]; Lohmann et al.[2013]; Joyce et al.[2015]; Sun et al.[2016]; McDonough et al.[2018]). 또한 수동형 채집기를 해수와퇴적물에 동시에 설치하여 퇴적물과 해수간의 오염물질 플럭스를 계산하여, 해양오염원을 확인하는 모니터링 도구로 활용하기도 하였다(Fig. 4) (Liu et al.[2013]; Mayer et al.[2014]; Ghosh et al.[2014]; Belles et al.[2017]).
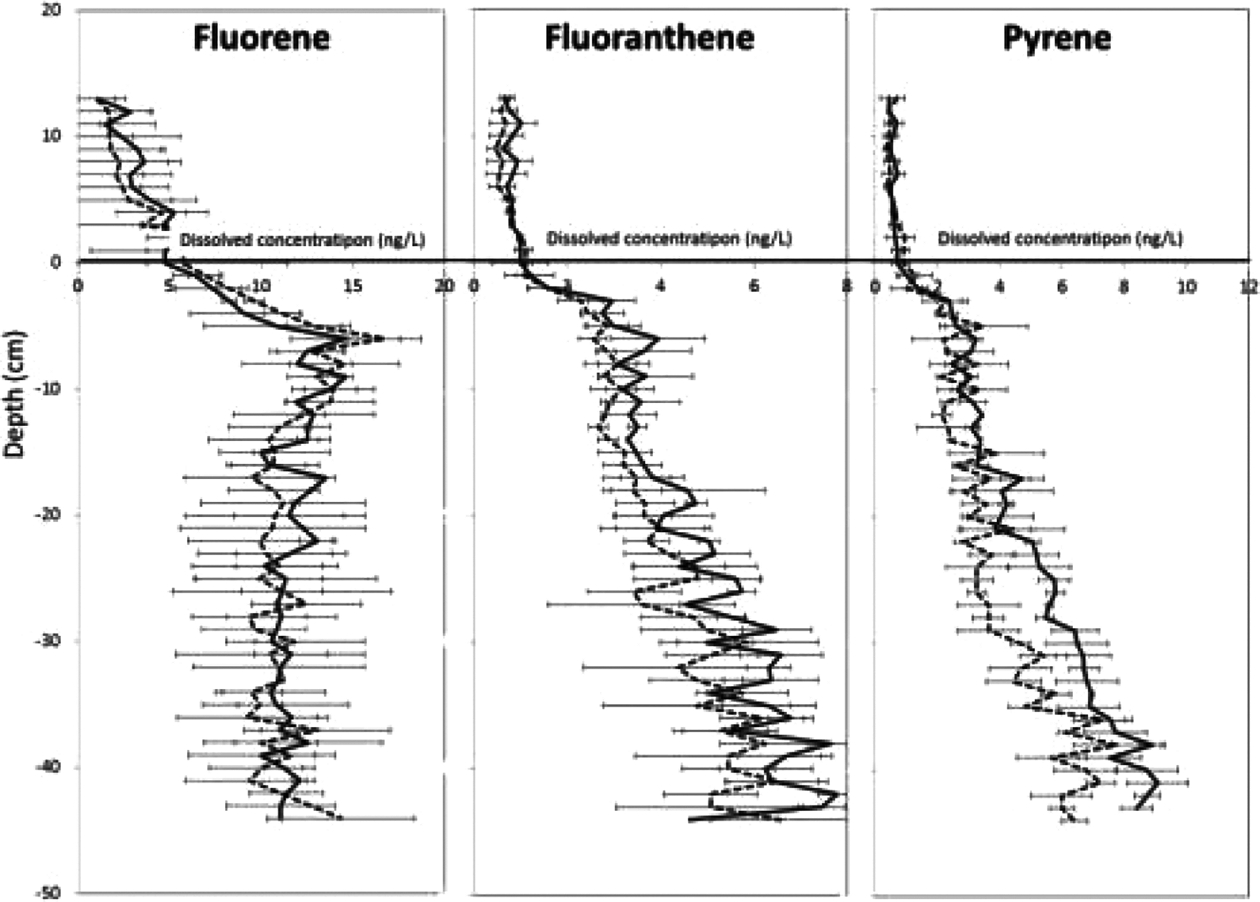
Dissolved concentration gradient of fluorene, fluoranthene and pyrene from the overlying water to the deep sediment at two sites (+13 to −44 cm) (Adapted from Belles et al.[2017], Sci. Total Environ., 579, 72-81, with permission from Elsevier).
현재 유럽이나 미국에서는 난분해성 유기오염물질을 대상으로 퇴적물의 질을 평가하기 위해 수동형 채집기를 활용하고 있으며, 이에 대한 가이드라인도 제시하고 있다(U.S. EPA[2003; 2008; 2012; 2017]; Burgess et al.[2013]; Miège et al.[2015]). 특히 미국의 경우, 오염이 극심한 지역(superfund site)에서 난분해성 유기오염물질 모니터링 및 퇴적물 정화작업 효율평가, 오염물질의 거동 및 오염물질과 생물영향의 상관관계를 평가하기 위해 수동형 채집기를 적용하고 있다(U.S. EPA[2012]). 또한 중국의 경우 가두리 양식장에서 수산물 안정성 평가 및 퇴적물 오염을 모니터링하기 위해 바지락과 PDMS 시트를 이용하여 생물 농축 및 퇴적물 정화작업 효율을 파악하는데 활용하기도 하였다(Li et al.[2018]).
6. 수동형 채집기의 한계점
수동형 채집기를 현장에 노출시 평형에 도달하는 시간이 길어져 수동형 채집기가 현장에 장기간 노출될 경우, 수동형 채집기 표면의 생물부착(biofouling)에 의해 오염물질의 흡수속도가 감소되거나(Prest et al.[1992]; Richardson et al.[2002]), 수동형 채집기의 유실 또는 흡수된 분석대상물질들이 분해될 수 있는 위험이 있다(Liu et al.[2014]). 한편, 수동형 채집기를 이용한 실험실 실험의 경우, 분석대상 오염물질 추출을 위해 수 mg 정도의 유기중합체를 사용하며, 추출시 10 mL 이하의 유기용매를 사용하고 정제과정 없이 기기분석을 수행할 수 있지만, 현장에 노출된 수동형 채집기의 경우 상대적으로 많은 양(1 g 이상)의 유기중합체를 사용함에 따라 유기용매 사용량이 상대적으로 많고 추출단계에서 올리고머가 함께 추출되어 추가적인 정제단계를 필요로 한다.
수동형 채집기에 대한 과학적 연구와 활동은 계속 발전되어져 오고 있지만, 수동형 채집기의 활용을 위해서는 기본적인 자료들에 대한 추가연구가 필요하다. 예를 들면 자유용존상 농도(Cfree)계산에 사용되는 수동형 채집기와 물간의 분배계수(예; KPOM, KPDMS, KLDPE)에 대한 연구는 PAHs와 PCBs에 대해 주로 수행되어 분배계수 값에 대한 정보를 쉽게 얻을 수 있으나(Ghosh et al.[2014]), DDTs(dichlorodiphenyltrichloroethane)와 같은 유기염소계 살충제 및 다이옥신(chlorinated dibenzodioxins), 퓨란(furans)의 분배계수에 대한 정보는 매우 제한적이다. 현재는 스톡홀름 협약에 의해 제조 및 사용이 제한되는 오염물질 이외에도 새롭게 제조되어 산업과 실생활에 이용되어지고 있는 매우 많은 종류의 오염물질에 대한 국민적 관심이 높다. 따라서 수동형 채집기를 활용하여 이러한 물질들의 상시적인 모니터링을 위해서는 수동형 채집기의 분배계수 값을 가장 먼저 측정하여야 한다. 그 이후에 국내의 여러 해양환경에서 수동형 채집기를 활용한 연구가 가능하게 될 것이다.
7. 결 론
해양환경 중에 수동형 채집기를 노출하였을 때 장기간 노출에 따른 오염물질의 흡수속도 감소 및 올리고머 생성에 따른 한계점에도 불구하고, 수동형 채집기는 용존상으로 존재하는 잔류성 유기오염물질의 자유용존상 농도(Cfree)를 보다 과학적이고 비용 효율적으로 측정하고, 보다 정확하게 생물농축 및 생물독성을 예측할 수 있어 해양환경 모니터링에 효율적으로 활용될 수 있을 것으로 판단된다. 또한 현재 전 세계적으로 다양한 해양환경에서 수동형 채집기가 적용되고 있으며, 보다나은 해양환경 관리를 위해 국내에서도 연안, 조간대 및 외해 등에 수동형 채집기 적용이 필요하다. 이를 위해서는 많은 연구자들 및 기관들과 공동 연구가 이루어져야 한다. 향후에는 시간과 비용 측면에서 효율적으로 오염물질을 모니터링할 수 있는 수동형 채집기가 특별관리해역 뿐만 아니라, 양식어장, 해수욕장 및 일반 해역에 이르는 다양한 해양환경에 적극 활용되어질 수 있을 것이다.
Acknowledgments
본 연구는 한국연구재단의 지원(NRF-2017R1C1B1008591, NRF-2017R1A2B4008737)으로 수행되었으며, 일부는 BK21플러스사업의 일환으로 수행되었습니다.
References
-
Adams, R.G., Lohmann, R., Fernandez, L.A., MacFarlane, J.K., and Gschwend, P.M., (2007), Polyethylene devices: passive samplers for measuring dissolved hydrophobic organic compounds in aquatic environments, Environ. Sci. Technol., 41, p1317-1323.
[https://doi.org/10.1021/es0621593]

- Adams, W.J., Kimerle, R.A., and Mosher, R.G., (1985), Aquatic safety assessment of chemicals sorbed to sediments, In: Cardwell, R.D., Purdy, R., Bahner, R.C., (editors)Aquatic toxicology and hazard assessment: Seventh symposium, ASTM STP, Philadelphia, p429-453.
-
Apell, J.N., and Gschwend, P.M., (2014), Validating the use of performance reference compounds in passive samplers to assess porewater concentrations in sediment beds, Environ. Sci. Technol., 48, p10301-10307.
[https://doi.org/10.1021/es502694g]

- Apell, J.N., Tcaciuc, A.P., and Gschwend, P.M., (2015), Understanding the rates of nonpolar organic chemical accumulation into passive samplers deployed in the environment: Guidance for passive sampler deployments, Integr. Environ. Assess. Manage., 12, p486-492.
-
Bartolomé, N., Hilber, I., Schulin, R., Mayer, P., Witt, G., Reininghaus, M., and Bucheli, T.D., (2018), Comparison of freely dissolved concentrations of PAHs in contaminated pot soils under saturated and unsaturated water conditions, Sci. Total Environ., 644, p835-843.
[https://doi.org/10.1016/j.scitotenv.2018.06.359]

-
Belles, A., Alary, C., Criquet, J., Ivanovsky, A., and Billon, G., (2017), Assessing the transport of PAH in the surficial sediment layer by passive sampler approach, Sci. Total Environ., 579, p72-81.
[https://doi.org/10.1016/j.scitotenv.2016.10.198]

-
Booij, K., Sleiderink, H.M., and Smedes, F., (1998), Calibrating the uptake kinetics of semipermeable membrane devices using exposure standards, Environ. Toxicol. Chem., 17(7), p1236-1245.
[https://doi.org/10.1897/1551-5028(1998)017<1236:ctukos>2.3.co;2]

-
Booij, K., van Bommel, R., van Aken, H. M., van Haren, H., Brummer, G.J.A., and Ridderinkhof, H., (2014), Passive sampling of nonpolar contaminants at three deep-ocean sites, Environ. Pollut., 195, p101-108.
[https://doi.org/10.1016/j.envpol.2014.08.013]

-
Borrelli, R., Tcaciuc, A.P., Verginelli, I., Baciocchi, R., Guzzella, L., Cesti, P., Zaninetta, L., and Gschwend, P.M., (2018), Performance of passive sampling with low-density polyethylene membranes for the estimation of freely dissolved DDx concentrations in lake environments, Chemosphere, 200, p227-236.
[https://doi.org/10.1016/j.chemosphere.2018.02.077]

- Burgess, R.M., and Scott, K.J., (1992), The Significance of inplace contaminated marine sediments on the water column: processes and effects, In; Burton, G.A., (editors)Sediment Toxicity Assessments, Lewis Publishers, Inc., Boca Raton, FL, p129-165.
- Burgess, R.M., Berry, D.R., Mount, D.M., and Di Toro, W.J., (2013), Critical review: Mechanistic sediment quality guidelines based on contaminant bioavailability: Equilibrium partitioning sediment benchmarks (ESBs), Environ. Toxicol. Chem., 32, p102-114.
-
Burton, G.A., (1992), Sediment Toxicity Assessment, Lewis Publishers, Inc., Boca Raton, FL.
[https://doi.org/10.1201/9781351076555]

-
Chen, Y., and Pawliszyn, J., (2003), Time-weighted average passive sampling with a solid-phase microextraction device, Anal. Chem., 75(9), p2004-2010.
[https://doi.org/10.1021/ac026315+]

-
Cornelissen, G., Okkenhaug, G., Breedveld, G.D., and Sørlie, J.E., (2009), Transport of polycyclic aromatic hydrocarbons and polychlorinated biphenyls in a landfill: A novel equilibrium passive sampler to determine free and total dissolved concentrations in leachate water, J. Hydrol., 369, p253-259.
[https://doi.org/10.1016/j.jhydrol.2009.02.017]

-
Cornelissen, G., Pettersen, A., Broman, D., Mayer, P., and Breedveld, G.D., (2008), Field testing of equilibrium passive samplers to determine freely dissolved native polycyclic aromatic hydrocarbon concentrations, Environ. Toxicol. Chem., 27, p499-508.
[https://doi.org/10.1897/07-253.1]

- Criquet, J., Dumoulin, D., Howsam, M., Mondamert, L., Goossens, J., Prygiel, J., and Billon, G., (2017), Science of the Total Environment Comparison of POCIS passive samplers vs. composite water sampling: A case study, Sci. Total Environ., 609, p982-991.
-
Di Toro, D.M., Zarba, C.S., Hansen, D.J., Berry, W.J., Swartz, R.C., Cowan, C.E., Pavlou, S.P., Allen, H.E., Thomas, N.A., and Paquin, P.R., (1991), Technical basis for establishing sediment quality criteria for nonionic organic chemicals using equilibrium partitioning, Environ. Toxicol. Chem., 10(12), p1541-1583.
[https://doi.org/10.1897/1552-8618(1991)10[1541:tbfesq]2.0.co;2]

-
DiFilippo, E.L., and Eganhouse, R.P., (2010), Assessment of PDMS-water partition coefficients: Implications for passive environmental sampling of hydrophobic organic compounds, Environ. Sci. Technol., 44(18), p6917-6925.
[https://doi.org/10.1021/es101103x]

-
Dong, Z., Lewis, C.G., Burgess, R.M., and Sine, J.P., (2015), The Gellyfish: An in-situ equilibrium-based sampler for determining multiple free metal ion concentrations in marine ecosystems, Environ. Toxicol. Chem., 34, p983-992.
[https://doi.org/10.1002/etc.2893]

- EU, (2000), Directive 2000/60/EC of the European parliament and of the council of 23 October 2000 establishing a framework for community action in the field of water policy, Off. J. Eur. Union, L327, p1-72.
- EU, (2013), Directive 2013/39/EU of the European Parlament and of the Council of 12 August 2013 amending directives 2000/60/EC and 2008/105/EC as regards priority substances in the field of water policy, Off. J. Eur. Union, L226, p1-17.
-
Fernandez, L.A., Lao, W., Maruya, K.A., and Burgess, R.M., (2014), Calculating the diffusive flux of persistent organic pollutants between sediments and the water column on the palos verdes shelf superfund site using polymeric passive samplers, Environ. Sci. Technol., 48, p3925-3934.
[https://doi.org/10.1021/es404475c]

-
Fernandez, L.A., Lao, W., Maruya, K.A., White, C., and Burgess, R.M., (2012), Passive sampling to measure baseline dissolved persistent organic pollutant concentrations in the water column of the Palos Verdes Shelf Superfund Site, Enviro. Sci. Technol., 46, p11937-11947.
[https://doi.org/10.1021/es302139y]

-
Fernandez, L.A., MacFarlane, J.K., Tcaciuc, A.P., and Gschwend, P.M., (2009), Measurement of freely dissolved PAH concentrations in sediment beds using passive sampling with low-density polyethylene strips, Environ. Sci. Technol., 43(5), p1430-1436.
[https://doi.org/10.1021/es802288w]

- Friedman, C.L., Burgess, R.M., Perron, M.M., Cantwell, M.G., Ho, K.T., and Lohmann, R., (2009), Comparing polychaete bioaccumulation and passive sampler uptake to assess the effects of sediment resuspension on PCB bioavailability, Environ. Sci. Technol., 43, p2865-2870.
- Friedman, C.L., Cantwell, M.G., and Lohmann, R., (2012), Pasive sampling provides evidence for Newark Bay as a source of Polychlorinate Dibenzo-pdioxins and furans to the New York/New Jersey, USA, atmosphere, Environ. Toxicol. Chem., 31(2), p253-261.
-
Ghosh, U., Driscoll, S.K., Burgess, R.M., Jonker, M.T.O., Reible, D., Gobas, F., Choi, Y., Apitz, S.E., Maruya, K.A., Gala, W.R., Mortimer, M., and Beegan, C., (2014), Passive sampling methods for contaminated sediments: Practical guidance for selection, calibration, and implementation, Integr. Environ. Assess. Manag., 10, p210-223.
[https://doi.org/10.1002/ieam.1507]

-
Gschwend, P.M., MacFarlane, J.K., Reible, D.D., Lu, X., Hawthorne, S.B., Nakles, D.V., and Thompson, T., (2011), Comparison of polymeric samplers for accurately assessing PCBs in pore waters, Environ. Toxicol. Chem., 30(6), p1288-1296.
[https://doi.org/10.1002/etc.510]

-
Hawthorne, S.B., Azzolina, N.A., Neuhauser, E.F., and Kreitinger, J.P., (2007), Predicting bioavailability of sediment polycyclic aromatic hydrocarbons to Hyalella azteca using equilibrium partitioning, supercritical fluid extraction, and pore water concentrations, Environ. Sci. Technol., 41, p6297-6304.
[https://doi.org/10.1021/es0702162]

-
Huckins, J.N., Tubergen, M.W., and Manuweera, G.K., (1990), Semipermeable membrane devices containing model lipid: A new approach to monitoring the bioavailability of lipophilic contaminants and estimating their bioconcentration potential, Chemosphere, 20, p533-552.
[https://doi.org/10.1016/0045-6535(90)90110-f]

- Ingersoll, C., Dillon, T., and Biddinger, G., (1997), Ecological risk assessment of contaminated sediments, SETAC, Pensacola, FL.
-
Jonker, M.T.O., and Koelmans, A.A., (2001), Polyoxymethylene solid phase extraction as a partitioning method for hydrophobic organic chemicals in sediment and soot, Environ. Sci. Technol., 35(18), p3742-3748.
[https://doi.org/10.1021/es0100470]

-
Joyce, A.S., Pirogovsky, M.S., Adams, R.G., Lao, W., Tsukada, D., Cash, C.L., and Maruya, K.A., (2015), Using performance reference compound-corrected polyethylene passive samplers and caged bivalves to measure hydrophobic contaminants of concern in urban coastal seawaters, Chemosphere, 127, p10-17.
[https://doi.org/10.1016/j.chemosphere.2014.12.067]

-
Joyce, A.S., Portis, L.M., Parks, A.N., and Burgess, R.M., (2016), Evaluating the relationship between equilibrium passive sampler uptake and aquatic organism bioaccumulation, Environ. Sci. Technol., 50, p11437-11451.
[https://doi.org/10.1021/acs.est.6b03273]

-
Kim, D.Y., and Kwon, J.H., (2018), Determination of the partition coefficient between dissolved organic carbon and seawater using differential equilibrium kinetics, Environ. Pollut., 240, p177-183.
[https://doi.org/10.1016/j.envpol.2018.04.114]

-
Kraaij, R., Mayer, P., Busser, F.J.M., van het Bolscher, M., Seinen, W., Tolls, J., and Belfroid, A.C., (2002), Measured pore-water concentrations make equilibrium partitioning work a data analysis, Environ. Sci. Techno., 37(2), p268-274.
[https://doi.org/10.1021/es020116q]

-
Lao, W., Hong, Y., Tsukada, D., Maruya, K.A., and Gan, J., (2016), A new film-based passive sampler for moderately hydrophobic organic compounds, Environ. Sci. Techno., 50(24), p13470-13476.
[https://doi.org/10.1021/acs.est.6b04750]

-
Larsson, P., (1985), Contaminated sediments of lakes and oceans act as sources of chlorinated hydrocarbons for release to water and atmosphere, Nature, 317, p347-349.
[https://doi.org/10.1038/317347a0]

- Li, J.Y., Shi, W., Li, Z., Chen, Y., Shao, L., and Jin, L., (2018), Equilibrium sampling informs tissue residue and sediment remediation for pyrethroid insecticides in mariculture: A laboratory demonstration, Sci. Total Environ., p616-617, 639-646.
-
Liu, H.H., Bao, L.J., and Zeng, E.Y., (2014), Recent advances in the field measurement of the diffusion flux of hydrophobic organic chemicals at the sediment-water interface, Trends Anal. Chem., 54, p56-64.
[https://doi.org/10.1016/j.trac.2013.11.005]

-
Liu, H.H., Bao, L.J., Zhang, K., Xu, S.P., Wu, F.C., and Zeng, E.Y., (2013), Novel passive sampling device for measuring sediment-water diffusion fluxes of hydrophobic organic chemicals, Environ. Sci. Technol., 47(17), p9866-9873.
[https://doi.org/10.1021/es401180y]

-
Lohmann, R., and Muir, D., (2010), Global aquatic passive sampling (AQUA-GAPS): using passive samplers to monitor POPs in the waters of the world, Environ. Sci. Technol., 44, p860-864.
[https://doi.org/10.1021/es902379g]

-
Lohmann, R., Burgess, R.M., Cantwell, M.G., Ryba, S.A., MacFarlane, J.K., and Gschwend, P.M., (2004), Dependency of polychlorinated biphenyl and polycyclic aromatic hydrocarbon bioaccumulation in Mya arenaria on both water column and sediment bed chemical activities, Environ. Toxicol. Chem., 23, p2551-2562.
[https://doi.org/10.1897/03-400]

-
Lohmann, R., Klanova, J., Pribylova, P., Liskova, H., Yonis, S., and Bollinger, K., (2013), PAHs on a West-to-East Transect Across the Tropical Atlantic Ocean, Environ. Sci. Technol., 47(6), p2570-2578.
[https://doi.org/10.1021/es304764e]

-
Long, E.R., and Chapman, P.M., (1985), A sediment quality triad: Measures of sediment contamination, toxicity and infaunal community composition in Puget Sound, Mar. Pollut. Bull., 16(10), p405-415.
[https://doi.org/10.1016/0025-326x(85)90290-5]

-
Lu, X., Skwarski, A., Drake, B., and Reible, D.D., (2011), Predicting bioavailability of PAHs and PCBs with porewater concentrations measured by solid-phase microextraction fibers, Environ. Toxicol. Chem., 30, p1109-1116.
[https://doi.org/10.1002/etc.495]

-
Lydy, M.J., Landrum, P.F., Oen, A.M.P., Allinson, M., Smedes, F., Harwood, A.D., Li, H., Maruya, K.A., and Liu, J., (2014), Passive sampling methods for contaminated sediments: State of the science for organic contaminants, Integr. Environ. Assess. Manag., 10, p167-178.
[https://doi.org/10.1002/ieam.1503]

-
Maruya, K.A., Zeng, E.Y., Tsukada, D., and Bay, S.M., (2009), A passive sampler based on solid-phase microextraction for quantifying hydrophobic organic contaminants in sediment pore water, Environ. Toxicol. Chem., 28(4), p733-740.
[https://doi.org/10.1897/08-322r.1]

-
Mayer, P., Parkerton, T.F., Adams, R.G., Cargill, J.G., Gan, J., Gouin, T., Gschwend, P.M., Hawthorene, S.B., Helm, P., Gesine, W., You, J., and Escher, B., (2014), Passive sampling methods for contaminated sediments: Scientific rationale supporting use of freely dissolved concentrations, Integr. Environ. Assess. Manag., 10, p197-209.
[https://doi.org/10.1002/ieam.1508]

- Mayer, P., Tolls, J., Hermens, J.L., and Mackay, D., (2003), Equilibrium sampling devices, Environ. Sci. Technol., 37(9), p184A-191A.
-
Mayer, P., Vaes, W.H.J., Wijnker, F., Legierse, K.C.H.M., Kraaij, R., Tolls, J., and Hermens, J.L.M., (2000), Sensing dissolved sediment porewater concentrations of persistent and bioaccumulative pollutants using disposable solid-phase microextraction fibers, Environ. Sci. Technol., 34(24), p5177-5183.
[https://doi.org/10.1021/es001179g]

-
McDonough, C.A., De Silva, A.O., Sun, C., Cabrerizo, A., Adelman, D., Soltwedel, T., Bauerfeind, E., Muir, D.C.G., and Lohmann, R., (2018), Dissolved Organophosphate Esters and Polybrominated Diphenyl Ethers in Remote Marine Environments: Arctic Surface Water Distributions and Net Transport through Fram Strait, Environ. Sci. Technol., 52(11), p6208-6216.
[https://doi.org/10.1021/acs.est.8b01127]

-
Miège, C., Mazzella, N., Allan, I., Dulio, V., Smedes, F., Tixier, C., Vermeirssen, E., Brant, J., O’Toole, S., Budzinski, H., Ghestem, J.P., Staub, P.F., Lardy-Fontan, S., Gonzalez, J.L., Coquery, M., and Vrana, B., (2015), Position paper on passive sampling techniques for the monitoring of contaminants in the aquatic environment–Achievements to date and perspectives, Trends Environ. Anal. Chem., 8, p20-26.
[https://doi.org/10.1016/j.teac.2015.07.001]

-
Muijs, B., and Jonker, M.T., (2012), Does equilibrium passive sampling reflect actual in situ bioaccumulation of PAHs and petroleum hydrocarbon mixtures in aquatic worms?, Environ. Sci. Technol., 46(2), p937-944.
[https://doi.org/10.1021/es202951w]

-
Oen, A.M., Janssen, E.M., Cornelissen, G., Breedveld, G.D., Eek, E., and Luthy, R.G., (2011), In situ measurement of PCB pore water concentration profiles in activated carbon-amended sediment using passive samplers, Environ. Sci. Technol., 45(9), p4053-4059.
[https://doi.org/10.1021/es200174v]

-
Peijnenburg, W.J.G.M., Teasdale, P.R., Reible, D., Mondon, K.J., Bennett, W.S., and Campbell, P.G.C., (2014), Passive sampling methods for contaminated sediments: State of the science for metals, Integr. Environ. Assess. Manag., 10(2), p179-196.
[https://doi.org/10.1002/ieam.1502]

- Prest, H.F., Jarman, W.M., Burns, S.A., Weismuller, T., Martin, M., and Huckins, J.N., (1992), Passive water sampling via semipermeable membrane devices (SPDMs) in concert with bivalves in the Sacramento/San Joaquin river delta, Chemosphere, 25, p1811-1823.
-
Prokeš, R., Vrana, B., and Klánová, J., (2012), Levels and distribution of dissolved hydrophobic organic contaminants in the Morava river in Zlín district, Czech Republic as derived from their accumulation in silicone rubber passive samplers, Environ. Pollut., 166, p157-166.
[https://doi.org/10.1016/j.envpol.2012.02.022]

-
Richardson, B.J., Lam, P.K.S., Zheng, G.J., McClellan, K.E., and De Luca-Abbott, S.B., (2002), Biofouling confounds the uptake of trace organic contaminants by semi-permeable membrane devices (SPMDs), Mar. Pollut. Bull., 44, p1372-1379.
[https://doi.org/10.1016/s0025-326x(02)00263-1]

-
Sacks, V.P., and Lohmann, R., (2012), Freely dissolved PBDEs in water and porewater of an urban estuary, Environ. Pollut., 162, p287-293.
[https://doi.org/10.1016/j.envpol.2011.11.028]

-
Salomons, W., de Rooij, N.M., Kerdijk, H., and Bril, J., (1987), Sediments as a source of contaminants?, Hydrobiologia, 149, p13-30.
[https://doi.org/10.1007/bf00048643]

- Schwarzenbach, R.P., Gschwend, P.M., and Imboden, D.M., (2003), Environmental Organic Chemistry, 2nd Edition, Wiley-Interscience, New Jersey.
-
Smedes, F., (2007), Monitoring of chlorinated biphenyls and polycyclic aromatic hydrocarbons by passive sampling in concert with deployed mussels, In passive sampling techniques in environmental monitoring, Ch. 19, Ed. by R. Greenwood, R., Mills, G.A., Vrana, B., Elsevier, Amsterdam.
[https://doi.org/10.1016/S0166-526X(06)48019-3]

-
Sun, C., Soltwedel, T., Bauerfeind, E., Adelman, D.A., and Lohmann, R., (2016), Depth profiles of persistent organic pollutants in the North and Tropical Atlantic Ocean, Environ. Sci. Technol., 50(12), p6172-6179.
[https://doi.org/10.1021/acs.est.5b05891]

-
ter Laak, T.L., Barendregt, A., and Hermens, J.L., (2006), Freely dissolved pore water concentrations and sorption coefficients of PAHs in spiked, aged, and field-contaminated soils, Environ. Sci. Technol., 40(7), p2184-2190.
[https://doi.org/10.1021/es0524548]

- United States Environmental Protection Agency (U.S. EPA), (2003), Procedures for the Derivation of Equilibrium Partitioning Sediment Benchmarks (ESBs) for the Protection of Benthic Organisms: PAH Mixtures, EPA-600-R-02-013, Office of Research and Development, Washington, DC.
- United States Environmental Protection Agency (U.S. EPA), (2008), Procedures for the Derivation of Equilibrium Partitioning Sediment Benchmarks (ESBs) for The Protection of Benthic Organisms: Compendium of Tier 2 Values for Nonionic Organics, EPA-600-R-02-016, Office of Research and Development, Washington, DC.
- United States Environmental Protection Agency (U.S. EPA), (2017), Laboratory, field, and analytical procedures for using passive sampling in the evaluation of contaminated sediments: User’s manual, p1-153.
- United States Environmental Protection Agency (U.S. EPA), (2012), Guidelines for Using Passive Samplers to Monitor Nonionic Organic Contaminants at Superfund Sediment Sites. Sediment Assessment and Monitoring Sheet (SAMS) #3, OSWER Directive 9200.1-110 FS, Office of Superfund Remediation and Technology Innovation/Office of Research and Development, Washington, DC.
- Van der Heijden, S.A., and Jonker, M.T., (2009), PAH bioavailability in field sediments: comparing different methods for predicting in situ bioaccumulation, Environ. Sci. Technol., 43(10), p3757-3763.
-
Van der Wal, L., Jager, T., Fleuren, R.H.L.J., Barendregt, A., Sinnige, T.L., Van Gestel, C.A.M., and Hermens, J.L.M., (2004), Solid-phase microextraction to predict bioavailability and accumulation of organic micropollutants in terrestrial organisms after exposure to a field-contaminated soil, Environ. Sci. Technol., 38, p4842-4848.
[https://doi.org/10.1021/es035318g]

-
Vinturella, A.E., Burgess, R.M., and Coull, B.A., Thompson, K.M., and Shine, J.P., (2004), Use of passive samplers to mimic uptake of polycyclic aromatic hydrocarbons by benthic polychaetes, Environ. Sci. Technol., 38(4), p1154-1160.
[https://doi.org/10.1021/es034706f]

- Vrana, B., Allan, I.J., Greenwood, R., Mills, G.A., Dominiak, E., Svensson, K., Knutsson, J., and Morrison, G., (2005), Passive sampling techniques for monitoring pollutants in water, Trends Analyt. Chem., 24(10), p845-868.
- Wenning, R.J., Batley, G.E., Ingersoll, C.G., and Moore, D.W., (2005), Use of sediment quality guidelines and related tools for the assessment of contaminated sediments, SETAC, Pensacola, FL.
-
Witt, G., Liehr, G.A., Borck, D., and Mayer, P., (2009), Matrix solid-phase microextraction for measuring freely dissolved concentrations and chemical activities of PAHs in sediment cores from the western Baltic Sea, Chemosphere, 74(4), p522-529.
[https://doi.org/10.1016/j.chemosphere.2008.09.073]