새만금 방조제 외측 조하대 갯벌 대형저서동물 군집의 장기간 시·공간 분포
초록
새만금 방조제 건설 이후 외해역 조하대 저서생태계의 군집 변화를 파악하기 위해 장기간 동안 퇴적환경 및 대형저서 동물 군집의 시공간 분포를 조사하였다. 본 연구는 2014년부터 2020년까지 7년간 매년 여름철에 새만금 방조제 외측해역에 위치한 10개 정점을 대상으로 총 7회 조사를 수행하였다. 본 조사 이전의 문헌자료와 비교해보면 새만금 해역의 퇴적환경은 새만금 방조제 완공 이후 세립해지는 경향을 보였으며, 강열감량은 배수갑문 유출수의 영향권 내에 있는 지역에서 전 조사기간에 걸쳐 대체로 높았다. 대형저서동물의 전체 출현종수는 255종이며, 평균서식밀도는 1,692±331 indiv.m-2, 평균생물량은 59.9 gWW m-2으로 여자만 연안 저서생태계와 유사한 군집 양상을 보였다. 가장 우점하는 대형저서동물 분류군은 종수와 서식밀도의 경우 환형동물, 생물량의 경우 연체동물로 나타났다. 우점종은 오염지시종으로 알려진 아기반투명조개(Theora lata), 고리버들갯지렁이(Heteromastus filiformis), 긴자락송곳갯지렁이(Lumbrineris longifolia)로, 이들 중 T. lata와 L. longifolia는 새만금 남쪽 외해역과 방조제 인근 해역에서 우점하였으며, H. filiformis는 전정점에서 고르게 우점하였다. 집괴분석(cluster analysis) 결과 7년 동안 조사된 총 70개 정점은 3개의 정점군으로 구분할 수 있었으며 각 정점군은 방조제 인접 여부, 입도 및 유기물함량에 따라 공간적으로 구분되었다. 새만금 방조제 외 해역의 저서생태계는 방조제 건설 이후 장기간에 걸쳐 유기물을 선호하는 종이 우점하는 형태로 변하였다. 북측해역의 저서생태계는 비교적 안정한 정점군을 유지하고 있는데 반해 2개의 갑문이 위치하는 남측해역의 저서생태계는 물리적 교란으로 인한 불안정한 정점군 변화를 보이고 있는 것으로 판단된다.
Abstract
Long-term spatio-temporal distributions of the benthic environment and the macrozoobenthos community were investigated to assess the impact of Saemangeum dike construction on the subtidal benthic ecosystem for 7 years. A total of 7 times sampling were conducted at the 10 sampling stations located outside of the Saemangeum dike in the summer from 2014 to 2020. The benthic sedimentological environment of Saemangeum sea area tended to be finer after the completion of the dike, and the loss on ignition (LOI) was relatively high within the area affected by the discharged water over the study period. A total of 255 macrozoobenthos species occurred with mean density of 1,692±331 indiv. m-2 and mean biomass of 59.9 gWW m-2 that the community structure was similar to that of Yoja Bay. Polychaeta was the most dominant taxa for the number of species and density, and Mollusca for the biomass. The most dominant species were Theora lata, Heteromastus filiformis, and Lumbrineris longifolia. Among the dominant species, T. lata and L. longifolia mainly dominated at the stations located in the south and near region of the Saemangeum dike, and the H. filiformis dominated in the every study area. Three station groups classified by cluster analysis, positioned consistently during the study period according to whether it was adjacent to the dike or not, mean grain size, and LOI. Therefore, the benthic ecosystem in the outer sea area of the Saemangeum dike has changed to where the pollution indicator species dominated over a long period after the completion of the dike, and the north part of the Saemangeum area has remained relatively stable, whereas the benthic ecosystem of the southern sea area where the two watergates located is supposed unstable due to the disturbance.
Keywords:
Saemangeum, Benthic ecosystem, Macrozoobenthos community, Indicator species키워드:
새만금, 저서생태계, 대형저서동물군집, 지시종1. 서 론
연안 생태계는 육지와 인접하여 자연적인 환경요인의 영향과 더불어 하수유입, 항만, 준설, 매립 등의 인위적인 활동으로 인한 영향을 받는다(Gray[1997]). 육상 기원의 유기물이 지속적으로 유입되기 때문에 외해역과 비교하여 상대적으로 생산력이 높은 생태계로 알려져 있다(Feebarani et al.[2016]). 수산물 공급, 정화, 서식지 제공, 일차생산 등 다양한 생태계 서비스를 제공하고 있지만 무분별한 개발행위로 인해 연안생태계의 건강성이 악화되고 지속가능한 서비스가 고갈되고 있다(Levin et al.[2001]).
저서동물은 이차생산자이자 상위포식자의 먹이원이 되기 때문에 연안생태계의 탄소순환과 먹이사슬에서 중요하다. 특히, 퇴적물과 수층의 얇은 경계면에서 벌어지는 물질교환에 지대한 영향을 미치고 있으며, 저층 해수와 퇴적물 환경 변화에 민감하게 반응한다(Gray[1974]; Snelgrove and Butman[1994]). 동물플랑크톤이나 중형동물에 비해 생활사가 상대적으로 길어 서식지 환경의 다양한 변화를 축적할 수 있기 때문에 해양환경 변화를 나타내는 지시자로서 널리 활용되고 있다(Rakocinski et al.[1997]; Blanchet et al.[2008]). 대형저서동물의 시공간 분포는 주로 저층 해수의 환경요인과 퇴적물 특성에 의해 결정되며 이러한 점 때문에 연안생태계를 잘 이해할 수 있는 기초정보를 제공하기도 한다(Millet and Guelorget[1994]; Ysebaert et al.[2003]; Ysebaert et al.[2005]; Sousa et al.[2006]; Fujii[2007]; Ryu et al.[2011]; Lee et al.[2014]; Kim and Koo[2016]).
새만금 해역은 국토확장과 산업용지 확보 등의 목적으로 1991년부터 2006년까지 총 길이 33.9 km의 방조제를 축조하여 401 km2 면적의 갯벌을 매립하였다(Koh et al.[2010]). 새만금 방조제 내측과 외측해역은 신시배수갑문과 가력배수갑문을 통한 해수 유통 외에 자연적인 해수의 순환이 이루어지지 않고 있어 단절된 상태를 유지하고 있다(Kim et al.[2007]; MOMAF[2007]; MOMAF[2009]). 새만금 방조제와 같은 대규모의 인공 구조물은 해수의 물리화학적 환경을 변화시키며, 이러한 변화는 저서동물 군집 분포에 잘 반영될 수 있다(Sanders[1968]; Tunnicliffe and Risk[1977]; Shim et al.[1988]; MOMAF[2007]; MOMAF[2009]). 저서동물 군집 구조의 장기간 변동 자료는 대규모 방조제에 의한 인근 해양생태계의 자연적인 변화와 인위적인 변화를 구분할 수 있도록 해준다.
과거 새만금 연안해역에서 방조제 축조에 따른 지형 및 입도특성(Woo et al.[2006]), 표층 퇴적물과 지화학적 특성(Cho et al.[2001]), 밀도성층의 계절변동(Kim et al.[2006]), 저서생태계의 변화(Lim[2007]; Koo et al.[2008a]; Koo et al.[2008b]; Kim et al.[2014]) 등 많은 연구들이 수행되었으나 방조제 완공 이후 장기간 모니터링을 통해 저서생태계 변화의 특성에 대한 연구는 미흡한 실정이다(An et al.[2006]; Park[2009]; Lee[2012]). 따라서 본 연구는 새만금 방조제 완공 이후 장기간에 걸친 조하대 저서생태계의 시공간 변화양상을 파악하여 외해역 해양생태계의 안정성을 진단하였다.
2. 재료 및 방법
2.1 조사 지역 및 시료 채집
저서퇴적환경과 대형저서동물 군집의 변화를 분석하기 위해 새만금 방조제 외측 해역에 총 10개의 정점을 선정하여 2014년부터 2016년까지는 9월, 2017년부터 2020년까지는 8월에 총 7회(연 1회) 현장조사를 수행하였다(Fig. 1). 각 정점에서 퇴적환경 분석 및 대형저서동물의 채집을 위해 입구면적 0.1 m2의 van Veen grab을 사용하여 선상에서 퇴적물을 3회 채집하였다. 2회 채집된 시료는 1 mm 체를 이용하여 저서동물을 채집하였고, 1회 채집된 시료는 표층 2 cm 퇴적물을 이용하여 퇴적환경 특성을 분석하였다. 채집된 저서동물은 10% 중성 포르말린으로 고정한 후 실험실로 운반하여 저서동물을 선별하였다.
2.2 퇴적환경 분석
연구지역 퇴적상은 2014년부터 2016년까지는 해양환경공정시험법 퇴적물공정시험기준(피펫팅법)에 따라 분석하였으며(MOF[2013]), 2017년부터 2020년까지는 입도 분석기(Mastersize 3000)를 이용하여 측정하였다. 평균입도 및 분급도 산출은 Folk and Ward[1957]을 따랐으며, 실트(silt)와 점토(clay)의 함량(%)을 합산하여 니질함량으로 계산하였다. 유기물함량은 강열감량법(Loss on ignition, LOI)을 이용하여 분석하였다. 퇴적물 시료를 70 oC에서 72시간 이상 충분히 건조시킨 후 막자사발을 사용하여 곱게 분마하였다. 분말퇴적물 약 2 g을 도가니에 담아 무게를 측정하고 고온전기로에서 550 oC로 4시간 동안 강열하였다. 강열된 시료의 무게를 전자저울을 이용하여 0.001 g까지 측정하고 강열 전과 후의 무게 차이를 계산하여 유기물함량(%)을 산출하였다.
분급도는 Compton (1985)이 제시한 기준에 따라 very well sorted (<0.35 ∅), well sorted (0.35–0.50 ∅), moderately well sorted (0.5–0.71∅), moderately sorted (0.71–1.00∅), poorly sorted (1.00–2.00∅), very poorly sorted (2.00–4.00∅), extremely poorly sorted (>4.00∅)로 구분하였으며, 니질함량은 Flemming (2000)이 제안한 방법에 따라 sand (5% 이하), slightly muddy sand (6–25%), muddy sand (26–50%), sandy mud (51–75%), slightly sandy mud (76–95%), mud (95% 이상)로 구분하였다.
2.2 대형저서동물 동정 및 군집분석
대형저서동물은 현미경을 이용하여 종 수준까지 동정한 후 계수하였으며(Kim[1973]; Kim[1977]; Park[1989]; Choi[1992]; Shin and Rho[1996]), 생물량은 화장지로 물기를 제거한 후 습중량으로 나타내었다. 대형저서동물의 종조성이 유사한 정점군을 분류하기 위해 집괴분석(cluster analysis)을 수행하였으며 출현 종의 개체수 자료를 log(x+1) 변환한 뒤 Bray-Curtis 지수(1957)를 산출하였다. 집괴분석은 PRIMER ver. 6를 이용하였다.
2.3 저서생물지수
대형저서동물 군집의 특성을 알아보기 위해 개체수 자료를 기반으로 종다양도지수(Shannon and Weaver[1963], H’), 종풍부도지수(Margalef[1958], R), 종균등도지수(Pielou[1966], J), 우점도지수(Simpson[1949], D)를 산출하였다.
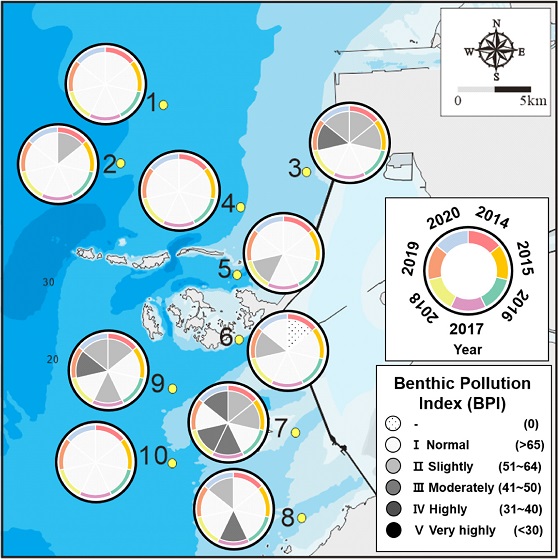
저서오염지수(Benthic Pollution Index, BPI)는 오염지시종 여부 및 섭식유형에 따라 대형저서동물을 총 4개의 그룹으로 분류하여 각 그룹별 출현 개체수를 기반으로 오염정도를 파악하는 방법이다(KORDI[1995]; Kim et al.[2014]; Seo[2016]). BPI의 산출 계산식은 다음과 같다.
여기서 N1은 여과식자(Filter feeder) 및 육식자(Carnivore)의 출현 개체수, N2는 표층퇴적물식자(Surface deposit feeder)의 출현 개체수, N3는 표층하퇴적물식자(Subsurface deposit feeder)의 출현 개체수, N4는 오염지시종(Pollution indicator) 및 기회종(Opportunistic species)의 개체수를 나타내며, a, b, c, d는 각각 a=0, b=1, c=2, d=3로 섭식군의 가중치를 나타낸다. 본 연구에서는 BPI지수의 지역별 비교를 위해 1–100까지의 BPI 값을 1등급(65 이상), 2등급(51–64), 3등급(41–50), 4등급(31–40), 5등급(30 이하)으로 나누어 제시하였다.
3. 결과 및 고찰
3.1 새만금 방조제 외측 조하대 갯벌 저서환경
본 연구기간동안 새만금 방조제 외측 조하대의 퇴적상은 3.4–5.6 ∅ 범위의 평균입도를 보였으며 평균 니질함량은 25.5–55.4%로 2016년 이후 비교적 조립해지다가 2020년 다시 세립해지는 경향을 보였다(Fig. 2a). 지역적으로는 비교적 수심이 깊고(> 10 m) 방조제에서 먼 지역(정점 1, 2, 10)일수록 조립하고 방조제와 근접하고 수심이 낮은 지역(정점 3, 5, 6, 7, 8)일수록 세립한 특성을 보였다(Fig. 2b, d). 분급도는 2.2–3.0 ∅ 수준이었으며 입도 및 니질함량 분포와 유사하게 방조제와 가깝고 수심이 낮은 지역일수록 불량하였다(Fig. 2c). 새만금 방조제 주변해역에서 새만금 방조제 완공 이전(2004년–2005년) 평균 입도는 2.0–4.5 ∅ 수준이었으며, 새만금 방조제 완공(2006년) 이전과 이후를 포함하는 2004년-2007년 기간동안의 평균 입도는 2.8–4.1 ∅ 수준이었다(An et al.[2006]); Park[2009]). 2007년-2010년 새만금 방조제 외해역의 평균 입도는 3.7–4.3 ∅ 수준이었다(Lee[2012]). 본 연구(3.4–5.6 ∅)와 선행 연구들의 입도분석 결과를 비교해보면 새만금 방조제 완공 이전의 연구 결과들은 연구대상 지역이 새만금 방조제 내측을 포함하고 있으며 연구 시기와 범위가 다르기 때문에 직접적인 비교는 어려울 수 있지만, 새만금 방조제 외해역의 퇴적상은 새만금 방조제 완공 이후 세립해지는 경향을 보였다(An et al.[2006]); Park[2009]).
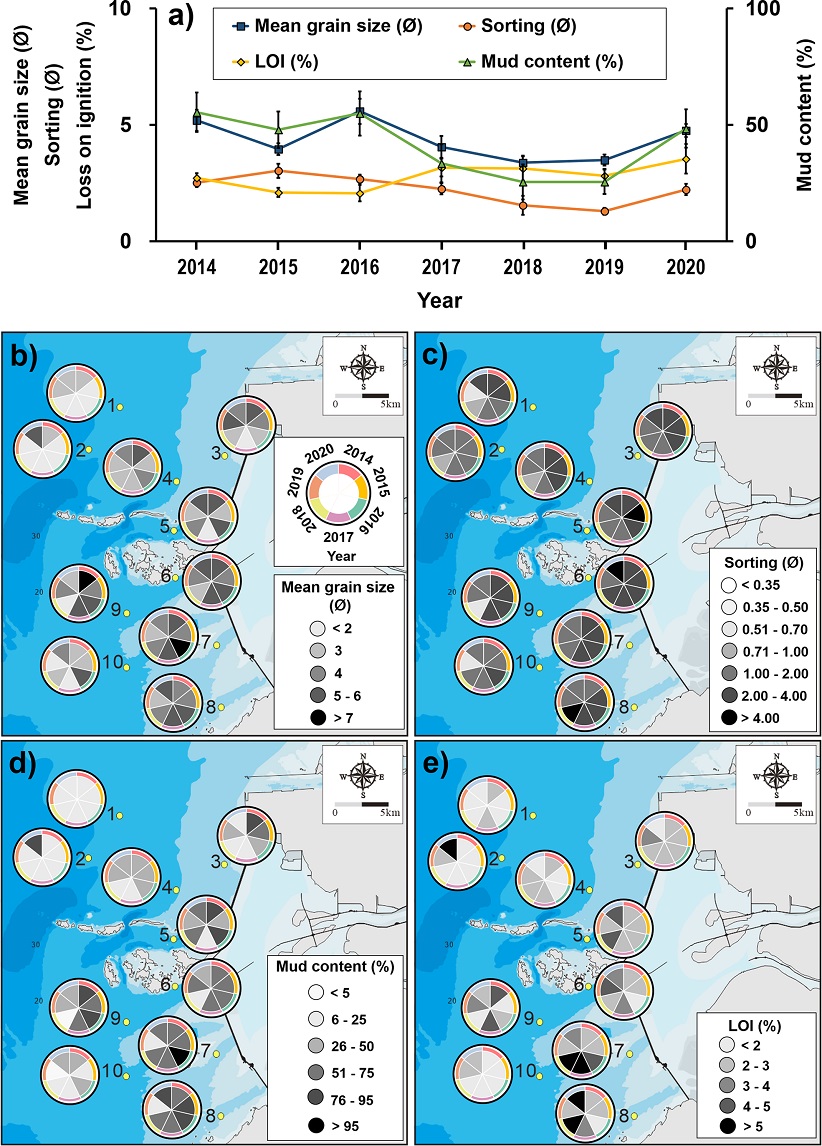
Spatio-temporal distribution of a) mean values of environmental characteristics b) mean grain size (∅), c) sorting (∅), d) mud content (%) and e) loss on ignition (LOI, %) in surface sediment of sampling stations in the study area.
평균 유기물함량은 2015년과 2016년에 2.1%로 가장 낮았으며 2017년 이후 전 연구기간동안 2.8% 이상으로 유지되었고 2020년에 3.5%로 유기물 오염도가 가장 높았다(Fig. 2a). 공간적으로는 고군산군도 인근에 위치한 정점(5, 6번)과 남쪽 방조제 인근에 위치한 정점(7, 8번)에서 3.0–4.0%의 비교적 높은 유기물함량을 보였으며 방조제와 먼 지역에 위치한 정점(1, 2, 10번)에서 2.5% 이하의 비교적 낮은 유기물함량을 보였다(Fig. 2e). 이러한 결과는 새만금 방조제 건설 이후 방조제와 인접한 지역에서 유속이 낮아지면서 나타나는 현상과 함께 신시, 가력 배수갑문 유출수의 영향으로 예상된다. 고군산군도 남쪽(정점 6, 7, 8, 9번) 지역은 배수갑문 유출수의 직접적인 영향권에 위치하고 있으며 여름철에는 남-서 계절풍과 조류의 영향으로 고군산군도 북쪽(정점 3, 4, 5번) 지역까지 그 영향권에 속한다(Cho et al.[2020]). 따라서 새만금 방조제 인근 조하대저서생태계의 퇴적상은 새만금 방조제 건설 이후 불규칙적인 물리적 교란으로 인한 퇴적상 변화와 새만금 방조제 내측에서 유입되는 오염물질의 직접적인 영향을 지속적으로 받고 있는 것으로 사료된다(Park et al.[2000]; An et al.[2006]; Seo and Lee[2011]).
3.2 새만금 방조제 외측 조하대 갯벌 저서동물 군집변화
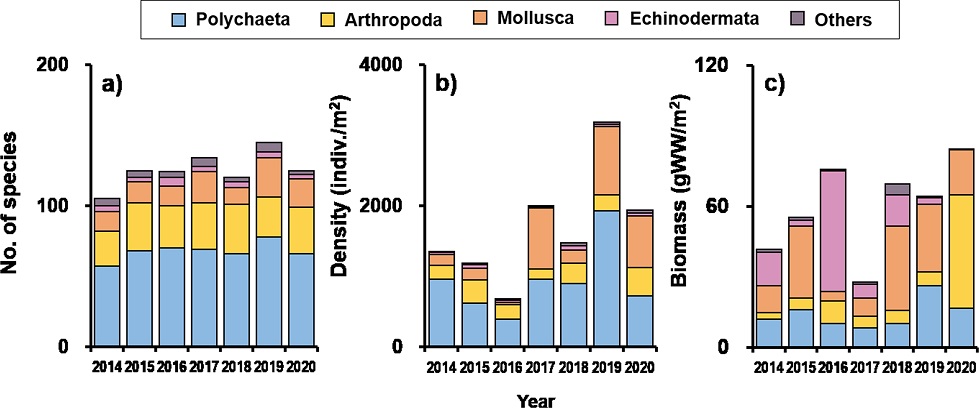
본 연구기간 동안 새만금 방조제 외측 조하대에서 채집된 대형저서동물 전체 출현종수는 255종이었으며, 분류군별로는 환형동물(47.1%), 절지동물(27.1%), 연체동물(19.6%), 극피동물(2.4%) 순으로 출현하였다. 조사시기별로는 2014년에 105종이 출현하여 가장 적었고, 2019년에 145종이 출현하여 가장 많았으며 전체 연구기간동안 평균 125종이 출현하였다(Table 1).
분류군별 출현종수는 환형동물이 50% 이상을 차지하였으며, 절지동물, 연체동물 순으로 나타났다(Fig. 3a). 지역별로는 비교적 수심이 깊고(> 15m) 방조제와 먼 북쪽해역(정점 1, 2번)과 고군산군도에 가장 인접한 지역(정점 5, 6, 9번)에서 가장 다양한 대형저서동물(101–142종)이 출현하였다(Fig. 4a). 반면 새만금 방조제와 인접한 고군산군도 북쪽 지역(정점 3, 4)과 고군산군도 남쪽 지역(정점 7, 8, 10)에서 80–93종이 출현하여 비교적 적은 출현종수를 보였다(Fig. 4a).
Temporal variations in a) number of species, b) density and c) biomass of macrozoobenthosby taxonomic groups in the study area.
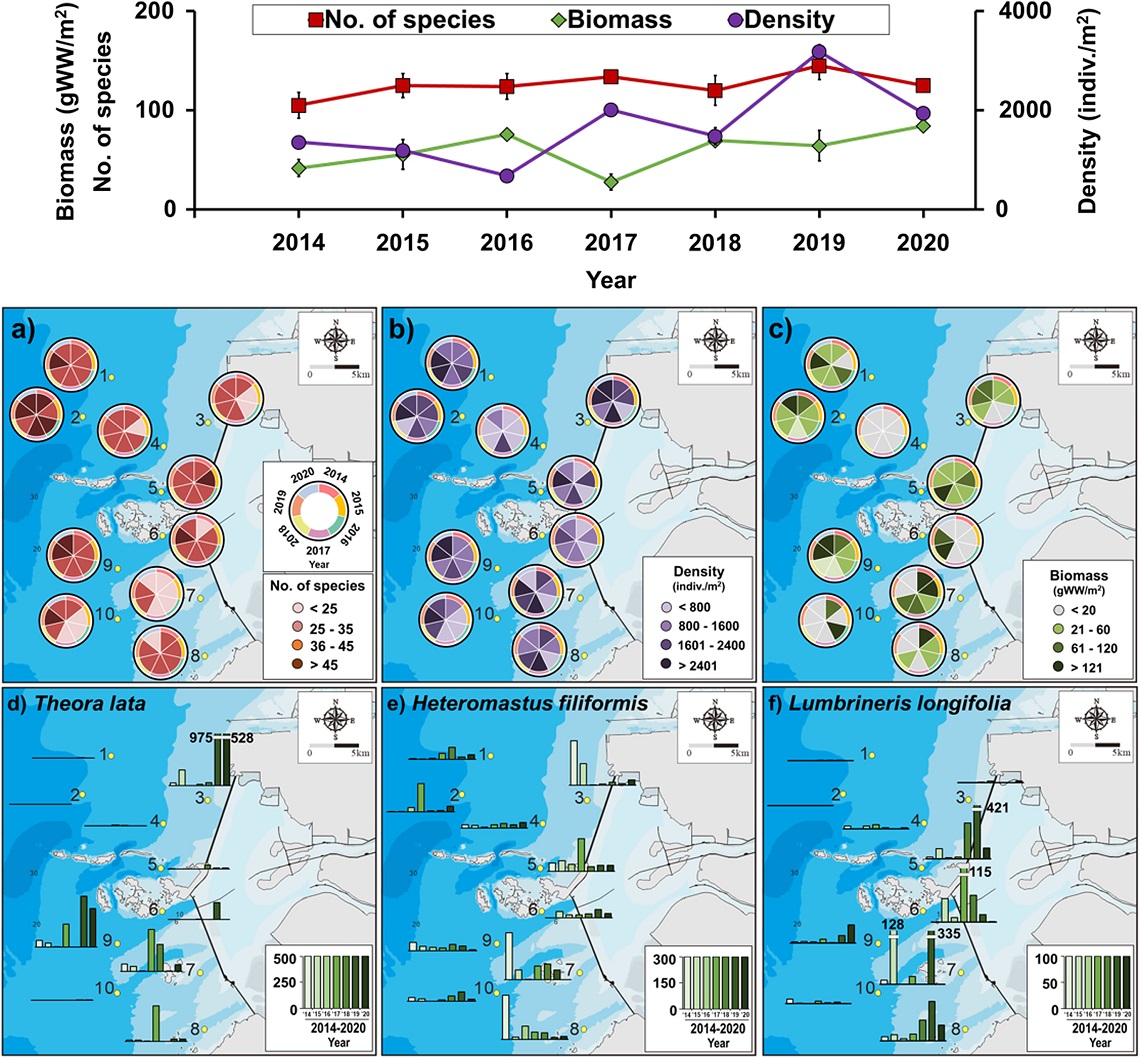
Spatio-temporal distribution of a) number of species, b) density and c) biomass of subtidal macrozoobenthiccommunity and the top 3 density-based dominant species: d) Theora lata, e) Heteromastus filiformis, f) Lumbrineris longifolia in the study area.
전체 대형저서동물 평균서식밀도는 1,692±331 indiv.m-2이었으며, 분류군별 서식밀도는 환형동물(54.9%), 연체동물(26.2%), 절지동물(15.1%), 극피동물(2.1%) 순이었다(Fig. 3b). 조사시기별로는 2016년에 가장 밀도가 낮았고(680±446 indiv. m-2) 2019년에 가장 높은 서식밀도를 보였다(3,186±1,719 indiv. m-2) (Fig. 4b). 대형저서동물의 출현양상은 표본의 규모에 따라 차이가 있을 수 있지만 서남해안 지역에서 여름철 수행된 유사 선행연구들과 비교해보면 새만금 방조제 외측 조하대에 서식하는 대형저서동물의 출현 종수 및 서식밀도는 득량만(145종, 998 indiv. m-2), 완도-도암만(186종, 1,299 indiv. m-2), 아산만(245종, 1,284 indiv. m-2)보다 높았고 여자만(274종, 2,346 indiv. m-2)보다 출현 종수는 낮았지만 평균서식밀도는 높았다(Yu et al.[2011]; Seo et al.[2014]; Lim[2015]; Lim et al.[2018]). 본 연구의 표본 규모(70개 정점)와 유사한 여자만(87개 정점)에서의 대형저서동물 출현양상이 새만금 방조제 외측 조하대와 유사하였으며(Lim[2015]), 표본 규모(22개 정점)는 작지만 여자만의 대형저서동물 출현양상 또한 새만금 방조제 외측 조하대와 상당히 유사하였다(Yu et al.[2011]).
전체 대형저서동물 평균생물량은 59.9 gWW m-2이었으며 분류 군별로는 연체동물(32.8%), 환형동물(23.7%), 극피동물(21.6%), 절지동물(19.6%) 순으로 나타났다(Fig. 3c). 조사시기별 생물량은 2017년에 27.7 gWW m-2로 가장 낮았고 그 이후로는 64 gWW m-2 이상의 생물량을 보였으며 2020년에 84.5 gWW m-2로 가장 높았다(Fig. 4c). 전체 연구기간동안 연구대상 지역에 서식하는 대형저서동물의 생물량은 극피동물인 모래무치염통성게(Echinocardium cordatum)와 연체동물인 대왕조개류(Macoma sp.), 아기반투명조개(Theora lata) 등 비교적 개체별 생물량이 높은 종의 출현여부에 따라 큰 변동성을 보였다(Fig. 4c). 서남해안 지역에서 수행된 유사 선행연구들과 비교해보면 새만금 조하대에 서식하는 대형저서동물의 생물량은 완도-도암만(265.7 gWW m-2), 천수만(214 gWW m-2)보다는 월등히 낮았고 여자만(77.4 gWW m-2), 아산만(73.6 gWW m-2)과는 유사하였다(Park et al.[2000]; Yu et al.[2011]; Lim[2015]; Lim et al.[2018]).
새만금 조하대에서 채집된 대형저서동물 중 개체수를 기준으로 1% 이상 우점한 종은 22종으로 전체 개체수의 74.1%를 차지하였으며 분류군별로는 환형동물 14종, 절지동물 4종, 연체동물 2종 등으로 나타났다(Table 2). 전체 연구기간동안 개체수로 가장 우점한 종은 T. lata로 전체 개체수의 18.6%를 차지하였으며 전체 조사정점의 51.4%에서 출현하였다(Table 2). 특히 T. lata는 2018년 이전까지는 고군산군도 남쪽해역(정점 7, 8, 9)에서 주로 고밀도로 출현하였고 2019년 이후 3번과 9번 정점에서 우점하며 높은 출현개체수를 보였다(Fig. 4d). 이 종은 니질 퇴적상을 선호하는 유기물 오염지시종으로 알려져 있는데(Poore and Kudenov[1978]; Yi et al.[1982]; Hong and Lee[1983]; Lim[1993]; Lim et al.[1995]), 본 연구지역에서는 니사질 퇴적상부터 사니질 퇴적상까지 넓은 범위의 퇴적환경에 서식하였으며(니질함량 17.5–73%, m=37.5%) 유기물함량 1.2–6.2% (m=3.6%) 범위에서 채집되었다(Fig. 5). 두 번째 우점종인 고리버들갯지렁이(Heteromastus filiformis)는 본 연구기간 동안 채집된 전체 출현 개체수의 11.9%를 차지하였는데, 이 종은 우리나라 전국 연안 갯벌에 넓게 분포하며 우점하는 종으로 비교적 유기물 오염도가 높은 환경을 선호한다고 알려져 있다(Shin et al.[1989]; Choi and Koh[1992]; Lee and Ryu[2018]). 총 조사기간 동안 전체 조사정점의 95.7%에서 출현하여 거의 대부분의 지역에서 출현하였으며(Fig. 4e) 가장 넓은 니질함량(6.6–85.1%, m=53.3%)과 유기물함량 (1.6–5.8%, m=2.8%)의 서식범위를 보였다(Fig. 5). 세 번째로 우점한 종은 긴자락송곳갯지렁이(Lumbrineris longifolia)로 전체 대형저서동물 개체수의 6.5%를 차지하였으며 조사기간 동안 전체 정점의 67.1%에서 출현하였다(Fig. 4f). 특히, 2019년에 431±89 indiv. m–2의 평균 서식밀도를 보여 다른 시기에 비해 월등히 많은 개체가 출현하였으며 니질함량 18.8–68.6%(m=36.2%)와 유기물함량 2.2–5.5% (m=2.9%)의 범위에서 서식하였다(Fig. 5). Lumbrineris longifolia 또한 우리나라 다수의 연안에서 우점하는 종으로 비교적 오염도가 높은 서식지를 선호하는 오염지시종으로 알려져 있다(Kitamori[1959]; Shin et al.[1989]; Shin and Koh[1990]; Lim[1993]; Lim and Choi[2001]).
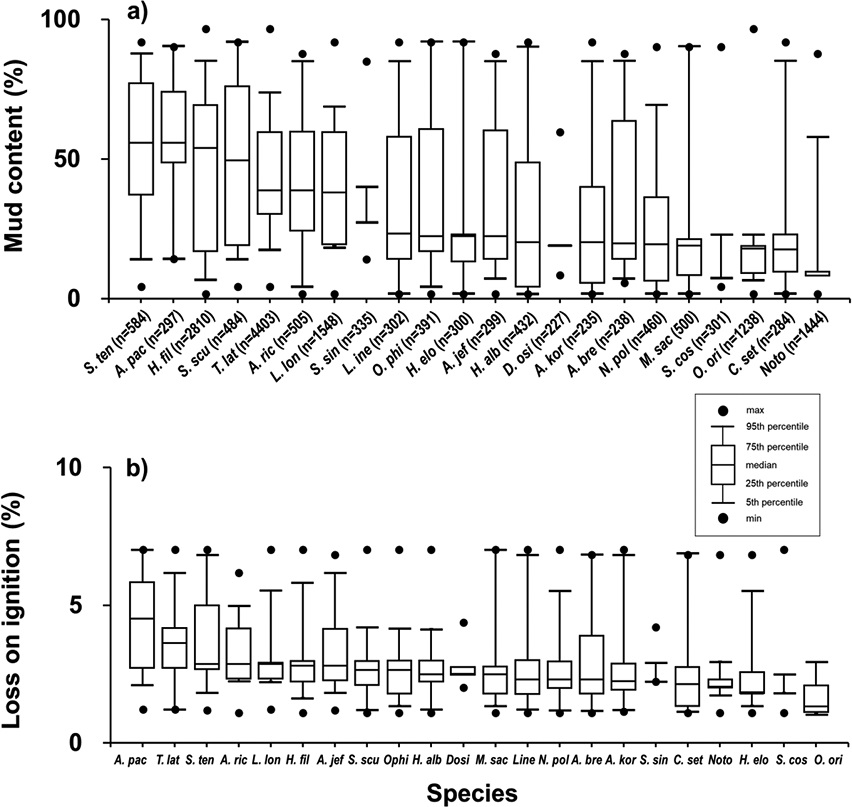
Box-and-whisker plot showing the range of a) mud content and b) loss on ignition in surface sediments inhabited by the top 22 macrozoobenthicspecies. Species names are abbreviated as four-letter codes: A. bre, Ampelisca brevicornis; A. jef, Aricidea jeffreysii; A. kor, Anaitides koreana; A. pac, Aricidea pacifica; A. ric, Aricidea sp.; C. set, Chaetozone setosa; Dosi, Dosinorbis sp.; H. alb, Hydatina albocincta; H. elo, Haploscoloplos elongates; H. fil, Heteromastus filiformis; L. lon, Lumbrineris longifolia; Line, Lineus sp.; M. sac, Magelona sacculata; N. pol, Nephtys polybranchia; Noto, Notomastus sp.; O. ori, Ogyrides orientalis; Ophi, Ophiura sp.; S. cos, Spiochaetopterus costarum; S. scu, Sternaspis scutata; S. sin, Sinocorophium sinensis; S. ten, Sigambra tentaculata; T. lat, Theora lata.
본 연구기간동안(2014년–2020년) 대형저서동물의 총 출현종수는 큰 변화가 없었지만 평균 서식밀도는 2017년 이후 1,400 indiv. m–2 이상 지속 출현하며 증가하는 경향을 보였다(Fig. 4). 새만금 방조제 완공(2006년) 이전과 완공 직후 주변 조하대 해역에서 선행된 연구결과들과 대형저서동물 출현양상을 비교해보면, 선행연구들의 경우 연구지역이 새만금 방조제 내측 해역을 포함하고 있으며 특히, An et al.[2006] 연구의 경우 여름철을 제외한 조사 시기를 포함하고 있고 대형저서동물의 채집을 위해 사용된 체의 망목이 0.5 mm로 본 연구에서 사용한 체의 망목(1.0 mm) 보다 작아 대형저서동물의 총 출현 종수의 직접적인 비교는 다소 어려울 수 있으나 새만금 방조제의 물막이 공사가 완공된 직후부터 최근까지 대형저서동물의 출현 종수는 점차 감소하고 있으며 서식밀도는 증가하는 경향을 확인 할 수 있었다(An et al.[2006]; Park [2009]) (Table 1). 새만금 방조제 완공 이전(~2005년) 연구대상 지역 조하대에서 여름철에 주로 우점하였던(>5%, > 50 indiv. m–2) 양손갯지렁이류(Magelona sp.)와 남방백금갯지렁이(Nepthys polybranchia), 오뚜기갯지렁이(Sternaspis scutata)는 2014년 이후 평균 40 indiv. m–2 이하로 감소하였으며, 우점률 또한 3% 미만으로 감소하였다(An et al.[2006]; Park[2009]). 반면 새만금 방조제 완공 이전 대형저서동물 개체수 우점도가 5% 미만이거나 비교적 적은 개체만 출현하던 T. lata, H. filiformis, L. longifolia, 가는버들갯지렁이류(Notomastus sp.), 뿔눈새우(Ogyrides orientalis)는 본 연구기간동안 평균 88 indiv. m–2 이상의 밀도로 지속 출현하며 우점율 5% 이상 최상위 우점종들로 분석되었다(An et al.[2006])(Table 2). 대형저서동물 최상위 우점종 3종(T. lata, H. filiformis, L. longifolia)은 모두 유기물 오염도가 비교적 높은 서식지를 선호하는 지시종들로 알려져 있는데 새만금 방조제 외측 조하대 해역 중 비교적 새만금 방조제와 가깝고, 수심이 얕으며 신시, 가력 배수갑문 배출수의 직간접적인 영향을 받는 지역에서만 불규칙적으로 극우점하는 특성을 나타냈다(Kitamori[1959]; Yi et al.[1982]; Shin et al.[1989]; Choi and Koh[1992]; Lim et al.[1995]; Lim and Choi[2001]; Cho et al.[2020]) (Fig. 4).
연구기간 총 7년에 걸쳐 새만금 외해역의 총 70개 정점에서 채집한 대형저서동물 개체수 자료를 이용하여 집괴분석(cluster analysis)을 수행한 결과 이들 정점들은 총 3개의 정점군으로 분류할 수 있었다(Fig. 6). 정점군 A는 정점 9번을 제외하고 모두 새만금 방조제에 인접하고 수심이 얕은 지역(정점 3–9)들로만 구성되었으며 정점군 B는 2014년 4번, 2017년 5번, 2018년 6번 정점을 제외하고 전체 연구기간동안 정점 1, 2, 10번을 모두 포함하였다(Fig. 6). 정점군 C는 2018년 8번 정점을 제외하고 모두 고군산군도에 가장 인접한 정점 5, 6번으로만 구성되었으며 2019년 이후에는 2020년 6, 7번 정점(기타 정점군)을 제외하고 모든 조사정점들이 정점군 A와 정점군 B로만 구성되는 특성을 보였다(Fig. 6). 정점군 A는 총 32개의 가장 많은 정점 포함하였으며 니질함량 50.1±24.7%, 유기물함량 3.2±1.3%, 평균입도 4.7±1.2 ∅ 범위의 저서환경 특성을 보였다(Table 3). 총 대형저서동물 출현종수는 182종, 평균 서식밀도는 2,094±1,224 indiv. m–2로 정점군들 중 가장 높은 서식밀도를 보였지만 종 다양도(H'), 균등도(J) 및 풍부도(R) 지수는 가장 낮았으며 종 우점도(D) 지수는 가장 높았다(Table 3). 정점군 A에 속하는 조사정점의 대형저서동물 최상위 우점종은 모두 비교적 오염된 환경을 선호하는 기회종으로 T. lata, H. filiformis, L. longifolia 등이었으며 특히 T. lata의 경우 다른 정점군에 비해 정점군 A에서 서식밀도가 가장 높았다(Kitamori[1959]; Yi et al.[1982]; Shin et al.[1989]; Choi and Koh[1992]; Lim et al.[1995]; Lim and Choi[2001])(Table 3). 정점군 B는 총 21개 정점으로 구성되었으며, 세 정점군 중 가장 낮은 니질함량(20.7±19.1%)과 유기물함량(2.2±1.2%) 특성을 보였다(Table 3). 대형저서동물 출현종수는 196종으로 가장 많았고 평균서식밀도는 1,981±1,189 indiv. m–2이었으며 생물량은 66.4±84.3 gWW m–2로 정점군들 중 가장 높았다(Table 3). 종 다양성지수(2.7±0.5) 및 우점도지수(0.4±0.2)는 정점군 C와 같은 값을 보였으나, 종 균등도지수는 정점군들 중 7.7±1.6로 가장 높았다(Table 3). 우점종은 조립한 퇴적상에서 주로 서식하는 Notomastus sp.와 O. orientalis로 다른 정점군에 비해 높은 서식밀도를 보였다(Kanaya and Kikuchi[2008]; Ozcan et al.[2008]). 정점군 C는 총 6개 정점으로 구성되었으며 평균 니질함량(67.2±13.9%)이 가장 높았고 총저서생물 출현 종(124종)과 평균서식밀도(1,031±580 indiv. m–2)는 가장 낮았다. 하지만 다른 정점군들과 비교하여 종 균등도는 가장 높았다(Table 3). 정점군 C에서는 특징적으로 옆새우류(Gammaropsis japonica)와 작은사슴갯지렁이(Ampharete arctica)가 상위우점군으로 서식하였으며 Magelona sacculata, Notomastus sp., S. scutata 등은 출현하지 않았다(Table 3).
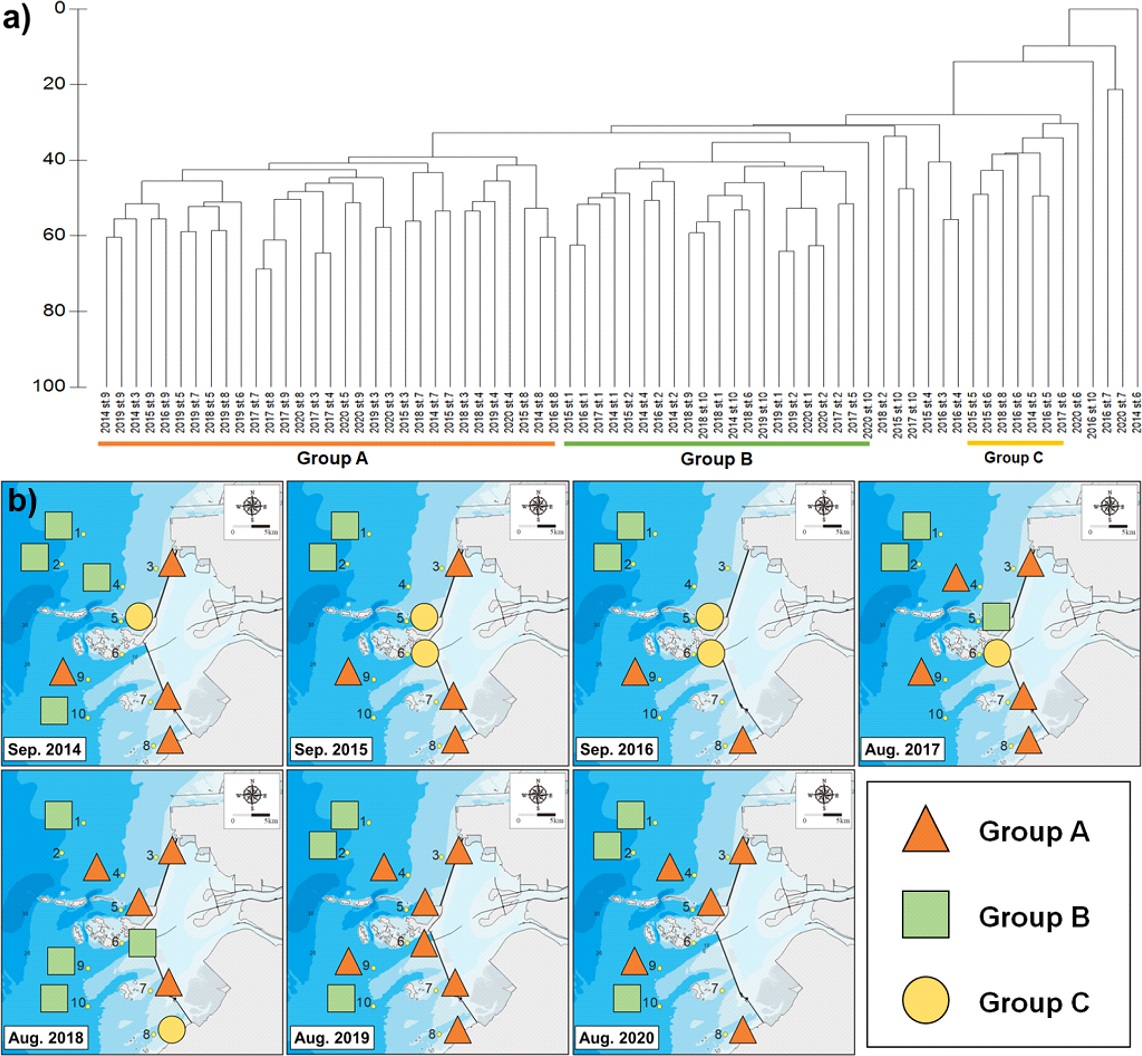
a) Dendrogramof cluster analysis grouping sampling stations/years based on Bray-Curtis similarity of species composition of macrozoobenthiccommunity in the study area. and b) spatio-temporal distributions of three station groups classified by cluster analysis based on Bray-Curtis similarity of species composition of macrozoobenthiccommunity in the study area.
Comparison of three station groups (A, B, C) in this study in term of environmental characteristics, community structure indices and density and biomass of dominant species (Mean±SE) (F: frequency (%))
BPI (Benthic pollution index)를 이용한 새만금 방조제 외해역조하대 저서환경 분석결과 본 연구기간동안 평균 70.4±12.2로 시화호, 진해만, 마산만, 광양만 등과 비교하여 비교적 양호한 상태의 저서환경을 보였으나 2017년 이후 2018년도(BPI 73)를 제외하고 68 이하로 BPI가 감소하는 추세를 보였다(Choi et al.[2003]; Lee et al.[2003]; Choi and Seo[2007]; Lim et al.[2007]). 지역별로는 새만금 방조제와 비교적 먼 외해역에 위치하며 신시, 가력 배수갑문 배출수의 영향범위 외에 있는 지역(정점 1, 2, 4, 10)에서 전체 연구기간 동안 2014년 2번 정점을 제외하고 모두 1등급의 BPI를 보여 새만금 방조제와 가까운 지역이거나 신시, 가력 배수갑문 배출수의 직간접적 영향권인 지역들보다 비교적 안정된 저서환경임을 시사했다(Cho et al.[2020])(Fig. 7). BPI 3등급을 포함하고 있는 정점들은 새만금 방조제에 인접해있거나 신시, 가력 배수갑문 배출수의 영향을 받는 정점들로 구성되어 있었으며 2020년 7번 정점을 제외하고 모두 유기물오염 지시종인 T. lata가 250 indiv. m–2이상 고밀도로 출현하여 우점한 지역이다. 2020년 7번 정점의 경우 T. lata의 밀도가 64 indiv. m–2로 다른 BPI 3등급의 정점들보다 출현 개체수는 적었지만 해당 조사 시기 채집된 전체 대형저서동물의 개체수가 극히 적어(69 indiv. m–2) T. lata가 극우점하는 특성을 보였다(Fig. 4a). 따라서 새만금 방조제 외측 해역 조하대 저서생태계는 전반적으로는 높은 BPI를 보여 비교적 안정된 상태로 보이나, 새만금 방조제 내측에서 신시, 가력배수갑문을 통해 배출되는 비교적 오염도가 높은 배출수의 영향권에 있는 방조제 근접 지역과 고군산군도 남쪽 지역의 경우 저서생태계의 변화가 지속적으로 발생되고 있는 것으로 보인다(Kim et al.[2009]; Park[2009]).
4. 결 론
새만금 방조제 외해역은 금강에서 유입되는 담수와 새만금 방조제의 신시, 가력배수갑문을 통해 유입되는 배출수의 영향이 저서생태계 환경 변화의 주요 원인으로 작용하고 있다. 연안지역에 인공 구조물이 건설되어 인위적인 교란이 발생될 경우 해수의 유동특성과 퇴적환경이 변화하게 되고 저서생물 군집구조는 그 영향을 받게 된다. 저서환경의 변화는 저서동물의 종수를 감소시킬 수 있으며 교란된 환경으로 인하여 기회종이 우점할 경우 저서동물의 서식밀도가 증가 할 수 있다. 새만금 외해역 저서 생태계는 새만금 방조제 완공 이후 총 출현 종수는 감소하고 서식밀도는 증가하는 경향을 보이고 있어 방조제 건설로 인한 저서생태계의 변화와 교란이 지속적으로 진행되고 있음을 시사한다. 새만금 방조제로부터 멀리 떨어진 해역과 북측해역에서는 비교적 안정적인 저서생태계가 유지되고 있다. 신시와 가력배수갑문을 통한 불규칙한 배출수의 영향을 받고 있는 남측해역 저서생태계의 경우 군집구조의 변화가 상대적으로 심하며 최근까지도 이러한 현상이 지속되고 있어 향후 해수유통 시나리오를 구성할 때 이러한 점이 반드시 고려되어야 한다.
Acknowledgments
본 연구는 해양수산과학기술진흥원(새만금 주변해역 해양환경 및 생태계관리 연구개발)의 지원을 받아 수행하였습니다.
References
-
An, S.M., Lee, J.H., Woo, H.J., Koo, B.J., Lee, H.G., Yoo, J.W. and Je, J.G., 2006, Benthic Environment and Macrofaunal Community Changes During the Dike Construction in Saemangeum Subtidal Area, Korea, Ocean Polar Res., 28(4), 369-383.
[https://doi.org/10.4217/OPR.2006.28.4.369]

-
Blanchet, H., Lavesque, N., Ruellet, T., Dauvin, J.C., Sauriau, P.G., Desroy, N., Desclaux, C., Leconte, M., Bachelet, G., Janson, A.L., Bessineton, C., Duhamel, S., Jourde, J., Mayot, S., Simon, S. and de Montaudouin, X., 2008, Use of Biotic Indices in Semi-enclosed Coastal Ecosystems and Transitional Waters Habitats-implications for the Implementation of the European Water Frame work Directive. Ecol. Indicators, 8(4), 360-372.
[https://doi.org/10.1016/j.ecolind.2007.04.003]

-
Cho, C.W., Song, Y.S. and Bang, K.Y., 2020, A Study on the Influence of the Saemangeum Sluice–Gates Effluent Discharge using the Particle Tracking Model, J Korean Soc. Coast. Ocean Eng., 32(4), 211-222.
[https://doi.org/10.9765/KSCOE.2020.32.4.211]

- Cho, Y.G., Ryu, S.O., Khu, Y.K. and Kim, J.Y, 2001, Geochemical Composition of Surface Sediments from the Saemangeum Tidal Flat, West Coast of Korea,「The Sea」 J. Korean Soc. Oceanogr., 6(1), 27-34.
- Choi, B.L., 1992, Illustrated Encyclopedia of Fauna and Flora of Korea, 33, Molluscs II, Seoul: Min Educ.
- Choi, J.W., Hyun, S.M. and Chang, M., 2003, The Summer Benthic Environmental Conditions Assessed by the Functional Groups of Macrobenthic Fauna in Gwangyang Bay, Southern Coast of Korea, Korean J. Environ. Biol., 21(2), 101-113.
- Choi, J.W. and Koh, C.H., 1992, The Distribution and Feeding Guilds of the Polychaete Community in the West Coast off Kunsan Korea. J. Oceanol. Soc. Kor., 27(3), 197-209.
-
Choi, J.W. and Seo, J.Y., 2007, Application of Biotic Indices to Assess the Health Condition of Benthic Community in Masan Bay, Korea. Ocean Polar Res., 29(4), 339-348.
[https://doi.org/10.4217/OPR.2007.29.4.339]

- Compton, R.R., 1985, Geology in the Field, New York, Wiley.
-
Feebarani J., Joydas T.V., Damodaran R., Borja A., 2016, Benthic Quality Assessment in a Naturally– and Humanstressed Tropical Estuary. Ecol. Ind., 67, 380-390.
[https://doi.org/10.1016/j.ecolind.2016.03.005]

-
Folk, R.L. and Ward, W.C., 1957, A Study in the Significance of Grain–Size Parameters, J. Sediment. Petrol., 27, 3-27.
[https://doi.org/10.1306/74D70646-2B21-11D7-8648000102C1865D]

-
Fujii, T., 2007, Spatial Patterns of Benthic Macrofauna in Relation to Environmental Variables in an Intertidal Habitat in the Humber Estuary, UK: Developing a Tool for Estuarine Shoreline Management, Estuar. Coast. Shelf Sci., 75, 101-119.
[https://doi.org/10.1016/j.ecss.2007.02.027]

- Gray, J.S., 1974. Animal–Sediment Relationships. Oceanogr. Mar. Biol. Ann. Rev., 12, 223-261.
-
Gray, J.S., 1997, Marine Biodiversity: Patterns, Threats and Conservation Needs, Biodivers, Conserv., 6, 153-175.
[https://doi.org/10.1023/A:1018335901847]

- Hong, J.S. and Lee, J.H., 1983, Effects of the Pollution on the Benthic Macrofauna in Masan Bay, Korea. J. Oceanogr. Soc. Kor., 18(2), 169-179.
-
Kanaya, G. and Kikuchi, E., 2008, Spatial Changes in a Macrozoobenthic Community along Environmental Gradients in a Shallow Brackish Lagoon Facing Sendai Bay, Japan. Estuar. Coast. Shelf Sci., 78(4), 674-684.
[https://doi.org/10.1016/j.ecss.2008.02.005]

- Kim, H.K., Lee, H.W., Choi, J.H. and Park, S.S., 2007, A Modeling Study for Change of Tidal Zone and Flushing Rate by the Construction of Sea Dike. J. Korean Soc. Environ. Eng., 29(10), 1106-1113.
- Kim, H.S., 1973, Illustrated Encyclopedia of Fauna and Flora of Korea, 14, Anomura Brachyura. Seoul: Min Educ.
- Kim, H.S., 1977, Illustrated Encyclopedia of Fauna and Flora of Korea, 19, Macurura, Seoul: Min Educ.
-
Kim, J.C., Ma, C.W. and Bok, Y.W., 2014, An Ecological Study on Subtidal Macrobenthos Inside and Outside of Saemangeum Dike, Korean J. Environ. Ecol., 28(4), 442-449.
[https://doi.org/10.13047/KJEE.2014.28.4.442]

-
Kim, M. and Koo, B.J., 2016, Changes in the Macrobenthic Community in Sihwa Tidal Flat after Operation of the Tidal Power Plant. Ocean Polar Res., 38(4), 315-324.
[https://doi.org/10.4217/OPR.2016.38.4.315]

-
Kim, S.H., Kim, K., Lee, M., Jeong, H.J., Kim, W.J., Park, J.G. and Yang, J.S., 2009, Enhanced Benthic Nutrient Flux during Monsoon Periods in a Coastal Lake Formed by Tideland Reclamation, Estuar. Coast., 32(6), 1165-1175.
[https://doi.org/10.1007/s12237-009-9217-1]

-
Kim, T.I., Lee, H.R. and Chang, K.I., 2006, Seasonal Variation of Density Stratification in the Saemangeum Waters, Korea, Ocean Polar Res., 28(3), 339-352.
[https://doi.org/10.4217/OPR.2006.28.3.339]

- Kitamori, R., 1959, The Benthic Community in Polluted Coastal Water, Osaka Bay. Bull. Inland Sea Reg. Fish. Res. Lab., 16, 1-83.
- Koh, C.H., Ryu, J.S. and Khim, J.S., 2010, The Saemangeum : History and Controversy, J. Korean Soc. Mar. Environ. Energy, 13(4), 327-334.
-
Koo, B.J., Shin, S,H. and Lee, S., 2008a, Changes in Benthic Macrofauna of the Saemangeum Tidal Flat as Result of a Drastic Tidal Reduction, Ocean Polar Res., 30(4), 485-495.
[https://doi.org/10.4217/OPR.2008.30.4.485]

-
Koo, B.J., Shin, S,H., Woo, H.J., Kim, E.S. and Je, J.G., 2008b, Changes in Macrobenthic Community Structure on Gunsan Tidal Flat after the Closing of the Saemangeum 4th Dyke, Ocean Polar Res., 30(4), 497-507.
[https://doi.org/10.4217/OPR.2008.30.4.497]

- Korea Ocean Research & Development Institute (KORDI), 1995, Marine environmental assessment based on the bentinc faunal communities–management technique for marine environmental protection.
-
Lee, J.H. and Ryu, J.S., 2018, Short–term Variations in Spatial Distribution of the Macrozoobenthic Community near the Geum River Estuary, Korea, J. Korean Soc. Mar. Environ. Energy, 21(4), 368-380.
[https://doi.org/10.7846/JKOSMEE.2018.21.4.368]

- Lee, J.H., 2012, Spatial and temporal variation of benthic polychaetous community in the offshore area outside Saemangeum dike since Saemangeum dike construction, Ph.D. Dissertation, Chonnam National University.
-
Lee, J.H., Lee, J.S., Park, Y.G., Kang, S.G., Choi, T.S., Gim, B.M and Ryu, J.S., 2014, Environmentally Associated Spatial Distribution of a Macrozoobenthic Community in the Continental Shelf off the Southern Area of the East Sea, 「The Sea」 J. Korean Soc. Oceanogr., 19(1), 66-75.
[https://doi.org/10.7850/jkso.2014.19.1.66]

-
Lee, J.H., Park, H.K., Park, H.S. and Kim, D.S., 2003, Environmental Assessment of the Shihwa Lake by using the Benthic Pollution Index, Ocean Polar Res., 25(2), 183-200.
[https://doi.org/10.4217/OPR.2003.25.2.183]

-
Levin, L.A., Etter, R.J., Rex, M.A., Gooday, A.J., Smith, C.R., Pineda, J., Stuart, C.T., Hessler, R.R. and Pawson, D., 2001, Environmental Influences on Regional Deep–sea Species Diversity. Ann. Rev. Ecol. Syst., 32(1), 51-93.
[https://doi.org/10.1146/annurev.ecolsys.32.081501.114002]

- Lim, H.S. and Choi, J.W., 2001, Macrobenthic Community in the Soft Bottom around Sorido Island, Southern Coast of Korea, J. Korean Fish. Soc., 34(3), 225-237.
- Lim, H.S., 1993, Ecology on the Macrozoobenthos in Chinhae Bay of Korea, PD. D. Thesis Nat. Fish. Univ. Pusan.
-
Lim, H.S., 2015, Spatial Distribution of Soft Bottom Macrobenthos of Yeoja Bay in Summer Season, South Coast of Korea. 「The Sea」 J. Korean Soc. Oceanogr., 20(2), 78-91.
[https://doi.org/10.7850/jkso.2015.20.2.78]

- Lim, H.S., Choi, J.W. and Son, M.H., 2018, Macrozoobenthic Community Structures in the Shallow Subtidal Soft–bottoms around Wando–Doam Bay during Summer Season.「The Sea」 J. Korean Soc. Oceanogr., 23(2), 91-108.
- Lim, H.S., Hong, J.S. and Je, J.G., 1995, Abundance and Distribution Pattern of the Smelid Bivalve, Theora fragilis A. Adams in Chinhae Bay, Korea, Korean J. Malacol., 11(1), 21-34.
- Lim, K.H., 2007, Long–term Variation of Benthic Environment and Macrofaunal Community on Tidal Flat with the Progress of Saemangeum Sea Dike Construction. Ph.D. dissertation, Chonnam National University.
- Lim, K.H., Shin, H.C., Yoon, S.M. and Koh, C.H., 2007, Assessment of Benthic Environmental based on Macrobenthic Community Analysis in Jinhae Bay, Korea,「The Sea」 J. Korean Soc. Oceanogr., 12(1), 9-23.
- Margalef, R., 1958, Information Theory in Ecology, General. Syst., 3, 36-71.
-
Millet, B. and Guelorget, O., 1994, Spatial and Seasonal Variability in the Relationships Between Benthic Communities and Physical Environment in a Lagoon Ecosystem, Mar. Ecol. Prog. Ser., 108, 161-174.
[https://doi.org/10.3354/meps108161]

- Ministry of Ocean and Fisheries (MOF, South Korea), 2013, Korean Marine Water Quality Testing Guideline.
- MOMAF, 2007, Intergrated preservation study on the marine environments in the Saemangeum area (1st Year of 2nd Phase, 2006). KORDI Research Report, BSPM 37900-1854-1.
- MOMAF, 2009, Intergrated preservation study on the marine environments in the Saemangeum area(2008). KORDI Research Report, BSPM 51001-2041-2.
-
Ozcan, T., Katağan, T. and Ateş, A.S., 2008, A New Record of the Lessepsian Shrimp, Ogyrides mjoebergi (Balss, 1921) (Decapoda, Ogyrididae) from the Levantine Coast of Turkey, Crustaceana, 81(6), 755-758.
[https://doi.org/10.1163/156854008784513500]

- Paik, E.I., 1989, Illustrated Encyclopedia of Fauna and Flora of Korea, 31, Polychaeta, Seoul: Min Educ.
- Park, H.S., Lim, H.S. and Hong, J.S., 2000, Spatio and Temporal Patterns of Benthic Environment and Macrobenthos Community on Subtidal Soft–Bottom in Consu Bay, Korea, J. Korean Fish. Soc., 33(3), 262-271.
- Park, S.H., 2009, Macrobenthic Community Health Assessment in the Saemangeum Subtidal Area Using the Benthic Biotic Index, MS. Thesis Nat. Fish. Univ. Pusan.
-
Pielou, E.C., 1966, The Measurement of Diversity in Different Types of Biological Collections, J. Theor. Biol., 13, 131-144.
[https://doi.org/10.1016/0022-5193(66)90013-0]

-
Poore, G.C., Kudenov, J.D., 1978, Benthos of the Port of Melbourne: The Yarra River and Hobsons Bay, Victoria, Aust. J. Mar. Freshwater Res., 29(2), 141-155.
[https://doi.org/10.1071/MF9780141]

-
Rakocinski, C.F., Brown, S.S., Gaston, G.R., Heard, R.W., Walker, W.W. and Summers, J.K., 1997, Macrobenthic Responses to Natural and Contaminant−related Gradients in Northern Gulf of Mexico Estuaries. Ecol. Appl., 7(4), 1278-1298.
[https://doi.org/10.1890/1051-0761(1997)007[1278:MRTNAC]2.0.CO;2]

-
Ryu, J.S., Khim, J.S., Choi, J.W., Shin, H.C., An, S.M., Park, J.S., Kang, D.S., Lee, C.H., Koh, C.H., 2011, Environmentally Associated Spatial Changes of a Macrozoobenthic Community in the Saemangeum Tidal Flat, Korea, J. Sea Res., 65, 390-400.
[https://doi.org/10.1016/j.seares.2011.03.003]

-
Sanders, H.L., 1968, Marine Benthic Diversity: A Comparative Study. Am. Nat., 102(925), 243-282.
[https://doi.org/10.1086/282541]

- Seo, J.Y., 2016, A Study on the determination of threshold value of benthic community health and application of Benthic Pollution Index (BPI) to special management areas the southern coasts of Korea, Ph.D. dissertation, Pusan National University.
-
Seo, J.Y., Lim, H.S. and Choi, J.W., 2014, Distribution Patterns of Macrobenthic Fauna Communities in Deukryang Bay, One of the Environment Conservation Areas of Korea. Ocean Sci. J., 49(2), 97-113.
[https://doi.org/10.1007/s12601-014-0011-z]

-
Seo, S.W. and Lee, H.Y., 2011, Analysis of Hydrodynamic Change around the Saemangeum Area Using a Particle Tracking Method, J. Korean Soc. Coast. Ocean Eng., 23(6), 442-450.
[https://doi.org/10.9765/KSCOE.2011.23.6.442]

- Shannon, C.E. and Weaver, W., 1963, The Mathematical Theory of Communication, Univ. Illinois. Pre. Urbana.
- Shim, J.H., Koh, C.H., Kim, S.J., Lee, T.W. and Park, Y.C., 1988, Analysis of the ecosystem. Yellow Sea. KOSEF.
- Shin, H.C. and Koh, C.H., 1990, Temporal and Spatial Variation of Polychaete Community in Kwangyang Bay, Southern Coast of Korea. J. Oceanogr. Soc. Korea, 25(4), 205-216.
- Shin, H.C., Choi, J.W. and Koh, C.H., 1989, Faunal Assemblages of Benthic Macrofauna in the Inter–and Subtidal Region of the Inner Kyeonggi Bay, West Coast of Korea. J. Oceanol. Soc. Kor., 24(4), 184-193.
- Shin, S. and Rho, B.J., 1996, Illustrated Encyclopedia of Fauna and Flora of Korea, 36, Echinodermata, Seoul: Min Educ.
-
Simpson, E.H., 1949, Measurement of Diversity, Nature, 163(4148), 688-688.
[https://doi.org/10.1038/163688a0]

- Snelgrove, P.V.R. and Butman, C.A., 1994, Animal–sediment Relationships Revisited: Cause versus Effect, Oceanogr. Mar. Biol. Ann. Rev., 32, 111-177.
-
Sousa, R., Dias, S. and Antunes, J.C., 2006, Spatial Subtidal Macrobenthic Distribution in Relation to Abiotic Conditions in the Lima Estuary, NW of Portugal, Hydrobiol., 559(1), 135-148.
[https://doi.org/10.1007/s10750-005-1371-2]

- Tunnicliffe, V. and Risk, M.J., 1977, Relationship Between the Bivalve Macoma balthica and bacteria in Intertidal Sediments: Minas Basin, Bay of Fundy. J. Mar. Res., 35, 499-507.
-
Woo, H.J., Choi, J.U., An, S.M., Kwon, S.H. and Koo, B.J, 2006, Changes of Sedimentary Environments in the Saemangeum Tidal Flat on the West Coast of Korea, Ocean Polar Res., 28(4), 361-368.
[https://doi.org/10.4217/OPR.2006.28.4.361]

- Yi, S.G., Hong, J.S. and Lee, J.H., 1982, A study on the Subtidal Benthic Community in Ulsan Bay, Korea. KORDI, 4, 17-26.
-
Ysebaert, T., Fettweis, M., Meire, P. and Sas, M., 2005, Benthic Variability in Intertidal Soft–sediments in the Mesohaline Part of the Schelde Estuary, Hydrobiol., 540, 197-216.
[https://doi.org/10.1007/s10750-004-7144-5]

-
Ysebaert, T., Herman, P.M.J., Meire, P., Craeymeersch, J., Verbeek, H. and Heip, C.H.R., 2003, Large–scale Spatial Patterns in Estuaries: Estuarine Macrobenthic Communities in the Schelde Estuary, NW Europe, Estuar. Coast. Shelf Sci., 57, 335-355.
[https://doi.org/10.1016/S0272-7714(02)00359-1]

- Yu, O.H., Lee H.G. and Lee, J.H., 2011, Original Articles: The Influence of Environmental Variables on Macrobenthic Communities after Dike Construction in Asan Bay, Korea, Korean J. Environ. Biol., 29(4), 326-344.