동해 울진 바다목장 해역의 생물해양학적 환경특성. 1. 식물플랑크톤 군집의 시·공간적 분포 특성


초록
울진 동해바다목장 해역의 식물플랑크톤 군집의 시·공간적 분포특성을 파악하기 위하여 2008년 4월부터 11월까지 9개 정점의 표층과 10 m 수심에서 4회 현장조사를 실시하였다. 출현한 식물플랑크톤은 67속 123종으로 다양하였다. 군집은 규조류가 60.5%, 와편모조류가 34.6%를 차지하였고, 가을에 가장 많은 종이 출현하였다. 현존량은 9월 1.8 × 103 cells·L-1에서 4월 2.4 × 105 cells·L-1의 범위로 연평균 4.8 × 104 cells·L-1로 낮았다. 최우점 및 차우점종은 4월 소형인 Thalassiosira sp., Pseudo-nitzschia pungens. 6월은 Leptocylindrus danicus, Guinardia striata, 9월은 Cheatoceros cirvisetus, Ch. decipiens 그리고 11월은 Skeletonema costatum -ls (like species), Pn. pungens가 차지하였다. 종 다양성지수는 4월 낮고 9월에 높은 반면, 우점도 지수는 이와 반대 양상을 보였다. 집괴분석에 의한 해역구분에서는 전반적으로 해안선과 평행하게 연안 및 바깥 해역으로 구분되어, 식물플랑크톤 군집은 영양염류 공급과 해수유동에 의해 지배되는 것으로 판단되었다. 때문에 이러한 해역특성은 동해 바다목장 운영 및 관리에 충분하게 고려되어야만 할 것이다.
Abstract
This study describes the spatio-temporal distributions in phytoplankton community such as species composition, standing crops and dominant species from April to November 2008 in the Uljin Marine Ranching Area (UMRA). A total of 123 species of phytoplankton belonging to 67 genera was identified. In particular, diatoms and dinoflagellates were occupied more than 60.5% and 34.6% of total species, respectively. The annual dominant species were Thalassiosira sp., Pseudo-nitzschia pungens in spring, Leptocylindrus danicus, Guinardia striata in early summer, Cheatoceros cirvisetus, Ch. decipiens in early autumn and Skeletonema costatum -ls (like species), Pn. pungens in autumn. Phytoplankton cell density fluctuated with an annual mean of 48 cells·mL-1 between the lowest value of 1.8 cells·mL-1 in early autumn and the highest value of 240 cells·mL-1 in spring. According to the cluster analysis, the phytoplankton community of the UMRA was characterized by the nutrient supply from land side and water movement as current.
Keywords:
Spario-temporal distribution, Phytoplankton community, Uljin Marine Ranching Area(UMRA), Cluster analysis키워드:
시공간적 분포, 식물플랑크톤 군집, 동해 울진바다목장 해역, 집괴분석1. 서 론
바다목장은 다양한 환경 인자에 의해 황폐화되어 있는 연안해역의 생산성과 경제성을 높이기 위해서 특정해역에 대한 해양환경과 생물의 군집구조를 개선하여 해역생태계를 자원생물의 육성에 바람직한 방향으로 변화시키고자 하는 사업이다. 동해 바다목장은 울진군 후포연안 20 km2 규모해역에 2002년부터 2013년까지 355억 원을 투입하여, 바다낚시 잔교를 설치한 해상낚시공원과 바다목장 체험관 및 홍보관 등을 포함하는 관광형 국가시범 바다목장으로 2014년 11월 준공되었다. 해양환경의 계절변동이 심하게 나타는 연안해역에 시설된 바다목장의 효율적인 자원조성 및 관리를 위해서는 무생물환경과 생물군집을 포함한 연간 변동특성을 정확하게 이해하는 것이 중요하다. 동해 바다목장 해역은 동해안을 따라 북상하는 쓰시마난류 지류인 동한난류 및 조류, 그리고 바람에 의해 발생하는 취송류 성분들이 복잡하게 작용하는 해역이다. 연안에서 해수유동은 바다의 물질수송은 물론, 물질의 이동과 확산. 그리고 그에 따른 해수의 화학성분 및 해양생물의 공간적 분포에 크게 영향을 준다.
이러한 연안해양생태계의 먹이사슬은 광합성으로 태양에너지를 합성하여 상위 영양단계의 소비자에게 에너지를 공급하는 식물플랑크톤에 의해 출발점이 만들어 진다. 즉 식물플랑크톤은 바다의 물질순환과 생태구조의 출발점을 형성하고 있어, 전체 먹이사슬의 구조를 결정시킨다(Street and Paytan[2005]). 식물플랑크톤이 외부에서 유입되는 영양염류의 공급(bottom-up)에 의해 지배되거나, 상위 영양단계인 동물플랑크톤 포식압(top-down)에 의해 지배되느냐는 생태구조의 특성을 다르게 한다(Kirk[2011]; Severiano et al.[ 2012]). 이외에도 식물플랑크톤은 빛, 해수유동 등 다양한 무생물적 환경요인에 의해 영향을 받고 있다(Castro and Huber[2010]). 때문에 해역에서 식물플랑크톤 군집의 특성을 파악하는 것은 먹이사슬 전체를 이해하는데 매우 중요한 단서로서 작용한다.
그러나 현재까지 울진 바다목장 해역 및 주변 해역을 대상으로 수행된 해양환경 및 식물플랑크톤 군집에 대한 조사연구는 울진 원자력발전소와 관련된 일부 연구결과가 보일 뿐이다(Kang and Choi[2001], [2002], [2003]). 그리고 바다목장 해역에서는 식물플랑크톤 등 기초생물에 대한 연구결과는 보이지 않고, 일부 해조류 및 어류에 대한 연구 결과가 있을 뿐이다(Choi et al.[2006]; Hwang et al.[2012], Hwang et al.[2012]; Yoon et al.[2013] etc).
따라서 이 연구는 동해 바다목장 주변해역의 식물플랑크톤 군집을 통한 저차영양구조 및 물질순환 구조를 파악하여 바다목장 해역의 효율적 관리와 생산증대에 필요한 기초 자료를 제공하고자 한다.
2. 재료 및 방법
동해 바다목장 해역의 식물플랑크톤 군집의 시·공간적 분포 및 변동양상과 생물량 변동특성을 파악하기 위해 동해 후포리에서 군사리 해역에 걸쳐 9개의 정점(Fig. 1)을 대상으로 2008년 4월 24일(음력 3. 19), 6월 27일(음력 5. 24), 9월 10일(음력 8. 11) 및 11월 4일(음력 10. 7), 4회에 걸쳐 현장조사를 실시하였다. 현장조사는 용선한 소형선박을 이용하여 각 정점의 표층과 10m 수심의 해수를 채수하여 식물플랑크톤의 정성 및 정량분석을 실시하였다.
식물플랑크톤의 표본 채집은 Van Dorn 채수기를 이용하여 각 정점의 표층과 10m 수심에서 채수하였다. 채집된 해수시료는 500ml용 폴리에칠렌 표본병에 넣어 Lugol’s 용액으로 2%되도록 현장에서 고정하였다. 실험실에서 고정된 해수시료의 500 ml를 취하여 침전법에 의해 최종농도가 5 ml 되도록 농축하여 검경 시료로 사용하였다. 정량분석을 위하여 농축된 시료를 균일하게 희석한 후 1.0ml를 취하여 Sedgwick Rafter chamber에 취해 광학현미경(Nikon)을 이용, 100-400X 배율에서 동정과 계수를 실시한 다음 단위체적당 세포수를 현존량으로 환산하였다. 시료의 분류 및 동정은 Cupp[1943], Dodge[1982], Chihara and Murano[1996], Tomas[1997] 등의 참고문헌을 이용하였고, 분류체계는 World Register of Marine Species(WoRMS, www.marinespecies.org)에 준하여 정리하였다.
우점종은 전체 정점 평균으로 5% 이상의 세포밀도를 보인 종들을 대상으로 정리하였고 각 정점의 식물플랑크톤 현존량 중에서 차지하는 비율이 가장 높은 종을 최우점종으로 하였다. 그리고 출현종과 현존량을 이용하여 식물플랑크톤 군집의 특성을 설명하는 종 다양성 지수(H'), 종 풍부도 지수(R), 종 균등도 지수(J), 우점도 지수(D)를 정점별로 다음 계산식을 기초로 하는 Primer 프로그램(ver. 6.0)을 이용하여 계산하였다.
- ① 종다양성지수: H' = -ΣPi×ln(Pi) (Shannon and Weaver[1963])
- Pi : i번째 종의 점유율
- ② 종풍부도지수: R = (S-1)/ln(N) (Margalef[1958])
- S : 출현종수, N: 총출현개체수
- ③ 종균등도지수: J = H'/ln(S) (Pielou[1966])
- ④ 우점도지수: D = (Y1 + Y2)/Y (McNaughton[1968])
- Y : 총개체수, Y1과 Y2 : 첫 번째와 두 번째 우점종의 개체수
그리고 각 정점의 식물플랑크톤 군집 유사도에 의한 해역구분을 실시하기 위하여 집괴분석(cluster analysis)을 실시하였다. 자료는 전 출현종을 대상으로 하였으며, 정점간 유사도지수는 Bray and Curtis 지수를, 그리고 정점 결합은 가중평균결합법(WPGMA)을 사용하였다.
3. 결과 및 고찰
3.1 식물플랑크톤 종조성
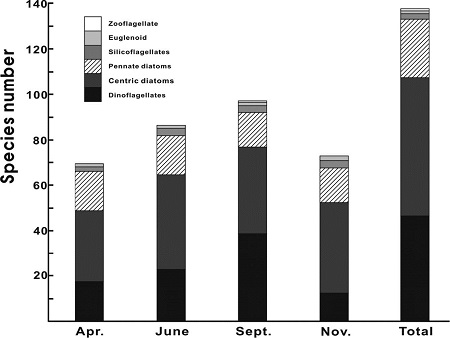
2008년 동해 바다목장 해역에 출현한 식물플랑크톤 종은 67속 123종으로 규조류가 42속 76종으로 61.8%, 와편모조류가 21속 42종으로 34.1%, 규질편모조류가 2속 3종으로 2.4%, 그리고 유글레나조류 및 동물성편모조류가 각각 1속 1종으로 각 0.8%의 점유율을 나타내었다. 시간적으로는 6월과 9월에 75종 이상 많은 종이 출현하였지만, 4월과 11월은 65종 이하로 상대적 낮은 종이 출현하였다(Fig. 2).
출현종의 시간적 변화는 2008년 4월, 전체 50속 74종으로, 중심규조류와 우상규조류가 각각 20속 39종 및 14속 14종으로 71.6%의 점유률을 보였고, 와편모조류가 12속 18종으로 23.3%, 기타 규질편모조류가 2속 2종, 유글레나조류 및 동물성 편모조류가 각 1속 1종으로 기타가 5.4%의 점유율을 보였다(Fig. 2). 수심별은 표층이 65종, 10 m 수심이 61종이 출현하여 수심에 따른 차이는 없었다. 6월은 48종 76종으로, 중심규조류와 우상규조류가 각 18속 37종 및 14속 15종으로 68.4%, 와편모조류가 13속 20종으로 26.3%, 기타 규질편모조류가 2속 3종, 유글레나조류가 1속 1종으로 5.3%의 점유률로 4월에 비해 규조 점유율은 다소 낮아지고 편모조류 점유률은 다소 높아지지만, 전체적으로는 4월과 유사하였다(Fig. 2). 수심별은 표층이 60종, 10 m 수심이 67종이 출현하여 10 m 수심에서 다소 많은 종이 출현하였다. 9월은 51종 85종으로 중심 및 우상규조류가 각 18속 33종 및 13속 11종으로 54.1%, 와편모조류가 18속 35종으로 41.2%, 기타 규질편모조류와 동물성 편모조류가 각 2속 2종 및 1속 1종으로 4.7%의 점유률을 나타내었다(Fig. 2). 수심별은 표층이 75종, 10 m 수심이 67종으로 6월과는 달리 표층에서 많은 종이 출현하였다. 11월은 45속 65종으로 중심 및 우상규조류가 각 20속 35종 및 13속 14종으로 75.4%, 와편모조류가 8속 12종으로 18.5%, 기타 규질편모조류 2속 2종, 유글레나조류 및 동물성편모조류가 각 1속 1종으로 6.2%의 출현 점유률을 나타내어, 규조류에 의한 점유률이 높았다(Fig. 2). 수심별은 표층이 60종, 10 m 수심이 67종으로 6월과 같이 10 m 수심에서 다소 많은 종이 출현하였다.
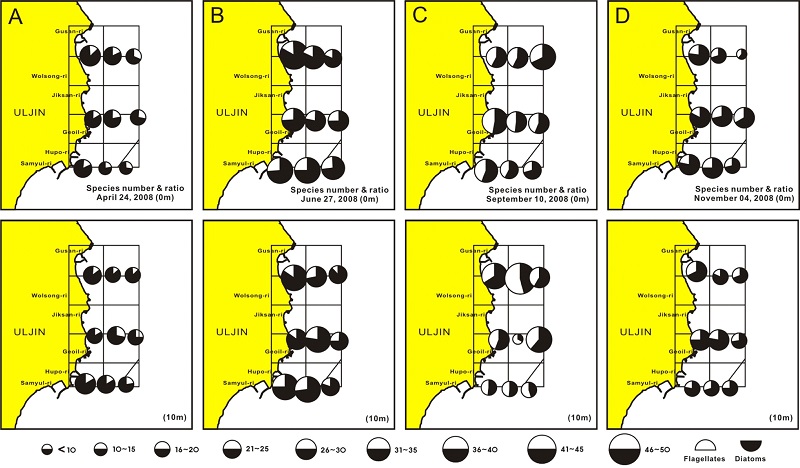
식물플랑크톤 출현종의 공간분포는 4월 표층에서 연안해역에서 많은 종이 출현하여 점차 바깥해역으로 진행될수록 종수는 감소하였다(Fig. 3A, upper). 이런 변동은 표층과 10 m 모두에서 관찰되지만, 표층보다 10 m에서 감소경향이 완만하였다. 그리고 10 m 수심은 북쪽보다 남쪽해역에서 출현 종이 많았다(Fig. 3A, lower). 또한 표층이 10 m 수심보다 편모조류 구성비가 다소 높았지만, 전체적으로는 규조류 구성비가 매우 높게 나타났다(Fig. 3A). 6월은 4월보다 많은 종에 출현하였지만, 분포경향은 4월과 유사하여, 표층은 많은 종수가 출현한 연안해역에서 바깥해역으로 갈수록 종수가 감소하였다. 편모조류의 구성비는 북쪽보다 남쪽해역에서 다소 높았다(Fig. 3B, upper), 10 m 수심도 전체적으로는 표층과 유사한 분포를 보이나, 70 m 등심선 보다 깊은 바깥해역에서 규조류 구성비가 높게 나타났다(Fig. 3B, lower). 9월 표층은 4월이나 6월과 같이 연안에서 바깥해역으로 갈수록 출현 종수가 감소하는 경향은 뚜렷하지 않고, 가운데와 남쪽라인에서 다소 많은 경향을 보였다. 그러나 북쪽 라인에서는 반대로 연안에서 바깥으로 진행함에 따라 출현 종수가 증가하였다(Fig. 3C, upper). 10m 수심은 바다목장 북쪽라인을 따라 시계방향 해역에서 상대적으로 많은 종이 출현하지만, 남쪽해역은 낮은 종수가 출현하였다(Fig. 3C, lower). 분류군에 따른 구성비는 편모조류 구성비가 매우 높아져, 표층과 10 m 수심 모두에서 식물성 편모조류와 규조류 구성비가 거의 같은 특성을 보였다(Fig. 3C). 11월 표층도 전체적으로는 연안 해역에 많은 종이 출현하고 있고, 바깥해역으로 갈수록 감소하지만, 북쪽의 바깥해역에서 비교적 많은 종이 출현하였다(Fig. 3D, upper). 10 m 수심도 전체적으로 연안해역에 많은 종이 출현하였고, 바깥해역에서 낮아지지만, 북쪽이 남쪽보다 많은 종수가 출현하였다(Fig. 3D, lower). 표층과 10 m 수심 모두에서 식물성 편모조류의 구성비는 20% 이하로 낮았다(Fig. 3D).
2008년 동해 바다목장 해역에 출현한 123종은 울진원자력 발전소 인근해역에서 1992~1996년에 출현한 364종(Kang and Choi[2001])에 비하면 매우 낮다. 동해에서 수행된 연구에서 식물플랑크톤 출현 종수는 95~409종(Lee and Shim[1990]; Park et al.[1991]; Choi et al.[2011])으로 연구자와 조사해역, 그리고 조사 횟수 등에 의해 큰 차이를 나타낸다. 이와 같은 결과를 나타내는 것은 동해는 동한난류 및 북한한류 등 난류와 한류가 혼재하여, 열 전선이 형성되며, 계절에 따라 전선의 위치가 크게 변화하는 특성을 나타낸다. 그리고 한류계 해수가 동해 남부해역에까지 확장되기도 하며, 한국남부 및 중국대륙의 양자강 희석수까지 영향을 받는 등(Lim and Chang[1969]; Nishimura[1983]), 다양한 수괴에 의한 복잡한 해황구조를 하고 있기 때문에 조사해역 및 시기에 따라 출현하는 생물종에 많은 차이를 보이기 때문이라 할 수 있을 것이다. 또한 연구자에 의해 군집해석에서 소수 출현종에 대한 분류기준을 달리하고 있기에 발생하고 있는 결과라고도 할 수 있다. 그리고 출현종의 계절변화에서 규조류는 연중 높은 출현 점유률을 보이지만 와편모조류 등 식물성 편모조류가 상대적으로 수온이 높은 고수온기에 다소 높은 출현률을 나타낸다. 이와 같은 결과는 우리나라 연안해역(Choi and Shim[1986]; Yoon et al.[1992]; Yoon[2011]; Shin[2013])과 중위도해역에서 쉽게 관찰되는 현상이라 할 수 있다(Castro and Huber[2010]). 그리고 고수온기 표층과 10 m 수심에서 와편모조류 출현 종수에서 차이를 보이는 것은 광량의 증가에 따른 일부 종이 광 저해(Shaw and Purdie[2001]; Gao et al.[2007], Villafae et al.[2008]; Gerla et al.[2011]) 및 낮과 밤을 통한 편모조류의 일주연직운동(Gerbersdorf and Schubert[2011]; Shulman et al.[2012]) 때문이라고 판단되었다. 그리고 연안부에서 출현 종수가 많고, 바깥해역으로 갈수록 출현 종수가 낮아지는 것은 영양염류 공급원이 육상에 있기 때문에 발생하는 것으로, 해역으로 유입되는 영양염류 공급이 매우 제한적인 것을 나타내는 것으로 판단되었다.
3.2 식물플랑크톤 현존량
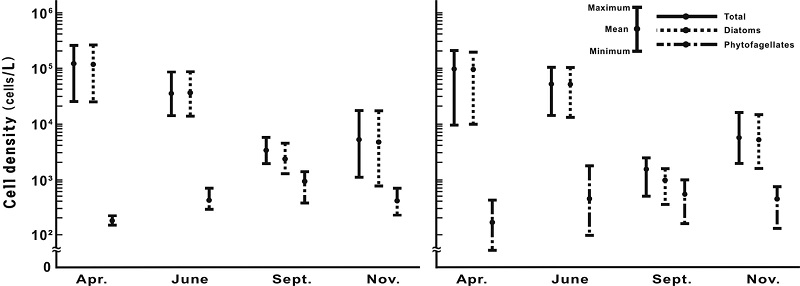
식물플랑크톤 현존량의 계절변동 양상은 수층에 관계없이 모두 4월에 높았고, 9월에 낮아 중위도의 개방해역에서 봄과 가을에 높은 현존량을 보이는 현상과(Castro and Huber[2010])과는 다른 결과를 나타내었다. 그리고 현존량은 연중 규조류에 의해 지배되는 경향을 나타내었다. 편모조류는 4월에서 9월까지 수온 상승에 따라 점차 세포밀도가 증가하고, 11월에 재차 감소하지만, 9월을 제외하고는 매우 낮은 현존량을 나타내었다(Fig. 4). 즉, 동해 바다목장 해역의 표층에서 최소값은 9월 1.8 × 103 cells·L-1에서 최댓값은 4월 2.4 × 105 cells·L-1의 범위에서 4회 평균 4.8 × 104 cells·L-1를 나타내었다. 시간적으로는 4월 표층에서 2.2 × 104 cells·L-1에서 2.4×105 cells·L-1의 범위로 10.9 ± 7.8 × 104 cells·L-1의 변동 폭을 보였고, 10 m 수심은 8.4 × 103 cells·L-1에서 1.9 × 105 cells·L-1의 범위에서 8.1 ± 6.3 × 104 cells·L-1로 변화하여, 표층이 10 m 수심보다 다소 높은 세포밀도를 나타내었다. 또한 4월 식물플랑크톤 현존량은 규조류가 표층과 10 m 모두에서 평균 99.8%로 매우 높은 점유률을 나타내었다(Fig. 4). 6월 표층은 1.3 × 104 cells·L-1에서 8.1 × 104 cells·L-1의 범위에서 3.3 ± 2.1 × 104 cells·L-1의 변동 폭을 보였고, 10 m 수심은 1.2 × 104 cells·L-1에서 8.8 × 104 cells·L-1의 범위에서 4.9 ± 2.7 × 104 cells·L-1로 변화하여, 표층보다 10 m 수심에서 높은 세포밀도를 나타내었다. 그리고 4월과 마찬가지로 규조류가 표층과 10 m 수심에서 각 평균 98.8%와 99.2%의 현존량 점유율로 매우 높게 나타났다(Fig. 4). 9월 표층은 1.8 × 103 cells·L-1에서 5.1 × 103 cells·L-1의 범위로 3.2 ± 1.0×103 cells·L-1의 변동 폭을 보였고, 10m 수심 0.4 × 103 cells·L-1에서 2.3 × 103 cells·L-1의 범위에서 1.4 ± 0.6 × 103 cells·L-1로 변동하여, 차이는 크지 않지만 표층에서 다소 높은 세포밀도를 보였다. 그러나 9월 세포밀도는 4월이나 6월보다 한 단위 낮은 농도였다. 식물플랑크톤 현존량에서 규조류가 차지하는 비율은 표층과 10 m 수심에서 각 평균 73.1%와 63.7%로 4월과 6월에 비하면 급격한 감소를 보였다. 즉 편모조류에 의한 점유율이 높아졌음을 의미한다(Fig. 4). 11월 표층은 1.0 × 103 cells·L-1에서 1.6 × 104 cells·L-1의 범위로 5.0 ± 4.6×103 cells·L-1의 변동 폭을 보였고, 10m 수심은 1.8 × 103 cells·L-1에서 1.5 × 104 cells·L-1의 범위에서 5.0 ± 4.0 × 103 cells·L-1로 변화하여, 수층 사이에 차이가 없는 연직 혼합된 특성을 보였다. 규조류에 의한 점유율은 표층과 10 m 수심에서 각 평균 91.9%와 92.5%로 9월에서 급격히 높아졌지만, 4월이나 6월보다는 낮았다(Fig. 4).
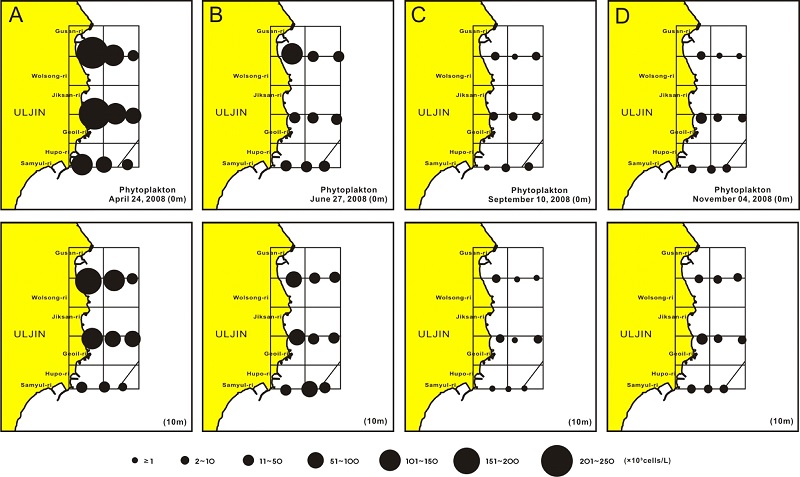
식물플랑크톤 현존량의 공간적 분포 특징은 4월 표층의 경우 출현종수와 같이 연안해역에서 세포밀도가 높고, 바깥해역으로 갈수록 세포밀도는 낮아졌다(Fig. 5A upper). 10 m 수심도 표층과 유사한 분포양상을 보이나, 출현 종수와는 반대로 10 m 수심보다 표층에서 연안에서 바깥해역으로 갈수록 다소 완만한 세포밀도의 감소가 보였다(Fig. 5A lower). 6월 표층은 북쪽라인의 연안과 중간 및 남쪽라인의 중앙 및 바깥해역에서 높고, 기타 해역에서 낮은 세포밀도를 보였다(Fig. 5B upper). 10 m 수심은 남쪽 후포리 연안을 제외하면 연안해역에서 시계반대 방향의 해역에 높은 세포밀도를 보이나, 북쪽 바깥해역에서 낮았다(Fig. 5B lower). 9월 표층은 일정한 규칙성 없이 남동해역에서 상대적으로 높은 세포밀도를 보였고, 북쪽 라인 연안을 제외한 연안해역에서 상대적으로 세포밀도가 낮았다(Fig. 5C upper). 10 m 수심도 표층과 유사하여 전체적으로 불규칙한 분포양상을 보이나, 연안해역과 바깥해역에서 상대적으로 세포밀도가 높았다. 그리고 30 m 등심선을 따라 선정된 가운데 남북 라인에서 상대적으로 세포밀도가 낮았다(Fig. 5C lower). 11월 표층은 중간라인의 연안에서 세포밀도가 상대적으로 높았고, 이를 중심으로 부채꼴 모양으로 점차 세포밀도가 낮아지는 양상을 보였다(Fig. 5D upper). 10 m 수심도 전체적으로 표층과 유사하지만, 남쪽해역보다 북쪽해역에서 상대적으로 세포밀도가 높았다(Fig. 5D lower).
분류군별로 규조류는 9월을 제외하면 전체 식물플랑크톤 현존량의 95%를 점유하고 있어, 위에서 살펴본 식물플랑크톤과 거의 동일한 분포를 나타낸다. 그러나 편모조류는 매우 낮은 출현 점유률로 특정 계절에 높게 출현하는 특징을 나타내었다. 4월 표층은 전체 해역에서 비교적 균일한 세포밀도를 보였다(Fig. 6A upper). 10 m 수심은 표층과는 다르게 일부 연안해역과 남북단면의 중간부 해역이 바깥해역보다 세포밀도가 상대적으로 높았다(Fig. 6A lower). 연안의 두 정점의 높은 세포밀도는 유글레나조인 Eutreptiella gymnastica가 패치 분포하는 결과였다. 6월 표층은 전체적으로 높은 세포밀도가 아니기에 균일한 분포처럼 보이지만, 세부적으로는 연안해역에서 다소 높고 바깥해역으로 갈수록 낮아진다(Fig. 6B upper). 10 m 수심은 표층보다 세포밀도는 낮고, 해역에 따른 분포 차이는 크게 나타나, 남쪽해역에서 높고, 북쪽으로 갈수록 세포밀도는 낮아졌다(Fig. 6B lower). 9월 표층은 중간해역에서 세포밀도가 높고, 북쪽과 남쪽라인의 연안 및 가장 바깥해역에서 세포밀도가 낮았다(Fig. 6C upper). 10 m 수심은 표층분포와는 달리 북쪽라인과 중앙부 해역을 제외한 중앙라인에서 세포밀도가 상대적으로 높았고, 남쪽해역에서 낮았다(Fig. 6C lower). 11월 표층은 전체적으로 뚜렷한 차이를 보이지는 않지만, 북쪽 연안과 중간, 그리고 남쪽의 바깥해역의 세포밀도가 상대적으로 높았다(Fig. 6D upper). 10 m 수심은 표층과는 달리 북쪽연안과 남쪽해역의 세포밀도가 상대적으로 높았다(Fig. 6D lower).
동해 바다목장에서 관찰되는 식물플랑크톤 세포밀도의 변동 범위인 1.8 × 103 cells·L-1에서 2.4 × 105 cells·L-1의 범위는 남해, 서해 및 제주연안에 비해서도 낮은 세포밀도이다(Yoon et al.[1992]; Yoon[2011], [2015]; Shin[2013]). 울진해역에서 기존 조사된 식물플랑크톤 세포밀도는 1992~1996까지 원전 인근해역에서 139.1~1,659 × 103 cells·L-1의 범위로 바다목장 해역보다, 최소, 최댓값 모두 한 단위 높은 값이다(Kang and Choi[2002]). 기존 동해해역에서 보고된 식물플랑크톤 현존량은 고리연안에서 35~30,401,000 cells·L-1의 범위(Choe[1972]; Shim et al.[1985])로 1960, 1970년대는 102~105 cells·L-1 수준(Choi[1969]); 1980년대 이후에는 104~106 cells·L-1 수준으로 변화하였다(Choi et al.[2011]). 2000년대 들어서도 큰 변화없이 103~106 cells·L-1의 세포밀도 범위를 보이고 있다(Kim et al. [2014]; this study; Yoon, unpublished data). 다만 동해의 식물플랑크톤 연구의 대부분은 고리원전 및 울진원전과 관련된 내용이 차지하고 있고, 연대별 최댓값은 울산항 등 산업단지 해역에서 기록되고 있어(Song[1980]; Shim et al.[1985]), 일반적인 해역 특성으로 보기는 다소 어렵다.
그리고 9월 낮은 식물플랑크톤 현존량은 동시에 측정된 동물플랑크톤 군집과 비교하면(MIFAFF[2009]; unpublished data), 동물플랑크톤의 포식압과 밀접한 관련성이 있는 것으로 판단되었고, 연안과 바깥해역의 현존량 차이는 종조성에서 설명한 영양염류의 공급원과 해역에 따른 불균형에서 오는 현상으로 판단되었다.
3.3 우점종
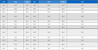
동해 울진 바다목장 해역의 식물플랑크톤 군집에서 우점종은 4월의 경우, 표층과 10 m 수심 모두에서 소형의 중심규조 Thalasiosira sp.가 60% 이상으로 극우점 하였다. 이외에 낮은 우점률로 표층에서 우상규조 Pseudo-nitzschia pungens와 중심규조 Rhizosilenia hebetata가, 10m 수심에서는 중심규조 Rh. hebetata와 Rh. setigera, 그리고 Pn. pungens가 우점하였다(Table 1). 6월은 중심규조 Leptocylindrus danicus, Guinardia striata가 표층에서 각 35.5%와 11.6%로, 10 m 수심도 각 36.2%와 11.8%로 최우점종 및 차우점종으로 출현하였고, 기타 Pn. pungens가 우점하였다(Table 1). 9월은 낮은 세포밀도에 높은 우점율로 출현하는 종은 없었지만, 중심규조 Chaetoceros curvisetus가 표층에서 18.1%, 10 m 수심에서 9.7%의 우점율로 최우점하였고, 기타 Ch. decipience가 우점하였다(Table 1). 그리고 11월은 미세구조에 의해 구분되는 Skeletonema속의 복합종(Smyda[2011]; Yamada[2013]; Yoon[2015])으로 보고 있는 중심규조 Skeletonema costatum-ls에 의해 표층과 10 m 수심에서 각 34.0%와 27.8%로 최우점 하였고, Pn pungens가 각 21.3%와 22.6%의 우점율을, 우상규조인 Thalassionema nitzschioides가 각 10.7%와 11.1%로 우점 출현하였다. 기타 Ch. debilis, Pn. delicatissima, 유글레나조 Eutreptiella gymnastica가 낮은 우점율을 보였다(Table 1).
동해 바다목장 해역에 우점 출현하는 종에서 Pseudo-nitzschia pungens 및 유글레나조인 Eutreptiella gymnastica를 제외하면 대부분 기존의 연구결과에서도 동해 연안해역에서 우점종으로 출현하는 종이다(Kang and Choi[2003]; Choi et al.[2011]). 이 중 Pn. pungens 대신 Pn. seriata 또는 Pseudo-nitzschia spp.가 우점되는 것으로, 그리고 기존 여름과 가을에 우점 출현하는 와편모조 Neoceratium furca, Prorocentrum triestium, Cocholodinium polykrikoides 및 규질편모조 Dictyocha speculum, Octactis octonaria 등의 편모조류는 우점 출현하지 않았다(Choi et al.[2011]; Kim et al.[2014]). 다만 Pn. pungens, Pn. seriata, Pseudo-nitzschia. spp. 등은 광학현미경을 사용한 분류학적 문제에서 발생하는 내용으로 판단할 수도 있다.
3.4 생태지수
동해 울진 바다목장 해역의 식물플랑크톤 군집을 구성하는 종과 각 종의 현존량을 이용하여 계산한 4개의 생태지수 중 다양도 지수는 연평균 2.036으로 0.833(4월)~3.031(9월)로 변화하여 출현종이 가장 낮고, 세포밀도가 높았던 4월에 낮고, 출현종이 가장 높고, 세포밀도가 낮았던 9월 높은 경향을 보였다. 우점도 지수는 연평균 0.589로 0.159(9월)~0.864(4월)로 변화하여 종 다양도 지수와는 정반대의 변동을 나타내었다. 즉, 특정종의 우점율이 높은 4월과 9월 높은 값을 보였다. 풍부도 및 균등도 지수는 각 연평균 3.004로서 4월 1.463에서 9월 4.794 및 연평균 0.611로 4월 0.262에서 9월 0.839로 변화하여 종 다양도 지수와 유사한 변동 양상을 나타내었다(Table 2).
그리고 종 다양도 및 우점도 지수의 계절변화를 살펴보면, 종 다양도 지수는 4월에서 9월까지 상승하다 9월 이후 감소하는 식물성 편모조류 현존량 변동과 유사하였다. 우점도 지수는 다양도 지수와 반대 경향으로 4월과 11월 특정종에 의해 극우점하는 시기에 높고, 특정 종에 의한 우점현상이 약한 시기에 낮은 변동 양상을 나타내었다(Fig. 7).
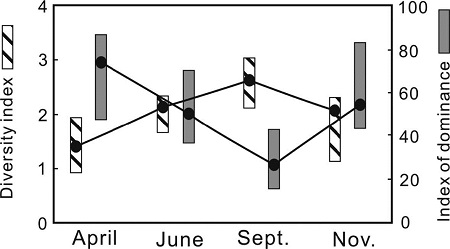
Temporal variation of diversity and dominance index of phytoplnkton community at surface in the UMRA.
생태지수에 의한 군집해석에서는 식물플랑크톤을 구성하는 모든 종에 대한 동정과 정확한 현존량 등 전체적인 정성, 정량분석이 이루어졌다는 조건에서 시작된다. 때문에 국내에서 일부 연구논문 등에 생태지수가 병기되고는 있지만, 이들 지수에 의한 군집구조 해석은 거의 이루어지고 있지 못한 실정이다. 그러나 동해는 개방된 해역특성으로 다양한 생물종에 의한 군집구조가 이루어지는 것으로 판단되지만, 일부 남해의 개방해역이나 제주연안에서 분석한 결과보다 종 다양성 지수나 풍부도 지수, 균등도 지수에서 낮은 값을 나타낸다(Yoon, unpublished data).
3.5 집괴분석에 의한 해역구분
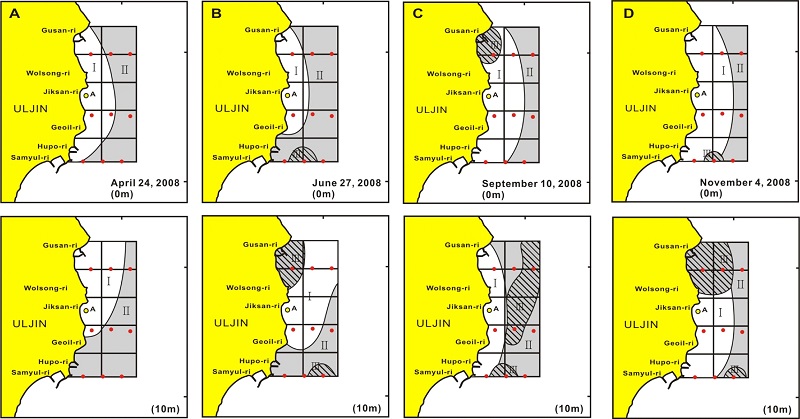
동해 바다목장 해역의 식물플랑크톤 군집에 의한 집괴분석 결과는 표층은 모든 조사시점 및 수층에서 유사도 70~80%에서 연안과 바깥해역으로 양분되었고, 바깥해역은 다시 낮은 유사도에서 2개의 해역으로 구분되었다(Fig. 8). 결과 4월 표층은 등심선 30 m를 전후로 안쪽과 바깥해역으로 구분되었다. 그러나 10m는 표층과 같이 안쪽과 바깥해역으로 양분되지만, 남쪽해역의 연안은 바깥해역과 유사한 환경특성을 가지는 것으로 나타났다(Fig. 8A). 6월 표층은 크게는 4월 10m와 유사하지만, 남쪽라인의 중앙점점은 바깥해역과 다소 다른 환경특성을 나타내었다. 10 m는 표층과 달리 연안정점 특성이 북쪽에서는 바깥해역까지 확대되는 반면, 남쪽해역은 연안까지 바깥해역의 특성을 보여 동서의 구획보다 사선에 의한 북서와 남동해역으로 구분되는 특성을 보였다. 그리고 북쪽 구산리 연안은 다른 해역과는 다른 환경특성을 보였다(Fig. 8B). 9월 표층도 크게는 연안 및 바깥해역으로 구분되지만 북쪽의 연안점점은 다소 다른 특성으로 구분되었다. 10 m도 연안과 바깥해역으로 구분되는 것은 표층과 같지만, 바깥정점은 다시 북쪽과 남쪽으로 다른 환경특성을 나타내는 등 다소 복잡한 양상을 보였다(Fig. 8C). 11월 표층도 연안과 바깥해역으로 구분되지만, 남쪽라인의 중앙정점은 다소 특성을 달리하였다. 10 m도 기본은 다른 계절과 같지만, 북쪽의 연안과 남쪽의 중앙정점은 환경특성을 달리하였다(Fig. 8D).
식물플랑크톤 군집에 의한 해역구분에서 연안과 바깥해역으로 크게 구분되는 것은 수심 20 m의 등심선을 따라 남북방향으로 해안선과 평행하게 흐르는 해류성분이 연안을 따라 흐르는 조석성분보다 강하여(MIFAFF[2009], unpublished data), 연안에서 유입되는 영양염류 농도 등에 영향을 받고 있기 때문으로 판단되었다. 즉 동해 바다목장의 식물플랑크톤은 해수유동 및 영양염류 공급에 의해 식물플랑크톤 군집이 지배되고 있다. 특히 연안선과 평행한 등심선 30m에서 70m의 표층퇴적층에 매우 높은 농도의 유기물 집적이 되어, 계절적으로 무기화에 의한 영양염류 용출이 있지만(MIFAFF[2009], unpublished data), 표층으로 공급되는 부분이 매우 제한적이기에 식물플랑크톤 재생산에 이용되는 부분은 많지 않은 것으로 추정되었다.
동해시범바다 목장은 개방된 해역특성으로 비교적 균일한 해양환경 특성을 나타낼 것으로 추정되지만, 조사결과는 매우 작은 해역범위에서 생물해양학적으로 다른 특성을 나타내는 해역으로 구분되고 있음을 알 수 있었다. 이와 같은 결과는 표층퇴적물의 유기물 집적이 육지와 인접하는 연안의 사질퇴적물에는 매우 낮지만, 20 m 등심선을 보이는 해역의 펄 퇴적물에는 매우 고농도로 집적되고 있다는 점 등(MIFAFF[2009], unpublished data)과 함께, 동해 시범바다목장의 운영 및 관리에 매우 중요한 환경인자라고 판단되었다. 때문에 동해 바다목장의 효율적 운영과 관리는 지속적인 해양환경과 기초생물 변화의 모니터링를 토대로 하는 과학적이면서 합리적으로 이루어져야만 할 것이라고 판단되었다.
Acknowledgments
이 논문은 2013년도 정부(교육과학기술부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업(No. 2013005394) 결과이다.
References
- Castro, P., and Huber, M.E., (2010), Marine Biology, (8th eds), McGraw Hill Comp, NY, 461.
- Chihara, M., and Murano, M.. (eds), (1997), An Illustrated Guide to Marine Plankton in Japan, Tokai Univ. Press, Tokyo, 1571.
- Choe, S., (1969), “Phytoplankton studies In Korean Waters III. Surface phytoplankton survey of the north-eastern Korea Strait in May of 1967”, J. Oceanol. Soc. Korea, 4, p1-8.
- Choe, S., (1972), “Studies on the seasonal variatons of phytoplankton organisms and suspended particuleta matter in the coastal area of Ko-Ri”, J. Oceanol. Soc. Korea, 7, p47-58.
-
Choi, C.G., Kwak, S.N., and Sohn, C.H., (2006), “Community structure of subtitdal marine algae at Uljin on the East Coast of Korea”, Algae, 21, p463-470.
[https://doi.org/10.4490/ALGAE.2006.21.4.463]

- Choi, J.K., Kang, Y.S., Noh, J.H., and Shim, J.H., (2011), “The characteristics of phytoplankton distribution in the East Sea of Korea”, In Choi, J.K. (ed.), The Plankton Ecology of Korean Coastal Waters, Donghwa Tech. Pub, Seoul, p48-67.
- Choi, J.K., and Shim, J.H., (1986), “The ecological study of phytoplankton in Kyeonggi Bay, Yellow Sea. III. Phytoplankton composition, standing crops, tychopelagic plankton”, J. Oceanol, Soc. Korea, 21, p156-170.
- Cupp, E.E., (1943), Marine plankton diatoms of the west coast of north America, Bull. Scripps Inst. Oceanogr., Univ, Calif, 5, p1-237.
- Dodge, J.D., (1982), Marine dinoflagellates of the British Isles, Her Majesty’s Office, London, 303.
-
Gao, K., Li, G., Helbling, E.W., and Villafan, V.E., (2007), “Variability of UVR effects on photosynthesis of summer phytoplankton assemblages from a tropical coastal area of the South China Sea”, Photochem. Photobiol, 83, p802-809.
[https://doi.org/10.1111/j.1751-1097.2007.00154.x]

-
Gerbersdorf, S.U., and Schubert, H., (2011), “Vertical migration of phytoplankton in coastal waters with different UVR transparency”, Environmental Sciences Europe, 23, 36(14), http://www.enveurope.com/content/23/1/36.
[https://doi.org/10.1186/2190-4715-23-36]

-
Gerla, D.J., Mooij, W.M., and Huisman, J., (2011), “Photoinhibition and the assembly of light-limited phytoplankton communities”, Oikos, 120, p359-368.
[https://doi.org/10.1111/j.1600-0706.2010.18573.x]

-
Hwang, I.J., Lee, J.B., Choi, S.J., Kim, S.K., Cha, H., Oh, T.Y., and Baek, H.J., (2012), “Reproductive Capacity in Starry Flounder Platichthys stellatus from Uljin Marine Ranching Area, Korea”, Korean J. Fish. Aquat. Sci, 45, p253-261.
[https://doi.org/10.5657/KFAS.2012.0253]

-
Hwang, K., Seo, I.-S., Choi, B.-M., Lee, H.N., Oh, C.W., Kim, M.H., Choi, C.G., and Na, J.H., (2012), “Community structure of macrobenthic assemblages near Uljin Marine Ranching Area, East Sea of Korea”, Korean J. Environ. Biol, 32, p286-296.
[https://doi.org/10.11626/KJEB.2014.32.4.286]

- Kang, Y.S., and Choi, J.K., (2001), “Ecological characteristics of phytoplankton communities in the coastal waters of Gori. Wulseong, Uljin and Youngkwang I. Species composition and distribution (1992-1996)”, Algae, 16, p85-111.
- Kang, Y.S., and Choi, J.K., (2002), “Ecological characteristics of phytoplankton communities in the coastal waters of Gori. Wulseong, Uljin and Youngkwang II. Distributions of standing crops and environmental variables (1992-1996)”, 「 The Sea」J. Korean Soc. Oceanogr, 7, p108-128.
-
Kang, Y.S., Choi, J.K., and Eum, H.M., (2003), “Ecologocal characteristics of phytoplankton communities in the coastal waters of Gori, Wolseong, Uljin and Younggwang III. Distribution of dominant species and environmental variables”, Algae, 18, p29-47.
[https://doi.org/10.4490/ALGAE.2003.18.1.029]

-
Kim, A-R., Youn, S.-H., Chung, M.H., Yoon, S.-C., and Moon, C.-H., (2014), “The influences of coastal upwelling on phytoplankton community in the southern part of East Sea, Korea”, 「 The Sea」 J. Korean Soc. Oceanogr, 19, p287-301.
[https://doi.org/10.7850/jkso.2014.19.4.287]

- Kirk, T.O., (2011), Light and photosynthesis in aquatic ecosystems, (3rd eds), Cambridge Univ. Press, 662.
- Lee, W.H., and Shim, J.H., (1990), “Distributions of phytoplankton standing crop and the associates T-S properties in the southwestern East Sea(Sea of Japan)”, J. Oceanol. Soc. Korea, 25, p1-7.
- Lim, D.B., and Chang, S., (1969), “On the cold water mass in the Korea Strait”, J. Oceanol. Soc. Korea, 4, p72-82.
- Margalef, R., (1958), Information theory in ecology, Gen. Syst, 3, p157-175.
-
McNaughton, S.J., (1968), “Structure and function in California grassland”, Ecology, 49, p962-972.
[https://doi.org/10.2307/1936547]

- MIFAFF (Ministry for Food, Agriculture, Forestry and Fisheries), (2009), Studies on the Development of Marine Ranching Program 2008 in the East, West and Jeju Coast of Korea, No. of Government Publication: 11-1541000-000260-10, 1019, (unpublished data).
- Nishimura, S., (1983), Okhotsk Sea, Japan Sea, East China Sea, In Ketchum, B.H. (ed.), Ecosystem of the world, V. 26 Estuaries and Enclosed Seas, Elsevier, New York, p305-401.
- Park, J.S., Kang, C.K., and An, K.H., (1991), “Community structure and spatial distribution of phytoplankton in the polar front region off the East Coast of Korea in summer”, Bull. Korean Fish. Soc, 24, p237-247.
-
Severiano, J., Moura, A., Magalhaes, E., and Almeida, V., (2012), “Study about top-down and bottom-up controls in regulating the phytoplankton biomass in a eutrophic reservoir in northeastern Brazil”, J. Water Res. Prot, 4, p616-621.
[https://doi.org/10.4236/jwarp.2012.48071]

- Shannon, C.E., and Weaver, W., (1963), The mathematical theory of communication, University of Illinois Press, Urbana, p117-125.
-
Shaw, P.J., and Purdie, D.A., (2001), “Phytoplankton photosynthesis- irradiance parameters in the near-shore UK coastal waters of the North Sea: temporal variation and environmental control”, Mar. Ecol, Prog. Ser, 216, p83-94.
[https://doi.org/10.3354/meps216083]

- Shim, J.H., Lee, W.H., and Park, S.Y., (1985), “Studies on the plankton in the southwestern waters of the east Sea (Sea of Japan)”, J. Oceanol. Soc. Korea, 20, p37-54.
-
Shin, Y.K., (2013), “A ecological study of phytoplankton community in the Geum river estuary”, KJEE, 46, p524-540, (2013).
[https://doi.org/10.11614/KSL.2013.46.4.524]

- Shulman, I., Penta, B., Moline, M.A., Had-dock, S.H.D., Anderson, S., Oliver, M.J., and Sakalaukus, P., (2012), “Can vertical migrations of dinoflagellates explain observed biolumi-nescence patterns during an upwelling event in Monterey Bay, California?”, J. Geophys. Res.: Oceans (1978–2012), 117(C1), (2012).
-
Smayda, T.J., (2011), “Cryptic planktonic diatom challenges phytoplankton ecologists”, Proc. Nat’l Acad. Sci. USA, 108, p4269-4270.
[https://doi.org/10.1073/pnas.1100997108]

- Song, J.S., (1980), “Annual changes in abundance and composition of phytoplakton in Ulsan Bay”, Bull. Fish. Res. Dev. Agency, 23, p159-169.
- Street, H., and Paytan, A., (2005), “Iron, phytoplankton growth, and the carbon cycle”, Met Ions Biol Syst, 43, p153-193.
- Tomas, C.R. (ed.), (1997), Identifying Marine Diatoms and Dinoflagellates, Academic Press, Oxford, 858.
-
Villafae, V.E., Janknegt, P.J., de Graaff, M., Visser, R.J.W., van de Pol, W.H.l., Buma, A.G.J., and Helbling, E.W., (2008), “UVRinduced photoinhibition of summer marine phytoplankton communities from Patagonia”, Mar. Biol, 154, p1021-1029.
[https://doi.org/10.1007/s00227-008-0993-0]

- Yamada, M., (2013), “Recent studies on biodiversity and eco-physiological characteristics of the genus Skeletonema (Bacillariophyceae)”, Bull. Plankton Soc. Japan, 60, p18-28.
-
Yoon, B.S., Park, J.-H., Sohn, M.H., Yang, J.H., Yoon, S.C., and Choi, Y.M., Choi, (2013), “Community Structure and Distribution Pattern of the Pleuronectiform Fishes in the Uljin Marine Ranching Area, Korea”, Korean J. Fish. Aquat. Sci, 46, p413-423.
[https://doi.org/10.5657/KFAS.2013.0413]

- Yoon, Y.H., (2011), “Marine environment and phytoplankton community in the southwester sea of Korea”, In Choi, J.K. (ed.), The Plankton Ecology of Korean Coastal Waters, Donghwa Tech. Publ. Co, Seoul, p68-93.
- Yoon, Y.H., Rho, H.G., and Kim, Y.K., (1992), “Seasonal succession of phytoplankton population in the Hamdok port, Northern Cheju Island”, Bull. Mar. Sci. Inst., Cheju Nat`l Univ, 16, p27-42.
-
Yoon, Y.H., (2015), “Spatio-temporal distributions of phytoplankton community in the coastal waters of Gogunsan Islands (CoWGIs), West Sea of Korea”, J. Korea Acad.-Ind. Cooper. Soc, 16, p2287-2300.
[https://doi.org/10.5762/KAIS.2015.16.3.2287]