The Study on the Marine Eco-toxicity and Ecological Risk of Treated Discharge Water from Ballast Water Management System Using Electrolysis
The International Convention for the Control and Management of Ship's Ballast Water and Sediments was adopted at 2004 and then various BWMS (ballast water management system) have been developed. In this study, WET (whole effluent toxicity) test with algae (diatom) Skeletonema costatum as primary producer, invertebrate (rotifera) Brachionus plicatilis as 1st consumer and fish (olive flounder) Paralichthys olivaceus as predator, chemical analysis and ERA (environmental risk assessment) were conducted to assess the unacceptable effect on marine ecosystem by emitting the discharge water treated with AquaStar™ BWMS using electrolysis as main treatment equipment for removing the marine organisms in the ship’s ballast water. The most sensitive test organism on discharge water treated with AquaStar™ BWMS was S. costatum that gave the NOEC value of 25.00%, LOEC value of 50.00% and 72hr-EC50 value of 69.97% from WET test result for 20 psu salinity treated discharge water. NOEC and LOEC value of B. plicatilis and P. olivaceus exposed at 20 psu salinity treated discharge water were 50.00% and 100.00%, respectively. In the chemical analysis results, total number of substances produced by AquaStar™ BWMS was 18 which were bromate, 7 volatile halogenated organic compounds, 7 halogenated acetic acids, 3 halogenated acetonitriles and chloropicrin. Eighteen substances did not consider as persistence and bioaccumulative chemicals. Uncertainty of toxic property of 18 substances was high. PECs of 18 substances calculated by MAMPEC model were ranged from 4.58×10-4 to 4.87 μg L-1, PNECs of them were ranged from 1.6×10-2 to 3.2×102 μg L-1. And, the PEC/PNEC ratio of 18 substances did not exceed 1. Therefore, ERA for produced substances indicate that the discharge water treated with AquaStar™ BWMS does not pose unacceptable effect on marine life. And EC50 value of S. costatum on discharge water treated by BWMS using the electrolysis had positive correlation with initial TRO concentration, concentration and kind & level of HAAs.
초록
외래종의 유입을 막기 위해 ‘선박평형수와 침전물의 제어와 관리를 위한 국제협약’이 2004년에 체결되었고 이에 따라 다양한 선박평형수 관리장치가 개발되고 있다. 본 연구에서는 전기분해를 이용하여 선박평형수 내 해양생물 제거를 위한 장치로 개발된 AquaStar™ BWMS가 해양생태계에 미치는 영향을 파악하기 위하여 1차 생산자로서 규조류 Skeletonema costatum, 1차 소비자로서 윤충류 Brachionus plicatilis 및 포식자로서 어류(넙치) Paralichtys olivaceus를 이용하여 AquaStar™ BWMS의 배출수독성시험과 생성된 화학물질에 대한 환경위해성 평가를 수행하였다. 배출수독성시험결과 가장 민감한 생물은 S. costatum이었고 염분 20 psu 배출수에 노출되었을 때 NOEC 25.00%, LOEC 50.00% 및 72hr-EC50이 69.97%였다. B. plicatilis와 P. olivaceus는 염분 20 psu 배출수에 노출되었을 때 NOEC 및 LOEC가 각각 50.00 및 100.00%였다. AquaStar™ BWMS에서 생성된 물질은 총 18개로, bromate, 7개의 volatile halogenated organic compounds, 7개의 halogenated acetic acids, 3개의 halogenated acetonitriles 및 chloropicrin이었다. 생성된 물질들의 지속성과 생물축적성을 보이는 화학물질은 없었으나, 물질의 생태독성을 평가하기에는 불확실성이 높았다. 그러나 MAMPEC 모델을 이용하여 생성된 18개 물질의 PEC는 4.58×10-4~4.87 μg L-1였고, PNEC는 0.016~320.00 μg L-1였으며, 18개 화확물질의 PEC/PNEC 비율은 1을 초과하지 않았다. 따라서 환경위해성평가결과는 AquaStar™ BWMS에 의하여 처리된 해수가 해양생태계에 수용 불가한 영향을 미치지 않는 것으로 나타났다. 또한 전기분해를 이용하는 BWMS의 배출수에 대한 S. costatum의 EC50은 초기 TRO농도, HAAs의 농도 및 종류수와 양의 상관관계가 있었다.
Keywords:
Ballast Water Management System, Electrolysis, Whole Effluent Toxicity test, Environmental risk assessment, 선박평형수관리장치, 전기분해, 배출수독성시험, 위해성평가1. 서 론
국가 간의 무역 및 교역 활동의 상당부분이 해상운송에 의해 이루어지면서, 선박에 의하여 국가 간 또는 지역 간으로 이동되는 선박평형수의 전 세계 연간 배출량은 약 190억 톤이며, 국내 주요항만에서 선박평형수의 배출량은 약 2천백만 톤으로 추정되고 있다 (Kim[2005], Choi et al.[2009]). 해양에서 외래종 유입의 주요 경로가 이 선박평형수임이 밝혀지고, 수중생물(특히, 해양의 미생물이나 플랑크톤류)이 선박평형수를 통하여 다른 나라의 해역으로 옮겨져서 생태계와 인간 건강을 위협한다는 사실이 알려지면서, 선박평형수를 규제하기 위한 움직임이 미국 등 선진국에서부터 시작되었다(Kim[2005]). 마침내 선박평형수에 의한 외래종 유입을 막기 위해 국제해사기구는 2004년에 ‘선박평형수와 침전물의 제어와 관리를 위한 국제협약(선박평형수관리 협약)’을 채택하였다(Kim[2005]). 이 국제협약은 배출요건을 규정함으로써 단계적으로 무역선박에 평형수관리장치(BWMS: Ballast Water Management Systems)의 탑재를 의무화하는 것이다(Kim[2005]). 선박평형수관리협약은 평형수의 배출요건을 D-2규정에 제시하면서 이에 부합하는 BWMS의 생물 사멸 능력과 각종 가동성능 그리고 선박적용을 확인하는 형식승인을 각 국가의 정부로부터 받도록 규정하였다. 이와 동시에 활성물질을 사용하는 장비에 대하여 활성물질이 2차 오염 등 환경에 미치는 영향을 확인하는 승인절차(G9)를 제시하여 MEPC(marine environment protection committee, 해양환경보호위원회)에서 사용승인을 받도록 하였다(Kim et al.[2012]).
선박평형수관리 협약이 채택된 후 개발된 BWMS는 2012년 6월까지 총 42개의 BWMS가 IMO로부터 기본승인을 받았으며, 28개의 BWMS가 최종승인을 받았다(IMO[2010b], MEPC[2011d], [2011e~h], [2012a~d]). 국가별로는 한국이 가장 많이 개발하여 승인을 취득하였고, 그 뒤를 독일과 일본이 잇고 있다(Kim et al.[2012]). 그 중 주요 처리장치로서 전기분해장치를 사용하는 BWMS가 총 19개로 BWMS 개발에 가장 많이 활용되고 있었다. 국내에서도 전기분해장치를 이용하여 BWMS를 개발하고 있거나 개발을 한 다수의 기업들이 있으며, 그 중 아쿠아이엔지(주)는 Smart Pipe, 전기분해장치 및 중화장치를 주요 처리장치로 하는 AquaStar™ BWMS를 개발하였다.
AquaStar™ BWMS는 해수 중의 염화나트륨(NaCl)을 전해질로 하여 활성물질인 차아염소산나트륨(sodium hypochlorite, NaOCl)과 차아염소산(hypochlorous acid, HOCl)을 생성시켜 해수 내 세균 및 플랑크톤을 사멸시키기 위해 고안된 장비이다(MEPC[2011a]). NaOCl과 HOCl의 생성은 해수의 전기분해 시 양극에서 염소(chlorine, Cl2)가 생성되고, 음극에서 수산화나트륨(sodium hydroxide, NaOH)이 생성된다. NaOH와 Cl2의 반응에 의하여 NaOCl이 생성되고 이와 동시에 Cl2는 물과 반응하여 HOCl을 생성하게 된다. HOCl은 주로 pH가 증가함 따라 수소이온(hydrogen ion, H+)과 차아염소산이온(gypochlorite, OCl-)으로 분리되고, pH가 감소하면 다시 결합하여 HOCl이 된다. 해수 중에는 약 60~70 mg/L의 브롬(bromine, Br)이 이온의 형태(bromide, Br-)로 존재하는데(Lee and Yang[1998]), 알칼리 조건에서 Br-는 HOCl에 의하여 차아브롬산(hypobromous acid, HOBr)로 산화되며, OCl-의 형성과 유사한 반응으로 차아브롬산 이온(hypobromite, OBr-)이 생성된다. 전기분해 장치에서 생성된 NaOCl, HOCl, OCl-, HOBr과 OBr-등은 활성물질로서 수중의 유기물 분해, 암모니아성 질소 제거와 살균 및 생물 제거에 탁월한 효과를 가지고 있다(Lee et al.[1997], Park et al.[1998], Yoon, et al.[2005], Kim and Gil[2007], Park and Kim [2011]).
일반적으로 전기분해를 이용하는 BWMS는 배출수에 상기 언급한 활성물질들이 잔류할 수 있고, 또한 전기분해 시 또는 전해수로 처리 후 부산물로 생성될 수 있는 bromate, volatile halogenated organic compounds, halogenated acetonitrils (HANs), halogenated acetic acids (HAAs), chlorinated phenol, brominated phenol과 adsorbable organic halogens 등이 배출수에 잔류할 수 있다. 이로 인하여 전기분해를 이용하는 BWMS의 배출수에 포함된 활성물질과 부산물들이 해양생태계에 부정적인 영향을 초래할 수 있다. 따라서 배출수의 잔류독성 및 위해성에 대한 평가는 반드시 필요한 부분이다.
본 연구에서는 전기분해장치를 사용하는 AquaStar™ BWMS에 의해 처리된 해수가 해양생물에게 수용불가한 부정적인 영향을 평가하고자 하였다. 이를 위하여 AquaStar™ BWMS로 처리된 배출수에 대한 WET(whole effluents toxicity) test를 수행하였고, 생성된 화학물질에 대한 특성 및 생성 가능한 기작을 고찰하였다. 또한 생성된 화학물질의 PBT(지속성(persistence), 생물축적성(bioacculumation) 및 생태독성(toxicity)) 특성과 유해지수인 PEC(predicted environmental concentration, 예상환경농도)/PNEC (predicted no effect concentration, 예상무영향농도)를 이용한 환경위해성평가(ERA, environmental risk assessment)방법을 이용하여 AquaStar™ BWMS의 처리된 배출수에 대한 위해성을 구명하고자 하였다.
2. 재료 및 방법
2.1 BWMS 배출수의 채집
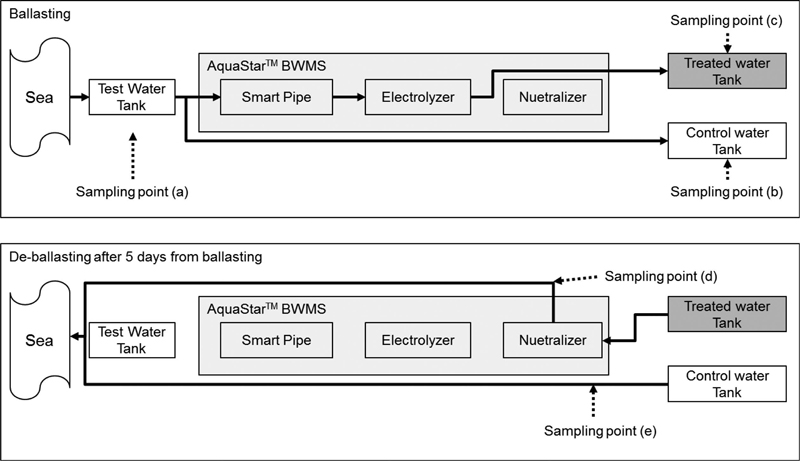
AquaStar™ BWMS의 처리장치는 Smart Pipe, Electrolyzer와 중화장치의 순서로 배치되었다. 시험원수 탱크로부터 BWMS를 통과시켜 생물을 제거한 해수는 처리수 탱크에 보관하고, BWMS를 우회시킨 해수는 대조구 탱크에 보관 하여 5일간 거치시켰다. 5일 후 대조구와 처리수 탱크의 해수를 중화한 후 배출하였다(Fig. 1). 배출수독성실험을 위한 시료는 5일 후 대조구와 처리수의 탱크에서 배출 시 각각 400 L와 600 L를 채수하여 실험에 이용하였다(Fig. 1의 sampling point (d)와 (e)). BWMS에 의한 물질생성 확인을 위한 화학분석은 BWMS의 성능검증시험 당일(Fig. 1. 1의 sampling point (a)~(c))과 5일 후(Fig. 1. 1의 sampling point (d)와(e))에 시험원수, 대조구 및 처리수를 1 L씩 채수하였다. 시료내 화학물질 성상의 변화를 막기 위하여 분석 항목 별 보존시약을 주입 후 즉시 아이스박스에 넣어 실험실로 운반하였다. 세부적인 채집 후 보존 시약의 주입방법은 ‘2.3 화학분석’에 제시하였다.
2.2 BWMS의 배출수에 대한 WET test
채집된 시료는 냉장차를 이용하여 실험실로 운반하였고, 3 μm CP filter(Chisso Filter, Japan)로 여과한 후 배출수를 희석(대조구 이용)하여 배출수 100%, 50%, 25%, 12.5%, 6.25% 및 0%(대조구)의 농도로 시험수를 제조하였으며, 각 농도구는 150 L 씩 제조하여 하루 동안 시험온도에 순치 시킨 후 각 시험에 사용하였다. Skeletonema costatum과 Brachionus plicatilis의 실험은 0.45 μm membrane filter로 시험수를 여과한 후 사용하였다.
규조류, 윤충류 및 어류의 시험조건(수온, 광량 및 광주기)은 각 시험생물을 이용한 시험방법에서 제시하거나 문헌에서 제시한 생존 및 성장에 가장 유리한 조건으로 설정하였다.
배출수가 S. costatum의 개체군 성장에 미치는 영향을 알아보기 위해 ISO에서 제시한 방법에 따라 수행하였고(ISO 10253[2006]), 72시간과 96시간동안 개체군의 성장을 관찰하였다. S. costatum 원종의 배양조건은 f/2배지, 온도 22±1 ℃로 설정하였고, 지속적인 개체군의 성장을 유도하기 위해 3,000 lux의 연속조명으로 하였다. 시험에 사용된 S. costatum의 배양주는 시험시작 3일 전 접종하여 배양한 후 사용하였고, 염분 20 psu 배출수의 시험은 2주간 순치한 후 시험에 사용하였다. 15 mL test tube에 f/2배지를 첨가한 시험수를 10 mL 분주한 후 초기 밀도 3,000 cells mL-1가 되도록 접종하였고 3개의 반복구를 두었다. 배양은 원종의 배양조건과 동일하게 하였다. 세포밀도의 정량분석을 위해 매 24시간 마다 대조구와 시험구에서 각각 2 mL와 1 mL씩 분취하였고, 분취 시료의 1 mL는 Chlorophyll-a의 농도를 측정하기 위해 90% 아세톤으로 추출하여 형광분석기(Turner Designs Model 10 AU, USA)로 파장 460 nm(excitation filter)와 683 nm(emission filter) 에서 흡광도를 측정하였고, 나머지 대조구의 1 mL 분취 시료는 세포밀도 측정을 위해 Sedgwick-Rafter chamber를 이용하여 도립현미경(CKX 31, Olympus) 하에서 계수하였다. 대조구에서 chlorophyll-a의 농도와 세포밀도 사이의 회귀방정식을 구한 다음 측정된 각 시험구의 chlorophyll-a의 농도로 세포밀도를 환산하였다. S. costatum의 성장률(growth rate, r)은 r = (lnNt - lnN0) / t (r = S. costatum의 성장률, Nt = t 시간 후의 세포밀도, N0 = 시험 초기의 세포밀도, t = 배양시간)의 식에 의하여 산출하였다. 대조구내 pH의 변화는 시험시작 전과 시험종료 직후에 pH meter (Orion Research, INC. Model 230A+, USA)를 이용하여 측정하였다.
시험의 유효성 판단은 대조구의 성장률이 0.92 day-1 이상, 대조구 성장률의 변동계수(coefficient variation)값이 7%이내, pH 변화가 1.0이내이며, 시험결과는 유효성을 만족하였다.
배출수가 B. plicatilis의 생존 및 개체군 성장에 미치는 영향을 알아보기 위해 ASTM[2004]과 Janssen et al.[1994]에서 제시한 방법에 따라 수행하였고, 24시간 생존율(급성독성)과 4일간 개체군 성장률(만성독성)을 관찰하였다. B. plicatilis는 cyst(MicroBioTests Inc., Belgium)를 염분농도 20 psu, 수온 25±1 ℃, 1,000~3,000 lux의 조도로 연속 조명하여 24시간 동안 부화시켰고, 부화 후 2시간 이내의 부화유생(neonate)을 시험에 사용하였다. 각 시험농도별 배출수를 0.45 μm membrane filter로 여과한 후 48 well plate에 1 mL씩 분취하여 부화유생을 1개 culture well에 5개체씩 접종하였고, 12개의 반복구를 두었으며, 25±1 ℃의 암조건에서 배양하였다. 부화유생의 생존율 및 개체군 성장률을 산출하기 위해 생존한 부화유생의 수를 입체현미경(SZ51, Olympus)하에서 계수하였다. 사망개체의 판단은 실험용기를 살며시 흔들어 5초간 유영하지 않는 개체 중 바늘로 살며시 자극을 주었을 때 반응이 없는 개체를 사망한 개체로 판단하였다. B. plicatilis의 성장률(growth rate, rm)은 rm = (lnN4 - lnN0) / 4 (rm= B. plicatilis의 개체군성장률, N4 = 4일 후의 개체수, N0 =접종된 B. plicatilis의 개체수, 4 = 배양일수)의 식에 의하여 산출하였다.
시험의 유효성은 급성독성시험의 경우 대조구에서 부화유생의 생존율이 90%이상, 만성독성시험의 경우 대조구에서 개체군 성장률이 0.55이상으로 시험종료시점에서 가장 낮은 시험농도구(6.25%)에서 성장억제비율(percentage growth inhibition)이 50% 미만인 조건이며, 모두 유효성을 충족하였다.
BWMS의 배출수가 어류의 생존 및 기형발달에 미치는 영향을 알아보기 위하여 OECD에서 제시한 방법에 따라 치어의 4일간 생존(급성독성)과 수정란의 7일간 생존 및 기형발달(만성독성)을 관찰하였다(OECD[1992], [1998b]). 시험에 사용된 넙치(Paralichthys olivaceus) 치어는 시험 전 2주 또는 3주간 실험실조건에서 순치하였으며, 먹이는 침강사료(수협사료, 1호)를 사용하였고 어체중량의 4%(약 8 g)를 하루 3회 공급하였다. 염분 34 psu 배출수 시험에 사용된 치어의 체장과 체중은 각각 2.0±0.22 cm(평균±표준편차)과 0.03±0.02 g이었으며, 염분 20 psu 배출수 시험에 사용된 치어는 4.31±0.38 cm과 0.59±0.15 g이었다. 치어의 4일간 생존 시험은 30 L 유리수조에 시험수 20 L를 분주한 후 넙치 치어 20개체씩 수용하였으며, 3개의 반복구를 두었다. 사육조건은 온도 20±1 ℃, 명암주기 16L:8D로 조도 2,000 lux이었고 부드럽게 폭기하였다. 시험용액은 2일에 1회 사이폰을 이용하여 수조바닥의 배설물을 제거하면서 시험수의 2/3가량을 환수하였으며, 먹이는 공급하지 않았다.
수정란의 생존 및 기형발달 시험은 수정 후 12시간 이내의 어란을 상업 종묘생산장(경양수산, 여수)에서 분양받아 사용하였으며, 각 시험수에 7일 동안 노출시켜 난황이 사라지기 전까지의 기간동안 생존율과 기형 발달율을 관찰하였다. 생존율 시험은 1 L 비이커에 시험용액 0.8 L를 분주 한 후 수정란 30개를 수용하였으며, 3개의 반복구를 두었다. 사육조건과 환수는 치어의 4일간 생존시험과 동일하게 하였다.
시험의 유효성은 4일간 생존 시험의 경우 대조구에서 치어 생존율이 90%이상, 수정란의 7일간 생존 및 기형발달 시험의 경우 시험종료 시 대조구에서 수정란에서 부화자어의 생존율 70%이상의 조건이며, 모두 유효성을 충족하였다. 7일간 생존 및 기형발달 시험의 생존율은 Kim[2000], Shin et al.[2009]과 Kim[2007]의 문헌을 참고하였다.
LOEC(lowest observed effect concentration)와 NOEC(no observed effect concentration)는 S. costatum 개체군 성장률, B. plicatilis의 생존율 및 개체군 성장률, P. olivaceus의 생존율과 기형 발달율 자료로 ANOVA test를 이용하여 산출하였고, 대조구 자료와 각 시험구 자료의 평균을 비교하였다. ANOVA test의 절차는 Shapiro-Wilk’s test로 자료의 정규분포를 검증한 후, Bartlett’s test로 자료의 등분산을 검증하였고, Dunnett’s test와 Steel’s many-one rank test(B. plicatilis의 생존율 및 개체군 성장률 자료)를 이용하여 유의수준 a=0.05에서 차이를 검증하였다. S. costatum과 B. plicatilis의 L(E)C50은 선형보간법(linear interpolation)을 이용하였고, P. olivaceus의 LC50은 7일간 생존율 자료를 사용하여 Maximum Likelihood-Probit 방법으로 산출하였다. 모든 자료의 통계분석은 TOXCALC 5.0 program(Tidepool scientific software, USA)를 이용하였다.
2.3 화학분석
AquaStar™ BWMS에 의하여 생성 가능한 활성물질을 확인하기 위하여 ozone, chlorine peroxide, sulfide, bromate와 bromide를 분석하였고, CHOH, BrOH, BrO- 등은 TRO(total residual oxidant, 총잔류산화물)와 FRO(free residual oxidant, 유리잔류산화물)의 농도를 측정하였다. 측정장비는 DPD(N,N'-diethyl-p-phenylenediamine) method를 사용하는 CLX online residual chlorine monitor(HF scientific, USA)를 사용하여 현장에서 측정하였다.
활성물질인 TRO는 수중에 존재하는 유기물과 반응하여 relevant chemicals를 생성하게 되며 이를 확인하기 위해 bromate, volatile halogenated organic compounds, halogenated acetonitriles(HANs), halogenated acetic acids(HAAs), chlorinated phenols(ClPhs), brominated phenols(BrPhs)과 adsorbable organic halogens(AOX)를 측정하였다. 해수 채집 시 분석 전까지 시료의 변질을 막기 위하여 volatile halogenated organic compounds, halogenated phenols 및 AOX는 기포가 생기시지 않도록 해수 시료를 갈색유리병에 가득 채운 후, 잔류염소가 있는 시료는 티오황산나트륨(Na2S2O3, sodium thiosulfate)을 첨가한 후 산을 추가하였다. HANs와 HAAs는 갈색유리병에 10 mg의 염화암모늄을 첨가하고 염산(6M)을 1~2방울 첨가한 후 시료를 유리병에 기포가 없도록 채취하였다. bromate는 PE 병에 Ethylenediamine 10 mg을 첨가하여 시료의 성상이 유지되도록 하였다. 모든 화학분석은 국제표준시험방법으로 분석하였고, 각 성분별 분석관련 장비 및 표준시험방법은 Table 1에 제시하였다.
2.4 물질의 지속성, 생물축적성 및 생태독성
AquaStar™ BWMS에 의하여 생성된 화학물질 배출 시 해양생태계에 미치는 위해성 유무를 판단하기 위해서 생성된 화학물질을 대상으로 각 화학물질의 지속성(P, persistency)과 생물축적성(B, bioaccumulation)그리고 생태독성(T, toxicity)을 평가를 하였다. 지속성(P)은 화학물질의 반감기로, 생물축적성(B)은 log Kow 값으로, 생태독성(T)은 생태독성자료를 이용하여 평가하였다. PBT 평가는 MEPC[2011c]에서 제안한 기준을 적용하여 반감기가 60일 초과, log Kow 값은 3 초과, 만성독성실험에 의한 NOEC값이 0.01 mg/L 미만일 경우 PBT 특성을 가지는 물질로 판단하였다. PBT 평가를 위한 반감기, log Kow 및 BCF 계수는 EPI suit™ (v4.1, US EPA)를 활용하였고, 실험에 근거한 자료가 있을 경우 실험값을 우선 적용하였다. 생태독성 자료는 ECOTOX database (US EPA[2009])를 활용하였다.
2.5 PEC와 PNEC
AquaStar™ BWMS의 배출수가 해양에 배출되었을 경우 환경위해성을 가질 수 있는지 여부를 판단하기 위하여 유해지수를 산출하여 평가하였다. 유해지수는 배경농도보다 높게 검출된 각각의 화학물질에 대하여 PEC와 PNEC를 산출하여 비교하는 방법으로 PEC/PNEC가 1 이상이 산출될 경우 위해성을 가지는 것으로 판단한다. 생성된 각 화학물질의 PEC는 MAMPEC 3.0모델에 탑재된 상업 무역항(GESAMP-BWWG model harbour)을 적용하여 산출하였다(Baart et al.[2008]). 생성된 각 화학물질에 대한 특성 정보는 OECD SIDS 및 European commission joint Research Centre에서 제공하는 database에서 수집하였으며, database에 없는 화학물질은 물질 제조사에서 제공하는 MSDS(material safety data sheet)의 자료를 활용하였다. PNEC는 수집된 생태독성자료 중 가장 낮은 값에 평가계수(assessment factor, MEPC[2011c])를 적용하여 산출하였다. PNEC 산출 시 각 화학물질에 대한 생태독성정보의 수집은 ECOTOX database(US EPA[2009])를 이용하였다.

List of standard methods applied to chemical analysis in this study (TRO: total residual oxidant; FRO: free residual oxidant)
3. 결 과
3.1 BWMS의 배출수에 대한 WET test
AquaStar™ BWMS의 배출수에 노출시킨 시험생물들의 실험결과에 근거하여 NOEC, LOEC와 LC50 또는 EC50을 산출하였다(Table 2). AquaStar™ BWMS의 배출수에 가장 민감한 시험생물은 S. costatum이었다. 염분 20 psu 배출수에 72시간동안 노출한 시험결과는 NOEC, LOEC 및 EC50이 각각 25.00, 50.00 및 69.97%였고, 96시간동안 노출한 시험결과는 NOEC, LOEC 및 EC50이 각각 50.00, 100.00 및 85.68%였다. B. plicatilis의 개체군 성장을 이용한 만성독성시험은 염분 20 psu 배출수에 96시간 노출시킨 결과 NOEC와 LOEC가 각각 50.00% 및 100.00%였고 LC50은 100.00% 이상 산출되었다. 넙치(P. olivaceus) 수정란을 이용한 실험결과 염분 20 psu 배출수에서 NOEC 및 LOEC가 각각 50.00 및 100.00%였고, LC50은 100.00% 이상으로 산출되었다(Table 2).
3.2 화학분석결과
염분 34 psu 배출수에서 TRO는 0.03 mg/L이하로 검출되었고, 부산물질은 bromate, volatile halogenated organic compounds가 7종, HANs가 1종, HAAs가 7종으로 총 16종이 검출되었다(Table 3). 그 중 배경농도보다 높은 농도로 검출되어 Electrolysis BWMS에 생성된 것으로 판단되는 화학물질은 volatile halogenated organic compounds 6종, HAAs 7종 및 HANs 1종이었다. Volatile halogenated organic compounds 6종 중 1,2-dichloroethane의 농도가 0.08 μg/L-1로 가장 낮았고, tribromomethane의 농도는 486.00 μg L-1로 가장 높았다. HAAs 7종 중 trichloroacetic acid의 농도가 0.88 μg L-1로 가장 낮았고, monochloroacetic acid의 농도는 54.90 μg L-1로 가장 높았다. HAN은 dibromoacetonitrile 1종이 3.42 μg L-1의 농도로 검출되었다.
염분 20 psu 배출수에서 TRO는 0.03 mg/L이하로 검출되었고, 활성물질 1종과 부산물질 21종이 검출되었다. 부산물질은 volatile halogenated organic compounds가 8종, HAAs가 9종, HANs가 3종과 chloropicrin이 검출되었다(Table 4). 그 중 AquaStar™ BWMS에 생성된 것으로 판단되는 화학물질은 volatile halogenated organic compounds 5종, HAAs 6종, HANs 4종 및 chloropicrin이었다 (Table 4). Volatile halogenated organic compounds 5종 중 bromochloromethane의 농도는 5.32 μg L-1로 가장 낮았고, tribromomethane의 농도가 129.00 μg L-1로 가장 높았다. HAAs 6종 중 dichloroacetic acid의 농도는 1.08 μg L-1로 가장 낮았고, monochloroacetic acid의 농도는 151.00 μg L-1로 가장 높았다. HANs 4종 중 bromochloroacetonitrile이 0.11 μg L-1로 가장 낮았고, dibromoacetonitrile의 농도는 0.24 μg L-1로 가장 높았다. Chloropicrin의 농도는 0.08 μg L-1이었다.

Concentration of generated relevant chemicals in salinity 34 psu treated discharge water (TDW) from AquaStar™ BWMS (MDL: minimum detection limit; unit: μg/L)
3.3 지속성, 생물축적성 및 생태독성
AquaStar™ BWMS에 의하여 생성된 18종 화학물질의 반감기는 8.67~60.00일로 60일을 초과하는 화학물질은 없었고, log Kow 값과 BCF 계수가 각각 0.22~2.16과 3.16~17.80 L kg-1 wet-wt.로 log Kow 값이 3을 초과하거나 BCF 계수가 2,000 L Kg-1 wet-wt.를 초과하는 화학물질은 없었다(Table 5).
AquaStar™ BWMS에 의해 생성된 18종의 화학물질에 대한 생태독성값을 Table 6에 정리하였다. 그룹별로 각 물질에 대한 가장 낮은 생태독성값을 살펴보면, bromate에 대한 48 hr-EC50은 30,000 μg L-1이었고, volatile halogenated organic compounds의 생태독성값은 1,200~240,000 μg L-1이었다. HAAs의 생태독성은 28~69,000 μg L-1였고, HANs의 생태독성값은 20~550 μg L-1이었으며, chloropicrin의 생태독성값은 16~63,000 μg L-1이었다.
3.4 PEC와 PNEC
AquaStar™ BWMS에서 생성된 18종의 화학물질들은 일간 배출양이 8.00×100~4.86×104 μg L-1였고, PEC는 4.58×10-4~4.87×100 μg L-1였다 (Table 7). PNEC는 가장 낮은 생태독성값에 10~1,000의 평가계수를 적용한 결과 1.6×10-2~3.2×102 μg L-1였다. PEC/PNEC는 2.54×10-6~1.93×10-1로 1을 초과하는 화학물질은 없었다.

Ecotoxicity data of relevant chemicals generated by AquaStar™ BWMS (source: ECOTOX database (US EPA, 2009); N.R.: Not reported)
4. 고 찰
본 연구에서 AquaStar™ BWMS의 배출수에 가장 민감하게 반응한 생물은 S. costatum으로 EC50이 69.97%이었다. MEPC에 제출된 공개 보고서들을 정리해보면, 많은 전기분해를 사용하는 BWMS의 배출수에 대하여 식물플랑크톤인 S. costatum 또는 Isochrysis galbana가 가장 민감하게 반응하는 것으로 보고되어 본 연구의 결과와 일치하였다(Table 8). 그러나 전기분해 장치를 사용하는 4개 BWMS의 배출수에서는 잔류독성이 검출되지 않아 본 연구의 결과와 차이를 보였다(MEPC[2010c], [2011f], [2011h], [2012]).

Most sensitive test organisms on treated discharge water from developed BWMS using electrolysis (WET: whole effluent toxicity)
AquaStar™ BWMS 배출수의 잔류독성은 특정 원인물질에 의한 것일 수도 있지만, 전기분해장치를 사용하는 BWMS의 경우 초기 TRO의 주입 농도와 소독부산물의 종류수에 따라 강도가 달라지는 것으로 생각된다. 선행연구결과들을 인용 및 정리하여 S. costatum 의 EC50값과 초기 TRO 농도, 생성된 소독부산물들의 종류수와 소독부산물 그룹의 농도들 사이의 상관관계를 분석하였다(Table 9). S. costatum의 EC50값은 초기 TRO의 농도와 강한 양의 상관관계를 보였고(r=0.818, n=8, P<0.05), 이는 초기 TRO의 농도가 높을수록 잔류독성이 높아짐을 의미한다. 소독부산물 종류수와 EC50과 높은 양의 상관관계를 보였으며(r=0.854, n=8, P<0.01), HAAs의 농도(r=0.712, n=8, P<0.01)와 종류수(r=0.884, n=8, P<0.01) 모두 EC50과 높은 양의 상관관계를 보였다. 즉 상관관계분석 결과는 소독부산물의 종류가 다양해질수록 독성이 강해진다는 것을 의미하고 있으며, 특히 HAAs의 종류가 다양해질수록 독성이 강해진다는 것을 의미한다. 2개 이상의 혼합물에 대한 수중생물의 독성은 각 물질이 가진 독성보다 높거나 낮게 나타날 수 있으며, 배출수에 대한 수중생물의 독성은 방류수면의 pH 및 용존산소의 농도에 따라 상승작용 또는 길항작용을 할 수 있다(Lloyd[1987]). 따라서 상기 상관관계분석결과는 각 물질별 농도가 낮아 S. costatum 개체군의 성장을 억제할 수 없어도, 물질의 종류가 다양해지면 물질들 사이 독성은 상승작용으로 인해 개체군 성장 억제에 미치는 영향이 더 커질 수 있다는 것으로 해석할 수 있다.
TRO 초기 주입농도는 HAAs의 종류수(r=0.798, n=8, P<0.01) 그리고 농도(r=0.716, n=8, P<0.05)와 높은 상관관계를 보였다. 이는 활성물질의 주입농도가 높을수록 생성되는 HAAs 종류도 다양해지고, 농도 또한 높아짐을 의미한다. 염소처리 후 생성되는 volatile halogenated organic compounds의 한 그룹인 THMs(trihalomethanes)와 HANs, HAAs는 주로 수중의 유기물과 염소가 반응하여 생성된다 (Chang et al.[2004]). THMs의 가장 유력한 전구체는 NOM(natural organic material)의 휴믹성분이 대부분이지만, NOM성분들 중 biopolymer, building block, neutrals 성분들도 소독부산물의 전구체가 될 수 있으며, 이들 소독부산물들의 생성능은 HAAs가 THMs 보다 높다(Lee and Choi[2010]). Chang et al.[2004]은 염소처리를 한 정수과정에서 관말로 갈수록 THMs의 농도가 증가하였고, 이는 배급수관에서 잔류염소와 잔존유기물의 지속적인 접촉 때문인 것으로 추정하였다. 따라서 해수를 처리하고 5일간 처리수 탱크에 보관하면서 해수내의 사멸된 미생물 및 잔존유기물들과 TRO가 지속적으로 반응하여 생성되기 때문에 전기분해 장치를 이용하는 BWMS의 배출수 내에 존재하는 소독부산물들은 TRO의 주입농도와 사용된 해수내의 유기물의 종류와 양에 따라 달라지고, 소독부산물들의 종류가 다양할수록 잔류독성도 높아지는 것으로 판단된다.

Correlation matrix between EC50 value of Skeletonema costatum and Isochrysis galbana in WET test results, injection concentration of TRO as Cl2 (TRO Conc.), and number (No.) & concentration (Conc.) of by-products (DBP: disinfection by-productVOCs: volatile halogenated organic compounds; HAAs: halogenated acetic acids; HANs: halogenated acetonitriles) of BWMSs using electrolysis. *is represented as significant difference at P=0.05 (n=8, two-tail). **is represented as significant difference at P=0.01 (n=8, two-tail). Data source from MEPC ([2008a], [2009], [2010a], [2010b], [2010e], [2010f], [2011a], [2011b] and [2011f])

In Republic of Korea, list of ballast water management systems that make of Active Substances which received Basic and Final Approval from IMO (IMO[2010b], MEPC[2011d], [2011e~h], [2012a~d]; BWMS: ballast water management system)
한편, 염분 20 psu의 배출수에서 로티퍼 B. plicatilis의 미약한 만성독성이 검출되었다(Table 2). 전기분해를 사용하는 RWO BWMS(Clean Ballast)는 생물을 제거하기 위한 TRO 농도를 2 ppm으로 설정하여 ballast water를 처리하는 장치로써 배출 시 중화시켜 TRO 농도를 0.2 ppm 이하로 배출한다. 이 장비의 경우 염분 22 psu 배출수에서는 B. plicatilis에 독성 영향이 없었으며, 해수염분농도인 32-35 psu 배출수에서 B. plicatilis의 NOEC, LOEC 및 72hr-EC50이 각각 46%, 56% 및 >100%이상으로 본 연구의 결과와 다소 차이를 보였으나, 배출수의 B. plicatilis에 독성에 대한 만성독성은 미약한 것으로 나타났다(MEPC[2008a]). TWECO(Techwin Eco Co., Ltd.) BWMS는 전기분해를 이용하여 생물을 제거하기 위해 TRO 농도를 3 ppm으로 설정하여 처리하는 장치로써 배출 시 중화시켜 TRO 농도를 0.1 ppm 이하로 배출한다. 이 장비의 경우 ballast water 처리 5일 후 중화시켜 배출한 ballast water에서는 B. plicatilis에 독성의 만성독성이 검출되지 않았다(MEPC[2010c]). 전기분해를 사용하는 BWMS 중 상대적으로 높은 TRO 농도를 사용하는 OceanGuard™ BWMS(생물제거를 위한 TRO설정 농도: 15 ppm)는 ballast water 처리 후 중화하여 배출 시 TRO 농도는 0.2 ppm 이하인 장치이지만, 해수와 기수염분의 배출수에서는 B. plicatilis에 독성의 만성독성이 검출되지 않았다(MEPC[2010b]). 따라서 전기분해를 이용하여 ballast water를 처리하는 장치의 경우 설정한 TRO 농도와 B. plicatilis에 대한 독성은 일정한 경향성을 보이지 않고 있으며, TRO 농도 또는 부산물에 대한 상관성을 규명하기 위해서는 보다 많은 연구가 수행되어야 할 것으로 생각된다.
본 연구에서 어류의 미약한 만성독성이 검출되었다(Table 2). Park et al.[2005]는 전해소독에 의한 해수 및 담수어의 급성 어독성 연구에서 sodium thiosulfate로 전해수를 중화한 후 어류의 급성독성 영향이 관찰되지 않아 본 연구의 어류 급성독성 결과와 일치하였다. 그러나 Park et al.[2005]의 연구 중 잔류염소농도 0.2 mg/L의 저농도에서 Microphysogobio tungtingensis, Pungtungia nigra 및 Rodeus uyekii를 7일 이상 노출 시켰을 때 모든 어류가 생존하였고 유영저해현상 등이 관찰되지 않아 본 연구결과와 다소 차이를 보였다. 많은 연구들에서 어류와 무척추동물의 초기생활사 단계가 성체 단계보다 독성물질에 더 민감한 것으로 보고되었다(Mohammed [2013]). Hutchinson et al.[1998]은 어류에 있어서 자어는 배아 (embryos)와 치어보다 독성물질에 대하여 더 민감하고, 치어는 성체보다 독성물질에 더 민감하게 반응한다고 하였다. 본 연구에서 잔류염소에 대한 종 특이적 반응도 있겠지만, 본 실험에 사용된 넙치는 수정란을 이용하여 배아발생단계부터 자어기 동안 배출수에 노출을 시켰기 때문에 치어 및 성어를 이용한 Park et al.의 연구결과보다 민감하게 반응한 것으로 생각된다.
앞서 고찰한 바와 같이 AquaStar™ BWMS 배출수의 잔류독성은 소독부산물에 의한 영향이 주요 원인인 것으로 판단된다. 그러나 AquaStar™ BWMS에 의하여 생성된 각 소독부산물질들에 대한 환경위해성평가 결과는 이 물질들이 해양생태계에 배출되었을 때 수용 불가능한 부정적인 영향을 미치지 않을 것으로 예측되었다. 생성된 각 소독부산물들의 PBT 특성 중 물질의 지속성과 생물축적성의 기준이 되는 반감기와 log Kow 값이 60일과 3을 초과하는 물질들은 없었다. 물질의 생태독성에 대하여 평가하기 위한 만성독성 NOEC 값이 없는 물질들이 많아 생태독성에 대한 판단을 하기에 불확실성이 높았으나(Table 6), 생성된 물질 18종의 PEC/PNEC는 1을 초과하는 물질이 없었기 때문에 이들 화학물질이 해양생물에게 미치는 독성영향은 없을 것으로 판단된다. 따라서 화학물질의 특성 및 환경위해성평가 결과는 AquaStar™ BWMS의 배출수가 해양생태계에 서식하는 생물들에게 수용불가한 부정적인 영향을 미치지 않을 것임을 나타내었다. 그러나 전기분해의 방식, 전해수의 주입방식 및 TRO의 반응 시간등과 같은 여러 가지 요건들에 따라 본 연구에서 사용된 전기분해장치보다 다양하고 높은 농도의 화학물질들이 생성될 수 있기 때문에, 전기분해를 이용한 BWMS는 반드시 생태독성시험 및 환경위해성에 대하여 평가되어야 할 것이다.
국내 BWMS를 개발한 기업들 중 2012년 6월까지 IMO로부터 기본승인 이상을 받은 장치는 총 15개이며 활성물질을 사용하는 장치(전기분해 또는 오존)가 12개로 가장 많았다(Table 10). 전기분해 또는 오존과 같은 활성물질을 사용하는 장치는 산화제를 현장에서 만들거나 싣고 다니면서 선박평형수를 처리할 수 있다는 이 점 때문에 비교적 효과적이고 경제적인 방법으로 평가받고 있다 (Kim et al.[2012]). 개발사들은 선박평형수관리협약의 이행을 준수하기 위한 장비를 개발함에 따라 BWMS의 성능과 형식에 초점을 맞추고 있는 추세이다. 그러나 본 연구를 포함한 타 BWMS의 경우에서도 활성물질을 사용하는 BWMS의 배출수에 대한 WET test결과는 잠재적으로 잔류독성을 가지고 있거나 가질 수 있음을 시사하고 있다. 현재 개발사들은 새로운 장치를 개발하거나 개발된 장치의 성능과 형식을 개선시키기 위한 노력이 있을 것으로 판단되며, 이러한 개발사들의 노력과 동시에 해양환경에 미칠 수 있는 2차 오염영향을 최소화하기 위한 방안마련도 반드시 병행되어야 할 것이다.
Acknowledgments
본 연구는 AquaStar™ BWMS의 개발과 관련하여 진행되었던 일련의 실험결과들이며, 연구에 참여하고 도움을 주신 모든 분들에게 심심한 감사를 전합니다.
References
- APHA, Standard methods for the examination of water & wastewater, 21st edition, 4500-ClO2, American Public Health Association, Washington, USA, (2005).
- APHA, Standard methods for the examination of water & wastewater, 21st edition, 4500-O3, American Public Health Association, Washington, USA, (2005).
- ASTM, “Standard guide for acute toxicity test with the rotifer Brachionus”, ASTM, (2004), E-1440-91, p8.
-
A Mohammed, “Why are early life stage of aquatic organisms more sensitive to toxicants than adults?”, In: Gowder, S. (ed.), New insights into toxicity and drug testing, InTech, (2013), p49-62.
[https://doi.org/10.5772/55187]

- A Baart, J Boon, B van Hattum, “User manualquick guide MAMPEC version 2.0”, IVM Report, Deltares/Delft Hydraulics Report, Institute for Environmental Studies, Vrije Universiteit, Amsterdam, The Netherlands, Deltares/Delft Hydraulics, Delft, The Netherlands, (2008), p27.
- H.S Chang, Lee D.W., Kim C.M., Lee I.S., Park H., “Characteristics of disinfected byproducts in tap water of Seoul”, Journal of the Institute of Industrial Technology, (2004), 12, p97-102.
- H.-S Choi, Kim H.-S., Lee S.-G., “An estimation of the amount of ship's ballast water to be discharged at Korean major ports”, Journal of the Korean Society for Marine Environmental Engineering, 12, p284-288.
-
T.H Hutchinson, Solbe J., Kloepper-sams P., “Analysis of the ecetoc aquatic toxicity (eat) database iii-comparative toxicity of chemical substances to different life stages of aquatic organisms”, Chemosphere, (1998), 36, p129-142.
[https://doi.org/10.1016/S0045-6535(97)10025-X]

- IMO, “BWM technologies” (http://www.imo.org/OurWork/Environment/BallastWaterManagement/Documents/table%20updated%20in%20October%202010.pdf), (2010).
- ISO 10253, “International Standard, water quality – marine algal growth inhibition test with Skeletonema costatum and Phaeodactylum tricornautum”, International Standard Organisation, Geneva, Switzerland, (2006), p12.
- ISO 15061, “Water quality - Determination of dissolved bromate - Method by liquid chromatography of ions”, International Standard Organisation, Geneva, Switzerland, (2001).
- ISO 7393-2, “Water quality - determination of free chlorine and total chlorine - Part 2: colorimetric method using N,Ndiethyl-1,4-phenylene diamine, for routine control purposes”, International Standard Organisation, Geneva, Switzerland, (1985).
- ISO 9562, “Water quality - Determination of absorbable organically bound halogens (AOX)”, International Standard Organisation, Geneva, Switzerland, (2004).
-
C.R Janssen, Persoone G., Snell T.W., “Cyst-based toxicity tests. VIII. Short-chronic toxicity tests with the freshwater rotifer Brachionus calyciflorus”, Aquatic Toxicology, (1994), 28, p243-258.
[https://doi.org/10.1016/0166-445X(94)90036-1]

-
E.-C Kim, Oh J.-H., Lee S.-G, “Consideration on the concentration of the active substances produced by the ballast water treatment system”, Journal of the Korean Society for Marine Environmental Engineering, (2012), 15, p219-226.
[https://doi.org/10.7846/JKOSMEE.2012.15.3.219]

- I.B Kim, “Fish aquaculture”, Gudeok press, Busan, Korea, -433, (2000).
- J.-S Kim, Gill D.-S., “Electrolysis characteristics of shipboard wastewater to manage the marine pollution”, Journal of Korean Society of Water Science and Technology, (2007), 15, p17-24.
- K.S Kim, “Domestic legislation for acceptance of “International Convention for the Control and Management of Ship's Ballast Water and Sediments”, Journal of the Korean Society of Marine Environment & Safety, (2005), 11, p83-96.
- K.S Kim, “Effect of heavy metal on early life stage of oliv flounder, Paralichthys olivaceus”, MSc. Thesis, Pukyong National University, Busan, Korea, (2007).
- B.-H Lee, Lee J.-K., Gil D.-S., Kawk S.-Y., “Ammonia-nitrogen removal in sea water by using electrolysis”, Journal of Aquaculture, (1997), 10, p435-438.
- K.W Lee, Yang H.S., “Chemical Oceanography”, p35, (1998).
- Y.-J Lee, Choi I., “Natural organic matter and DBP formation potential”, Abstract, Annual Joint Meeting Korean Society of Water and Wastewater and Korean Society on Water Environment, (2010), p559-560.
- R Lloyd, “Special tests in aquatic toxicity for chemical mixtures: interactions and modification of response by variation of physicochemical conditions”, In: Vouk, V.B., Butler G.C., Upton A.C., Parke D.V., Asher S.C., (eds.), Methods for Assessing the Effects of Mixtures of Chemicals, New York, John Wiley & Sons, (1987), p491-507.
- MEPC, “Harmful aquatic organisms in ballast water, application for final approval of the RWO ballast water management system (CleanBallast) submitted by Germany”, Marine Environment Protection Committee 59/2, (2008a).
- MEPC, “Harmful aquatic organisms in ballast water, application for Final approval of the Resource BallastTechnologies System (Cavitation combined with Ozone and Sodium Hyochlorite treatment) submitted by South Africa”, Marine Environment Protection Committee 59/2/10, (2008b).
- MEPC, “Harmful aquatic organisms in ballast water, application for Basic approval of Kwang San co., Ltd. (KS) Ballast water management system “En-Ballast” submitted by the Republic of Korea”, Marine Environment Protection Committee 60/2/7, (2009).
- MEPC, “Harmful aquatic organisms in ballast water, application for Final approval of HHI ballast water management system HiBallast (Filter Version) submitted by the Republic of Korea”, Marine Environment Protection Committee 62/2/5, (2010a).
- MEPC, “Harmful aquatic organisms in ballast water, application for final approval of the OceanGuard™ ballast water management system submitted by Norway”, Marine Environment Protection Committee 61/2/7, (2010b).
- MEPC, “Harmful aquatic organisms in ballast water, report of the thirteenth meeting of the GESAMP-Ballast water working group”, Marine Environment Protection Committee 61/2/15, (2010c).
- MEPC, “Harmful aquatic organisms in ballast water, application for Final approval of the Severn Trent De Nora BalPure® ballast water management system submitted by Germany”, Marine Environment Protection Committee 61/2/9, (2010d).
- MEPC, “Harmful aquatic organisms in ballast water, application for basic approval of GEA westfalia separator BallastMaster ballast water management system submitted by Germany”, Marine Environment Protection Committee 62/2/2, (2010e).
- MEPC, “Harmful aquatic organisms in ballast water, application for Basic approval of STX Metal Co., Ltd. ballast water management system (Smart Ballast) submitted by the Republic of Korea”, Marine Environment Protection Committee 62/2/8, (2010f).
- MEPC, “Harmful aquatic organisms in ballast water, application for final approval of AquaStarTM ballast water management system”, Marine Environment Protection Committee 63/2/3, (2011a).
- MEPC, “Harmful aquatic organisms in ballast water, application for Basic approval of EcoGuardian™ Ballast water management system submitted by the Republic of Korea”, Marine Environment Protection Committee 63/2/4, (2011b).
- MEPC, “Methodology for information gathering and the conduct of work of the GESAMP-BWWG (updated version September 2011)”, Marine Environment Protection Committee 63/2-10, (2011c).
- MEPC, “Harmful aquatic organisms in ballast water, report of the fifteenth meeting of the GESAMP-Ballast water working group”, Marine Environment Protection Committee 62/2/11, (2011d).
- MEPC, “Harmful aquatic organisms in ballast water, report of the sixteenth meeting of the GESAMP-Ballast water working group”, Marine Environment Protection Committee 62/2/12, (2011e).
- MEPC, “Harmful aquatic organisms in ballast water, report of the seventeenth meeting of the GESAMP-Ballast water working group”, Marine Environment Protection Committee 62/2/18, (2011f).
- MEPC, “Harmful aquatic organisms in ballast water, report of the eighteenth meeting of the GESAMP-Ballast water working group”, Marine Environment Protection Committee 63/2/10, (2011g).
- MEPC, “Harmful aquatic organisms in ballast water, report of the nineteenth meeting of the GESAMP-Ballast water working group”, Marine Environment Protection Committee 63/2/11, (2011h).
- MEPC, “Harmful aquatic organisms in ballast water, report of the twentieth meeting of the GESAMP-Ballast water working group”, Marine Environment Protection Committee 63/2/21, (2012a).
- MEPC, “Harmful aquatic organisms in ballast water, report of the twenty-first meeting of the GESAMP-Ballast water working group”, Marine Environment Protection Committee 64/2/6, (2012b).
- MEPC, “Harmful aquatic organisms in ballast water, report of the twenty-second meeting of the GESAMP-Ballast water working group”, Marine Environment Protection Committee 64/2/7, (2012c).
- MEPC, “Harmful aquatic organisms in ballast water, report of the twenty-third meeting of the GESAMP-Ballast water working group”, Marine Environment Protection Committee 64/2/19, (2012d).
- OECD, “Fish, acute toxicity test”, OECD guideline for the testing of chemicals (203), (1992).
- OECD, “Fish, Short-term toxicity test on the embryo and sac-fry stages”, OECD guideline for the testing of chemicals (212), (1998).
- S.-W Park, Kim S.-K., Lee K.-W., “A study on industrial wastewater treatment using the electrolysis”, Journal of Nakdonggang Environmental research institute, (1998), 3, p131-142.
-
Y.-S Park, Kim D.-S., “Effect of water quality of artificial sewage on E. coli disinfection using electrolysis process”, Journal of the Environmental Sciences, (2011), 20, p1115-1124.
[https://doi.org/10.5322/JES.2011.20.9.1115]

- Y.-S Park, Kim Y.-J., Lee K.-P, Rhie K., “Acute toxicity of electrolysis on aquatic and marine fishes”, Institute of Global Environment, (2005), 15, p69-77.
- Y.K Shin, Cho K.C., Jang D.J., Jin Y.G., “Effect of crude oil on early life stage of the flounder, Paralichthys olivaceus”, Journal of Environmental Health and Toxicology, (2009), 24, p119-125.
- US EPA 300.1, “Determination of inorganic anions in drinking water by ion chromatography”, U.S. Environmental protection Agency, Cincinnati, Ohio, USA, (1997).
- US EPA 524.2, “Measurement of purgeable organic compounds in water by capillary column gas chromatography/mass spectrometry”, U.S. Environmental protection Agency, Cincinnati, Ohio, USA, (1995).
- US EPA 551.1, “Determination of chlorination disinfection byproducts, chlorinated solvents, and halogenated pesticides/herbicides in drinking water by liquid-liquid extraction and gas chromatography with electron-capture detection”, U.S. Environmental protection Agency, Cincinnati, Ohio, USA, (1995).
- US EPA 552.2, “Determination of haloacetic acids and dalapon in drinking water by liquid-liquid extraction, derivatization and gas chromatography with electron capture detection”, U.S. Environmental protection Agency, Cincinnati, Ohio, USA, (1995).
- US EPA 8041A, “Phenols by gas chromatography”, (2007).
- US EPA, “The ECOTOX (ECOTOXicology) database”, (http://www.epa.gov/ecotox/ecotox_home.htm), (2009).
- B.S Yoon, Rho J.H., Kim K.I., Park K.S., Kim H.R., “Development of ballast water treatment technology (Feasibility study of NaOCl produced by electrolysis)”, Journal of the Korea Society for Marine Environmental Engineering, (2005), 8, p174-178.