거제 남동부 내만해역의 식물플랑크톤 군집 월 변화 특성
초록
거제 남동부 내만 해역을 대상으로 식물플랑크톤 군집의 월 변화 특성을 파악하기 위한 현장조사는 2018년 6월부터 2019년 5월까지 월 1회 3개의 정점에서 실시하였다. 결과 출현한 식물플랑크톤 종은 54속 97종으로 여름에서 초겨울까지 급격히 출현 종수가 감소하였고, 겨울에서 봄까지 증가하였다. 출현한 유해식물플랑크톤은 규조류 Pseudo-nitzschia pungens, 와편모조류 Dinophysis acuminata, D. fortii, Lingulodinium polyedra, Gymnodinium catenatum, Margalefidinium polykrikoides, 침편모조류 Heterosigma akashiwo 등으로 다양하였다. 식물플랑크톤 현존량은 표층에서 1월 0.8 cells mL-1에서 7월 154.4 cells mL-1까지의 변동 폭으로 변화하여, 평균 32.0 cells mL-1로 봄과 여름에 높고, 가을과 겨울에 낮은 세포 밀도를 나타내었다. 우점종은 여름에 와편모조류 Prorocentrum triestinum, Tripos fusus 및 규조류 Chaetoceros affinis, Nitzschia sp., Skeletonema costatum-ls, 가을 규조류 Chaetoceros debilis, Paralia sulcata, Thalassionema nitzschioides, 겨울 규조류 Chaetoceros curvisetus, Ch. socialis, Dentoluna pulima, Eucampia zodiacus, S. costatum-ls 그리고 봄은 규조류 Ch. curvisetus, D. pulima, E. striata, E. zodiacus, Pn. pungens, S. costatum-ls 및 와편모조류 P. triestinum, Scrippsiella trochoidea로 변하여, 비교적 계절 천이가 분명하였다. 다양도 지수 및 우점도 지수에 의한 식물플랑크톤 군집구조의 시간적 변화가 큰 특징을 보였다. 즉 거제 남동부 내만 해역의 식물플랑크톤 군집은 계절적 변화가 매우 컸으며, 이러한 변화는 거제도 주변 해역의 쓰시마 난류 및 담수 혼합 등 해수 유동과 밀접하게 관계되는 것으로 판단되었다.
Abstract
We carried out field survey on the analysis for a characteristics of monthly variation of phytoplankton community in the Inner Bay of southeastern Geoje Island, South Sea of Korea from June 2018 to May 2018. The results showed that phytoplankton community consisted of 54 genera 97 species showing a relatively simple. The harmful phytoplankton that appeared were diatom, Pseudo-nitzschia pungens, dinoflagellates, Dinophysis acuminata, D. fortii, Lingulodinium polyedra, Gymnodinium catenatum, Margalefidinium polykrikoides, and chloromonad, Heterosigma akashiwo. The species number of phytoplankton dropped sharply from summer to early winter, and increased from winter to spring. Phytoplankton cell density ranged from 0.8 cells mL-1 in January to 154.4 cells mL-1 in July with the average layer being 32.0 cells mL-1 low in autumn and winter and high in summer and spring. The seasonal succession of phytoplankton dominant species was distinct dinoflagelates, Prorocentrum triestinum, Tripos fusus and diatoms, Chaetoceros affinis, Nitzschia sp., Skeletonema costatum-ls in summer, Chaetoceros debilis, Paralia sulcata, Thalassionema nitzschioides in autumn, Chaetoceros curvisetus, Ch. socialis, Dentoluna pulima, Eucampia zodiacus, S. costatum-ls in winter, and Ch. curvisetus, D. pulima, E. striata, E. zodiacus, Pn. pungens, S. costatum-ls and P. triestinum, Scrippsiella trochoidea in spring. The phytoplankton community by the ecological indices showed a very large fluctuation and unstable structure. In other words, the phytoplankton community structure in the Inner Bay of southeastern Geoje Island showed a very large change in monthly variations. And it could be determined to be closely related to seawater movements such as Tsushima warm current and freshwater mixed from Nakdong estuary.
Keywords:
Southeastern geoje, Harmful phytoplankton, Dominant species, Cell density, Ecological indices, Seawater movements키워드:
거제 남동부, 유해식물플랑크톤, 우점종, 세포 밀도, 생태지수, 해수 유동1. 서 론
연안해역은 육상에서 다양한 유기 및 무기물질 공급으로 영양염이 풍부하여 높은 생물생산을 나타내어, 어장으로서 높은 가치(Ryther[1969])를 나타내고 있을 뿐만 아니라 적조 등 다양한 해양환경문제를 발생시키고 있다. 그러기에 연안해역은 생물해양학은 물론 환경해양학 분야에서도 높은 관심을 보이는 곳이다([Hopkinson and Smith[2005]; Cloern et al.[2014]). 특히 하구역을 포함한 연안해역은 담수 유입량에 따른 복잡한 염분 성층 구조로 물리·화학적 환경인자는 물론 생물학적 인자의 농도의 변화가 크다(Hoshiai[1964]; McLusky[1993]). 그리고 식물플랑크톤 군집은 하천을 통해 공급된 풍부한 영양염으로 Dictylum, Rhizosolenia, Thalassiosira 등과 같이 상대적으로 대형 종으로 구성되며, 환경변화에 적응이 탁월한 종들이 우점한다(Cloern[2018]).
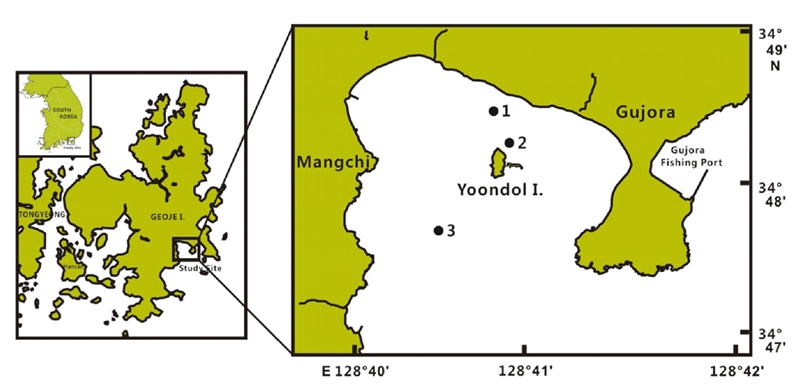
거제도는 진해만 입구에 위치하여 낙동강에서 배출되는 담수의 영향은 물론 동중국해로 유입되어 동해로 유출되는 양자강 희석수를 포함한 쓰시마난류 영향을 강하게 받는 해역이며, 이들 수괴의 해수유동 특성에 따라 식물플랑크톤 등 해양생물의 성장 및 분포가 크게 영향을 받는다(Shin et al.[2007]; Lim and Baek[2018]). 또한, 거제도 북서부 및 북동부는 한국 굴지의 조선산업단지 등 대형 공업단지가 조성되어 있으며, 남동부 및 남서부는 한려해상국립공원에 해당하는 해역으로 대규모 패류 양식장이 위치하여, 외부 및 해역내부에서도 해양환경변화에 대한 압력이 상대적으로 큰 해역이다. 특히 구조라 인근 거제 연안해역은 대규모의 석유비축 단지가 위치하여 유조선 출입도 많은 곳으로, 유류오염이 염려되지만, 최근 인공으로 바다숲이 조성되고 있다(FIRA[2019]).
거제 주변 해역을 대상으로 보고된 식물플랑크톤 관련 기존 연구는 거제 서부해역인 한산-거제만의 굴 양식장을 중심으로 다수의 식물플랑크톤 군집 분포, 적조생물 및 와편모조류 휴면포자에 대한 연구(Pospelova and Kim[2010]; Suh et al.[2015]; Kang et al.[2018]; Lim and Baek[2018]; Kim et al.[2019]) 등이 있다. 그리고 기타 남해의 광역적 수괴분포와 관한 연구에서 거제 일부 해역이 포함된 연구(Baek et al.[2010]) 등이 있지만, 거제 구조라 연안해역에 대해서는 와편모조류의 휴면포자와 관련된 연구(Shin et al.[2007]) 및 여름 남해 연안해역의 식물플랑크톤 군집 연구(Yoon et al.[2019])에서 일가부 소개된 내용이 있을 뿐이다.
그러나 거제도 남동부에 위치하는 구조라 주변 해역은 어장의 효율적 이용과 관리는 물론 해역의 효율적 관리 및 환경보전을 위해 해양환경 및 기초생물에 대한 학술자료가 요구되지만, 현재 이러한 자료가 많지 않다. 때문이 이 논문은 구조라 내만 해역을 대상으로 식물플랑크톤 군집의 시간적 변동 특성을 파악하여, 거제 연안해역의 효율적 어장이용 및 관리, 그리고 연안해역의 환경보전에 필요한 기초자료를 제공하고자 한다.
2. 재료 및 방법
거제 남동해역에 위치하는 구조라 연안에서 식물플랑크톤 군집의 월 변화 특성을 파악하기 위해 2018년 6월부터 2019년 5월까지 매월 1회, 3개 정점을 대상으로 표층과 저층(수심 7~9 m) 해수에 대한 표본을 채집하였다(Fig. 1). 조사는 소형선박을 이용하였고, 채수는 용량 3.0 L의 반돈채수기로 해수 500 mL를 차광된 표본병에 채수하여 루골 용액으로 최종 농도가 2.0%가 되도록 고정하였다. 고정한 표본은 실험실에서 차광된 플라스틱 메스실린더를 이용 48시간 이상 정치시켜 수 회 상등액을 제거하는 방법으로 최종농도 10 mL가 되도록 50배 농축하였다(OSC[1986]). 검경은 1.0 mm 간격의 가로와 세로 선이 들어 있는 계수판(Rigosha, No. 5608-C)을 사용하여 농축 시료 0.1 mL를 미분간섭장치(DIC)가 장착된 광학 현미경(Nikon, Eclipse 80i)으로 100X ~ 400X 배율로 종의 동정과 계수를 하였다. 식물플랑크톤 동정은 식물플랑크톤 관련 도감(Cupp[1943]; Chihara and Murano [1997]; Tomas[1997]; Hallegraeff et al.[2010]; Omura et al.[2012]) 및 다양한 분류논문을 참고하였다. 그리고 종명에 대한 분류체계는 World Register of Marine Species(WoRMS, www.marinespecies.org)에 따라 정리하였다.
검경 자료를 이용하여 식물플랑크톤 출현 종조성, 세포 밀도에 의한 현존량 및 우점종 등을 도출하였고, Primer program(Plymouth Routines In Multivariate Ecological Research)을 이용하여 정점별로 다양성 지수(H') 및 우점도 지수(D)를 아래 계산식을 이용하여 산출하였다.
- ① 다양성 지수: H' = -ΣPi× ln(Pi) (Shannon and Weaver[1963]) Pi: i번째 종의 점유율
- ② 우점도 지수: D = (Y1 + Y2)/Y(McNaughton[1968])
Y: 총 세포수, Y1과 Y2: 첫 번째와 두 번째 우점종의 세포수
3. 결과 및 고찰
3.1 식물플랑크톤 군집
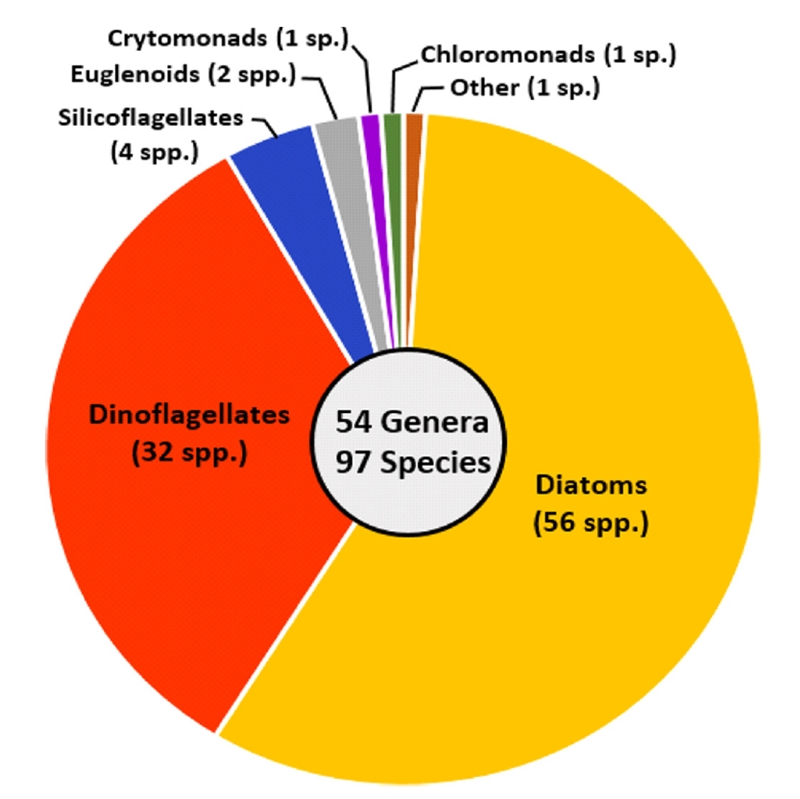
거제 남동부 내만 해역에서 출현이 확인된 식물플랑크톤 종은 54속 97종으로, 분류군별로는 은편모조류가 1속 1종을 보였고, 규조류(담수종 포함)가 33속 56종, 와편모조류가 15속 32종, 규질편모조류가 3속 4종, 침편모조류가 1속 1종, 유글레나조류가 1속 2종, 그리고 미동정 편모조류가 1종 출현하였다(Fig. 2).
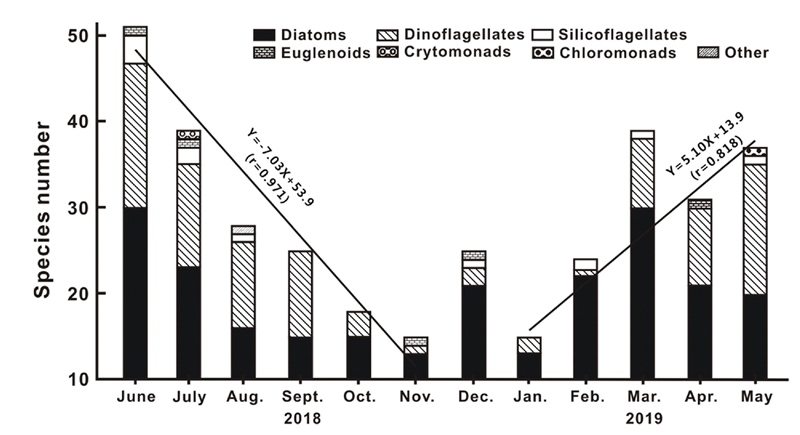
출현 종수의 월 변화는 저수온기에 15종(1월 및 11월)으로 매우 단조로운 종조성을 보였고, 수온상승기에 51종(6월)으로 다양하였다. 즉 봄 3월에서 여름 8월에 거쳐 28종에서 51종 범위에서 평균 월 37.5종이 출현하였으며, 가을 9월에서 겨울 2월까지는 15종에서 25종 범위에서 평균 월 20.3종이 출현하였다. 즉 여름에서 초겨울까지는 급격한 출현 종수의 감소를 나타내었지만, 겨울에서 봄까지는 감소하는 비율보다 낮게 완만한 증가세를 보여(Fig. 3), 수온에 크게 영향을 받는 것으로 나타났다.
연간 출현이 확인되는 종은 중심규조 Rhizosolenia setigera 1종뿐이었지만, Eucampia zodiacus, Proboscia alata 및 우상규조 Nitzschia longissima 3종은 4계절 출현하였고, 중심규조 Chaetoceros affinis, Dictylum brightwellii. Leptocylindrus danicus, Rhizosolenia flaccida, Skeletonema costatum-ls, 우상규조 Pleurosigma normanii, 그리고 와편모조류 Scrippsiella trochoidea 등 7종은 3계절 출현이 관찰되었지만, 식물플랑크톤 출현종의 월 변화가 상대적으로 뚜렷한 특성을 보였다.
출현종 대부분은 한국 연안해역에 일반적으로 관찰되는 종들로, 연중 규조류가 다양하게 출현하여, 국내의 다른 연안해역과 유사하였지만(Yoon[2011]; Shin[2013]), 와편모조류는 고수온기 짧은 기간에 집중적으로 출현하는 특성을 보였다(Yoon[1995], [2011]; Yoon et al.[1992]; Lim and Baek[2018]). 그리고 연안어장에서 패류독화를 발생시키는 규조류 Pseudo-nitzschia pungens, 와편모조류 Dinophysis acuminata, D. fortii, Lingulodinium polyedra, Prorocentrum cordatum등도 출현하지만, 출현빈도는 1-2회, 세포 밀도는 1 cells mL-1 이하로 높지 않았다. 그러나 2018년 6월 Gymnodinium catenatum, 2019년 5월 출현한 Margalefidinium polykrikoides(=Cochlodinium polykrikoides) 및 Heterosigma akashiwo 등 적조 발생으로 연안 어장에 막대한 피해를 동반하는 유해생물이다(Yoon[2010]). 즉 M. polykrikoides는 한국 남해안에서 늦여름에서 초가을에 거처 대규모 적조 발생으로 막대한 수산피해를 발생시키는 종이지만(Li et al.[2020]), 국내에서는 아직도 출현군 동태가 명확하게 규명되어 있아, 초기 발생에 대한 정확한 정보가 요구된다. 다만, 일본 규슈서해연안에서는 연중 출현이 확인되며, 여수 성두의 육상정점에서도 대량의 해수를 농축(20 L→5 mL)한 시료에서 5월에서 10월까지 출현이 확인되었다(Matsuoka et al. [2010]). G. catenatum은 최근 남해에서 M. polykrikoides와 함께 적조를 형성하기도 하며, 광범위하게 출현하는 적조원인 생물이다(Lee et al.[2001]). 그리고 H. akashiwo는 국내에서 극도의 부영양화가 진행된 내만 해역에서 적조를 형성하는 종(Park et al.[1989])으로, 거제도 서부해역(Kang et al.[2018])은 물론 남해 연안에서 일반적으로 관찰되는 종으로, 일본 연안해역에서 1970년 이후 적조 발생으로 수산피해를 발생시키고 있다(Imai et al.[2006]; Shikata et al.[2008]). 또한, 구조라 및 한산도 연안해역의 와편모조류 휴면포자 관찰에서 이 연구에서는 출현하지 않은 국제적 대표 유독 플랑크톤인 Alexandrium catenella/tamarensis가 많은 양으로 출현하였고(Shin et al.[2007]; Pospelova and Kim[2010]), 기타 아열대성으로 부착성 유해종인 Protoceratium reticulatum, Pyrodinium bahamense의 출현을 보고(Pospelova and Kim[2010]) 되기에, 거제 주변 해역 패류양식장 관리를 위한 유해종의 모니터링이 필요하다.
식물플랑크톤 세포 밀도로 표현한 현존량의 월 변화는 표층에서 0.8 cells mL-1(1월)에서 154.4 cells mL-1(7월)의 범위로 변동하였고, 3개 정점을 평균한 값으로는 1.7 cells mL-1(11월)에서 87.4 cells mL-1(6월)의 범위에서 평균 32.0 cells mL-1를 보여, 일반적인 내만해역의 세포 밀도로는 낮은 수준이었다(Yoon[2011]). 저층은 1.2 cells mL-1(10월)에서 143.6 cells mL-1(7월)의 범위로 변동하였고, 3개 정점을 평균한 값으로는 2.0 cells mL-1(11월)에서 69.9 cells mL-1 : 단위 표현을 변환(6월)의 범위에서 평균 27.3 cells mL-1로 표층보다 다소 낮았다(Table 2).

Monthly variations of diatoms, phytoflagelates and total phytoplankton cell density in the southeastern Geoje Island
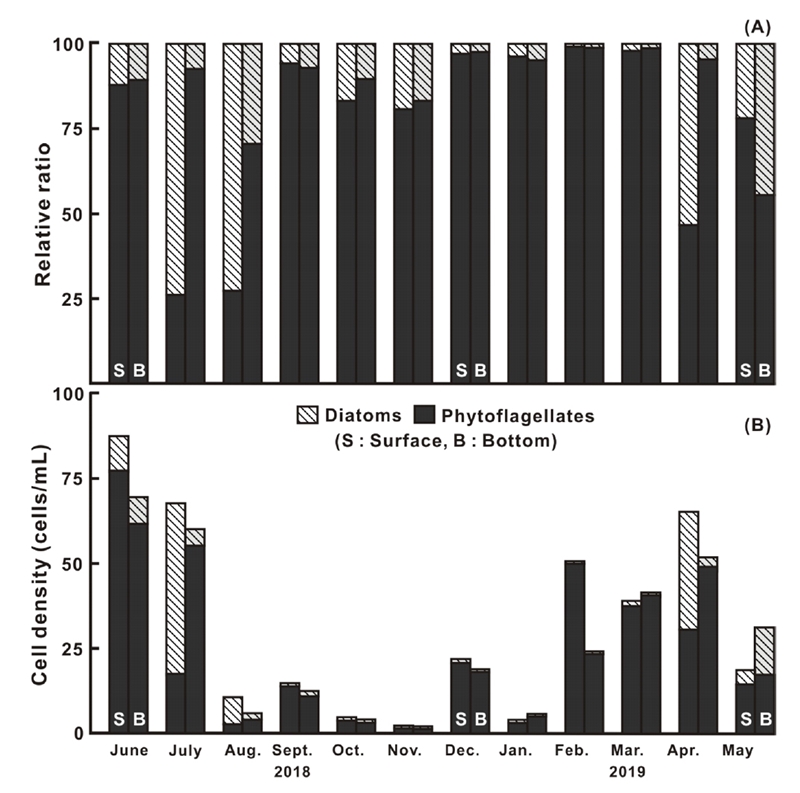
분류군별 현존량은 출현 종수와 유사한 경향으로 전체 식물플랑크톤 군집에서 규조류가 점유하는 비율은 표층에서 26.3%(8월)에서 99.6%(2월)의 변동 범위에서 평균 76.4%로서 높았으며, 저층은 55.7%(5월)에서 99.2%(2월)의 변동 범위에서 평균 88.5%로 표층 보다 높은 점유율을 나타내었다(Fig. 4A). 반면 와편모조류를 주로하는 식물성 편모조류의 점유율은 규조류와는 반대로 표층에서 0.4%(2월)에서 73.7%(8월)에서 평균 23.6%를, 저층은 0.8%(2월)에서 44.3%(5월)에서 평균 21.5%로 표층보다 낮은 점유율을 나타내었다. 특히 2018년 6~8월 여름 및 2019년 4월 봄까지의 저층에서 식물성 편모조류 출현량은 표층에 대해 평균 각 28.8%, 91.4%, 76.6% 및 93.6%가 낮은 세포 밀도를 나타내어, 표층과 저층에서의 현존량에 큰 차이를 보였다(Fig. 4B).
거제도 남동해역의 식물플랑크톤 현존량은 상대적으로 낮은 세포 밀도(Iizuka[1985]; Yoon[2011])로 출현하였으며, 최댓값으로는 인근 해역인 거제·한산만에서 6월 Prorocentrum donghaiense에 의해 관찰된 5.7 × 104 cells/mL 보다도 낮았다(Lim and Baek[2018]). 또한, 계절 변화에서 일반적인 온대해역에서 관찰되는 봄과 가을규조류에 의한 대발생(Muñiz et al.[2018])이 관찰되지 않았지만, 가을보다 겨울인 12월과 2월에 높은 세포 밀도를 보였다. 이러한 출현 양상은 중위도 개방해역과 내만 해역은 식물플랑크톤 성장을 지배하는 영양염 공급원에 차이가 있기 때문으로(Yoon[2011]), 겨울에 높은 현존량은 우리나라 내만 해역 및 수심이 얕은 연안해역에서 충분한 광량 및 영양염이 공급이 원활하기 때문이라 할 수 있다(Yoon[2011]; Tiselius et al.[2016]). 그리고 수온상승기인 봄과 여름에 식물성 편모조류 현존량에서 표층에 비해 저층에서 낮은 밀도를 보이는 것은, 편모조류가 미약하나 운동력을 가지고 있어, 낮과 밤을 통해 일주연직이동(Kamykowski and Zentara[1977]; Hall and Paerl[2011])을 하기 때문이다
식물플랑크톤 군집에서 정점 평균으로 5.0% 이상의 우점율을 나타내는 종을 우점종으로 하여 월별 변화를 살펴보았다(Table 3). 우점종에서 월 10% 이상의 우점율을 나타내는 종의 변화를 보면, 여름인 6월은 소형 우상규조 Nitzschia sp. 및 중심규조 S. costatum-ls가표·저층 모두에서 각 30%와 18% 전후의 우점율을 보였고, 7월은 표층에서 와편모조류 P. triestinum이 59.0%로 극우점을, 그리고 우상규조 N. longissima가 15.1%의 우점율을 보였으며, 저층은 표층과는 다르게 N. lonissima 및 E. zodiacus가 각 47.2%와 10.2%의 우점율을 나타내었다. 그리고 8월 표층은 와편모조류 P. triestinum 및 Tripos furca가 34.0%와 12.0%, 그리고 S. costatum-ls가 10.1%의 우점율을 보였으며, 저층은 S. costatum-ls가 15.2%의 우점율을 나타내었다(Table 3). 가을인 9월은 표·저층 모두 Ch. debilis가 73.9% 및 40.0%로 극우점하였으며, 10월 표층은 우상규조 Th. nitzschioides, 저층은 저서성 중심규조 Pa. sulcata에 의해 12.1%와 20.7%의 우점율로 출현하였다. 그리고 11월 표층은 특이한 우점종은 없으나, Chaetoceros 속이 23.0%, 저층은 Ch. curvisetus가 13.3%의 우점율을 나타내었다(Table 3). 겨울인 12월은 표·저층 모두에서 S. costatum-ls가 20% 전후의 우점율로 최우점하였고, 저층은 Ch. curvisetus가 12.6%의 우점율을 나타내었다. 1월 역시 표·저층 모두 S. costatum-ls가 38.5%의 우점율을 나타내었다. 그리고 2월 표층은 Ch. socialis, D. pumila, E. zodiacus가 각 33.7%, 18.7% 및 11.9%의 우점율을 보였고, 저층은 E. zodiacus, D. pumila가 30.5%와 18.4%의 우점율을 나타내었다(Table 3). 봄인 3월 표층은 E. zodiacus와 E. striata가 31.0%와 12.3%의 우점율을 보였으며, 저층은 Ch. curvisetus와 E. zodiacus가 16.1%와 14.1%의 우점율을 나타내었다. 4월 표층은 와편모조류 S. trochoidea가 49.9%로 극우점하였으며, Pn. pungens 및 E. zodiacus가 16.1%와 15.1%의 우점율을 보였고, 저층은 E. zodiacus, D. pumila 및 Pn. pungens가 각 42.1%, 15.3% 미 15.1%의 우점율을 나타내었다. 그리고 5월 표층은 중심규조 L. danicus 및 S. trochoidea가 27.8% 및 12.1%의 우점율을 보였고, 저층은 와편모조류 S. trochoides 및 P. triestinum이 15.6%와 12.9%의 우점율을, L. danicus와 S. costatum-ls가 15.4%와 11.2%의 우점율을 나타내어, 전체적으로 규조류의 우점율이 높게 나타났으마, 여름과 봄에는 와편모조류에 의한 우점율이 높은 특징을 보였다(Table 3).
즉 우점율 10% 이상 우점종의 천이를 계절별로 속 단위에서 정리하면, 여름은 와편모조류 Prorocentrum, Tripos, 규조류 Skeletonema, Chaetoceros, Nitzschia가 우점하였고, 가을은 9월을 제외하면은 낮은 세포 밀도로 뚜렷한 우점종은 없으나, 상대적으로 규조 Chaetoceros, Paralis, Thalassionema가 우점 출현하였다. 겨울은 중심규조 Skeletonema, Chaetoceros, Eucampia, Dentoluna가, 그리고 봄은 규조류 Eucampia, Leptocylindrus, Chaetoceros, Skeletonema, Detonula, Pseudo-nitzschia 및 와편모조류 Scrippsiella, Prorocentrum에 의해 우점되어(Table 4), 주로 연중 Chaetoceros에 의해 우점되는 것처럼 보였지만, Chaetoceros는 규조류에서도 매우 다양한 종을 포함하는 분류군으로, 종 수준에서는 비교적 계절에 따른 종 변화가 큰 특징을 나타내었다. 그리고 연안해역의 부영양화 지표종(Iizuka[1985])으로 한국 연안에서 연중 우점하는 S. costatum-ls(Yoon[2011])가 9월에서 11월까지의 가을에 전혀 출현이 관찰되지 않은 것은 매우 이례적인 현상으로 거제 내만 해역은 개방된 해역특성으로 아직 부영양화 진행이 되지 않은 해역으로 판단되었다. 그리고 한산·거제에서 여름 우점 보고되는 은편모조류 Cryptomonas sp 및 와편모조류 P. donghaiense, 그리고 12월의 와편모조류 Akashiwo sanguinea 등(Lim and Baek[2018])은 관찰되지 않았다. 특히 겨울과 봄에 우점한 대형 규조인 E. zodiacus는 한국 남서해역에서 저수온기에 우점 출현하는 종(Yoon[2017])으로, 일본에서는 김 성장이 가장 활발한 겨울에 적조를 형성하여 영양염 경쟁으로 김 성장을 저해시켜, 김 엽상체의 변색은 물론 생산을 극단적으로 감소시켜, 수산피해를 발생시키는 유해종으로 취급된다(Nishikawa et al.[2007]). E. zodiacus는 주로 저수온기에 우점하지만, 남해 일부 해역 및 서해에서는 여름에도 우점종으로 출현하는 것이 보고된다(Yoon et al.[2019]; Kim et al.[2020]). 이러한 겨울 대형종이 대량출현은 앞으로 우리나라 연안해역의 김 양식장 등 해조류 어장에도 피해가 예상되기에 출현에 대한 모니터링이 필요한 종이다.
영양염이 풍부한 연안해역의 식물플랑크톤 군집구조는 대형 종으로 구성되고Cloern[2018]), 무생물학적 환경농도 구배가 크기에 환경변화에 따른 종 천이가 빠른 것(Vigil et al.[2009])이나, 거제 동부의 와편모조류 휴면포자 분포가 해수 흐름에 밀접한 관련성이 있다는 것(Shin et al.[2007])에서 거제 동남부 내만 해역의 뚜렷한 우점종의 월 변화는 거제도 주변 해역에 영향을 미치는 쓰시마난류 및 낙동강 유출수의 혼합 등 해수 유동의 계절 변화(Shin et al. [2007]; Baek et al.[2010])에 의해 발생하는 것이라 할 수 있었다(Vigil et al.[2009]; Cloern[2018]).
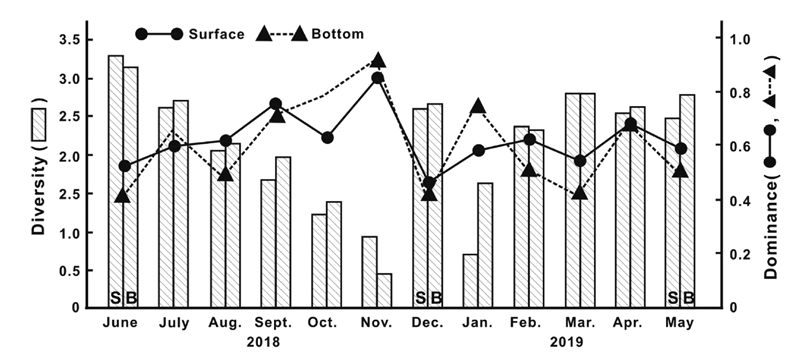
생물군집 구조 이해에 필요한 생태지수는 연구자에 따른 종 동정 기준이 다르기에 단순 비교가 쉽지 않다는 불합리한 점은 있지만, 생물군집 안정성 등을 평가하는 주요 지표이다. 거제 남동해역의 3개 정점을 수층별로 평균하여 표시한 다양도 지수는 표층에서 1월 0.729의 최솟값에서 7월 3.301의 최댓값의 범위에서 2.127 ± 0.767의 변동 폭으로 보였고, 저층은 11월 0.461의 최솟값에서 7월 3.158의 최댓값의 범위에서 2.239 ± 0.723의 변동 폭으로 낮았지만, 봄과 여름에 상대적으로 높은 지수를 보였고, 가을과 겨울에 지수가 낮았다(Fig. 5). 같은 방법으로 우점도 지수는 표층에서 12월 0.462의 최솟값에서 11월 0.861의 최댓값의 범위에서 0.623 ± 0.102의 변동 폭을, 저층은 12월 0.398의 최솟값에서 11월 0.917의 최댓값의 범위에서 0.600 ± 0.166의 변동 폭으로 다소 높았으나 다양도 지수와는 반대로 봄과 여름에 상대적으로 지수가 낮았고, 가을과 겨울에 높았다(Fig. 5).
거제 남동부 내만 해역 식물플랑크톤 군집의 다양도 지수는 서해의 금강 하구역(Shin[2013])에 비해 다소 높지만, 이른 여름 남해연안이나 광역적 금강 하구 해역에 비하면 다소 낮았다(Yoon et al.[2019]; Kim et al.[2020]). 그러나 우점도 지수는 평균값으로 다소 차이가 있지만, 서해 및 남해 연안의 지수와 유사한 결과를 나타내었다. 특히 우점도 지수에서 식물플랑크톤 출현 종수 및 세포밀도가 낮았던 겨울에 높은 지수를 보이는 것은 몇 종의 규조류가 높은 우점도를 보이기 때문이라 할 수 있었다(Yoon et al.[2019]). 그러나 기존 국내 연안에서 보고되는 생태지수의 계산에서는 네트에 의한 정성분석과 채수법으로 정량분석이 이원화되어 실시되고 있어(Shin[2013]), 다양한 출현종과 높은 세포 밀도에도 낮은 다양도 지수를 보이는 등 동일 표본을 이용한 정량 및 정성분석이 이루어진 연구결과와 단순 비교는 어렵다.
4. 결 론
거제도 남동부 내만 해역의 식물플랑크톤 군집은 상대적으로 단조로운 종조성에 낮은 현존량을 나타내고 있지만, 경시적인 변화폭이 매우 큰 특징을 보였다. 이러한 변화는 쓰시마난류, 낙동강 하구역의 담수 혼합 등 거제도 주변 해역의 해수 유동에 의한 영향으로 해석할 수 있었으며, 봄과 여름에 다양하게 출현하는 유독 및 유해 식물플랑크톤은 효율적인 어장이용 및 관리, 그리고 연안해역이 환경보전이란 측면에서 지속적 모니터링이 요구된다.
Acknowledgments
이 논문은 2020년 해양수산부 재원으로 해양수산과학진흥원의 지원을 받아 수행된 과제임(ICT기반 수산자원관리 연구센터).
References
-
Baek, S.H., Shin, K., Hyun B., Jang, P.-G., Kim, H.-S. and Hwang, O.-M., 2010, Distribution characteristics and community structure of phytoplankton in the different water masses during early summer of southern sea of Korea, Ocean and Polar Res., 32(1), 1-13.
[https://doi.org/10.4217/OPR.2010.32.1.001]

- Chihara, M, and Murano, M.(eds), 1997, An Illustrated Guide to Marine Plankton in Japan. Tokai Univ. Press, Tokyo.
-
Cloern, J.E., 2018, Why large cells dominate estuarine phytoplankton, Limnol. Oceanogr., 63(S1), S392-S409.
[https://doi.org/10.1002/lno.10749]

-
Cloern, J.E., Foster, S.Q. and Kleckner, A.E., 2014. Phytoplankton primary production in the world’s estuarine-coastal ecosystems, Biogeosci., 11, 2477-2501.
[https://doi.org/10.5194/bg-11-2477-2014]

- Cupp, E.E., 1943, Marine plankton diatoms of the west coast of north America, Bull. Scripps Inst. Oceanogr. Univ. of California, 5, 1-237.
- FIRA, 2019. A Study on the Effect of South Sea Forest Development and Management in 2018, Busan, Korea.
- Hallegraeff, G.M., Bolch, C.J.S., Hill, D.R.A., Jameson, I., LeRoi, J.M., McMinn, A., Murray, S., de Salas, M.F. and Saunders, K., 2010, Algae of Australia: Phytoplankton of Temperate Coastal Waters. CSIRO Publ., Cambella.
-
Hall, N.S. and Paerl, H.W., 2011, Vertical migration patterns of phytoflagellates in relation to light and nutrient availability in a shallow microtidal estuary, Mar. Ecol. Prog. Ser., 425, 1-19.
[https://doi.org/10.3354/meps09031]

-
Hopkinson, C.J. and Smith, E.M., 2005, Estuarine respiration: an overview of benthic, pelagic and whole system respiration. in: del Giorgio, P.A., Williams, P.J. le B. (Eds), Respiration in Aquatic Ecosystems, Oxford Univ. Press, New York, 122-146.
[https://doi.org/10.1093/acprof:oso/9780198527084.003.0008]

- Hoshiai, T., 1964, Synecological study on the intertidal zonation of the Asamushi coastal area with special reference to its reformation, Bul. Mar. Biol. Stn Asamushi, Tohuku Univ., 12, 93-126.
- Iizuka, S., 1985, The results of a survey of maximum densities in cell number of phytoplankton in coastal waters of Japan, Bull. Plankton Soc. Japan, 32(1), 67-72.
-
Imai, I., Yamaguchi, M. and Hori, Y., 2006, Eutrophication and occurrences of harmful algal blooms in the Seto Inland Sea, Japan, Plankton Benthos Res., 1(2), 71-84.
[https://doi.org/10.3800/pbr.1.71]

-
Kamykowski, D. and Zentara, S.J., 1977, The diurnal vertical migration of motile phytoplankton through temperature gradients, Limnol. Oceanogr., 22(1), 148-151.
[https://doi.org/10.4319/lo.1977.22.1.0148]

-
Kang, H.-E., Yoon, T.-H., Yoon, S., Kim, H.J., Park, H., Kang, C.-K. and Kim, H.-W., 2018, Genomic analysis of red-tide water bloomed with Heterosigma akashiwo in Geoje, PeerJ, 1-25.
[https://doi.org/10.7717/peerj.4854]

-
Kim, D., Lee, Y.-J., Kang, H.Y., Kwon, K.Y., Lee, W.-C. and Kwak, J.H., 2019, Seasonal variations in primary productivity and biomass of phytoplankton in Geoje-Hansan Bay on the Southern Coast of Korea, Ocean Sci. J., 54(2), 213-227.
[https://doi.org/10.1007/s12601-019-0005-y]

-
Kim, H.S., Kim, H., D. Yang and Y.H. Yoon, 2020, Spatio-temporal distribution patterns of phytoplankton community and the characteristics of biological oceanograpic environments in the Geumgang Estuary, West Sea of Korea in 2018 J. Environ. Biol., 38(2), 254-270.
[https://doi.org/10.11626/KJEB.2020.38.2.254]

- Lee, C.K., Kim, H.C., Lee, S.G., Jung, C.S., Kim, H.G. and Lim, W., 2001, Abundance of harmful algae, Cochlodinium polykrikoides, Gyrodinium impudicum and Gymnodinium catenatum in the coastal area of South Sea of Korea and their effects of temperature, salinity, irradiance and nutrient on the growth in culture, Korean, J. Fish. Aquat. Sci., 34(5), 536-544.
-
Li, Z., Matsuoka, K. and Shin, H.H., 2020. Revision of the life cycle of the harmful dinoflagellate Margalefidinium polykrikoides (Gymnodiniales, Dinophyceae) based on isolates from Korean coastal waters, J. Appl. Phycol.
[https://doi.org/10.1007/s10811-020-02125-0]

-
Lim, Y.K. and Baek, S.H., 2018. Seasonal distributional characteristics of phytoplankton adjacent to the oyster farming area of Hansan-Geoje Island. Korean J. Environ. Biol., 36(4), 647-658.
[https://doi.org/10.11626/KJEB.2018.36.4.647]

-
Matsuoka, K., Mizuno, A., Iwataki, M., Takano, Y., Yamatogi, T., Yoon, Y.H. and Lee, J.-B., 2010, Seed populations of a harmful unarmored dinoglagellate Cochlodinium polykrikoides Margalef in the East China Sea. Harmful Algae, 9(6), 548-556.
[https://doi.org/10.1016/j.hal.2010.04.003]

-
McLusky, D.S., 1993, Marine and estuarine gradients -An overview-, Netherlands J. Aquat. Ecol., 27(2-4), 489-493.
[https://doi.org/10.1007/BF02334809]

-
McNaughton, S.J., 1968, Structure and function in California grassland. Ecol., 49(5), 962-972.
[https://doi.org/10.2307/1936547]

-
Muñiz, O., Rodríguez, J.G., Revilla, M., Laza-Martínez, A., Seoane, S. and Franco, J., 2018, Seasonal variations of phytoplankton community in relation to environmental factors in an oligotrophic area of the European Atlantic coast (southeastern Bay of Biscay), Reg. Studies Mar. Sci., 17, 59-72.
[https://doi.org/10.1016/j.rsma.2017.11.011]

-
Nishikawa, T., Hori, Y., Tanida, K. and Imai, I., 2007, Population dynamics of the harmful diatom Eucampia zodiacus Ehrenberg causing bleachings of Porphyra thalli in aquaculture in Harima-Nada, the Seto Inland Sea, Japan, Harmful Algae, 6(6), 763-773.
[https://doi.org/10.1016/j.hal.2007.04.005]

- Omura, T., Iwataki, M., Borja, V.M., Takayama, H. and Fukuyo, Y., 2012, Marine Phytoplankton of the Western Pacific. Kouseisha Kouseikaku. Tokyo.
- OSC (The Oceanographic. Society of Japan), 1986, A Manual for Coastal Environmental Survey (Sediments and Biology), Kouseoshakouseikaku, Tokyo.
- Park, J.S., Kim, H.G., Lee, S.G., 1989. Studies on red tide phenomena in Korea coastal water. in: Okaichi, T., Anderson, D.M., Nemoto, T. (eds), Red Tides: Biology, Environmental Science, and Toxicology, Elsevier, New York, 37-40.
-
Pospelova, V. and Kim, S.J., 2010, Dinoflagellate cysts in recent estuarine sediments from aquaculture sites of southern South Korea, Marine Micropaleont., 76(1-2), 37-51.
[https://doi.org/10.1016/j.marmicro.2010.04.003]

-
Ryther, J.H., 1969. Photosynthesis and fish production in the sea, Science, 166(3901), 72-76
[https://doi.org/10.1126/science.166.3901.72]

- Shannon, C.E. and Weaver, W., 1963, The mathematical theory of communication. Univ. Illinois, Press, Urbana.
-
Shikata, T., Yoshikawa, S., Matsubara, T., Tanoue, W., Yamasaki, Y., Shimasaki, Y., Matsuyama, Y., Oshima. Y., Jenkinson, I.R. and Honjo, T., 2008, Growth dynamics of Heterosigma akashiwo (Raphidophyceae) in Hakata Bay, Japan, Eur. J. Phycol., 43(4), 395-411.
[https://doi.org/10.1080/09670260801979295]

-
Shin, H.H., Yoon, Y.H. and Matsuoka, K., 2007. Modern dinoflagellate cysts distribution off the eastern part of Geoje Island, Korea. Ocean Sci. J., 41(1), 31-39.
[https://doi.org/10.1007/BF03020908]

-
Shin, Y.K., 2013, An ecological study of phytoplankton community in the Geum river estuary, Korean, J. Ecol. Environ., 46(4), 524-540.
[https://doi.org/10.11614/KSL.2013.46.4.524]

-
Suh, S.-S., Park, M., Hwang, J., Kil, E.-J. Jung, W., Lee, S. and Lee, T.-K., 2015, Seasonal dynamics of marine microbial community in the South Sea of Korea, PLoS One, 10(6), e0131633. 1-9.
[https://doi.org/10.1371/journal.pone.0131633]

-
Tiselius, P., Belgrano, A., Andersson, L. and Lindahl, O., 2016, Primary productivity in a coastal ecosystem: a trophic perspective on a long-term time series, J. Plankton Res., 38(4), 1092-1102.
[https://doi.org/10.1093/plankt/fbv094]

- Tomas, C.R.(ed.), 1997, Identifying marine diatoms and dinoflagellates. Academic Press. Oxford.
-
Vigil, P., Countway, P., Rose, J., Lonsdale, D.J., Gobler, C.J. and Caron, D.A., 2009, Rapid shifts in dominant taxa among microbial eukaryotes in estuarine ecosystems, Aquat. Microb. Ecol., 54(1), 83-100.
[https://doi.org/10.3354/ame01252]

- Yoon, Y.H., 1995. Seasonal dynamics of phytoplankton community and red tide organisms in the northern Kamak bay, Southern Korea. Bull. Mar. Sci. Inst., Yeosu Nat`l Fish. Univ., 4, 1-15.
- Yoon, Y.H., 2010. Red Tides -Uprising of Sea-, Jibmundang, Seoul.
- Yoon, Y.H., 2011, Marine Environments and Phytoplankton in the South-western Sea of Korea. in: Choi, C.K. (Ed), The Plankton Ecology in Korean coastal waters. Donghwa Pub. Seoul, 68-93.
-
Yoon, Y.H., 2017, Spatio-temporal distributions of phytoplankton community in the coastal waters of central South Sea (CWoCSS), Korea. J. Korea Acad.-Indust. Coop. Soc. 18(1), 441-453.
[https://doi.org/10.5762/KAIS.2017.18.1.441]

- Yoon, Y.H., Rho, H.G. and Kim, Y.K., 1992, Seasonal succession of phytoplankton population in the Hamdok port, Northern Cheju Island. Bull. Mar. Sci. Inst., Cheju Nat`l Univ., 16, 27-42.
-
Yoon, Y.H., Park, J.S. and Kim, B.S., 2019, Spatial distributions of phytoplankton community in the coastal waters of South Sea, Korea during the early summer of 2018, Korean J. Environ. Biol., 37(2), 164-176.
[https://doi.org/10.11626/KJEB.2019.37.2.164]