하계 영산강, 하구호 및 하구 퇴적물 내 인의 생지화학적 특성
 ; Sung-Uk An2
; Sung-Uk An2 ; Sung-Han Kim3
; Sung-Han Kim3 ; Jae-Hyuk Shin4
; Jae-Hyuk Shin4 ; Hyo-Jin Lee5
; Hyo-Jin Lee5 ; Jung-Ho Hyun6
; Jung-Ho Hyun6 ; Jin-Sook Mok2, †
; Jin-Sook Mok2, †
초록
수층 내 인의 순환을 이해하는데 퇴적물 내에 인의 존재형태와 존재형태별 공급과 소비의 조절요인 규명이 중요한데 이들은 퇴적물 내 생지화학적인 환경특성과 밀접한 관계가 있다. 이 연구에서는 퇴적물 내 다양한 생지화학적인 특성을 가진 영산강(YR), 하구호(YL) 및 하구역(YE)에서 환경 요인 변화에 따른 인의 거동을 이해하기 위해 퇴적물의 지화학 성분 및 고형상 인의 형태별 분포 특성을 파악하였다. 하구호(YL, 10 μM)에서 빈산소 환경으로 공극수 내 누적된NH4+(65.7 mmol m-2)와 Fe2+(14.9 mmol m-2)의 값이 높게 나타났다. PO43-는 하구역(YE) 정점의 공극수에서 4-8배 이상 높게 나타났다. 인 용출율 또한 하구호(0.021 mmol m-2 d-1)보다 하구역(0.047 mmol m-2 d-1)에서 2배 정도 높게 나타났다. 한편, 퇴적물 내 누적된 총인의 값은 하구호(6,665 mmol m-2)에서 높고 하구역(1,000 mmol m-2)에서 급격히 감소하는 분포를 보였다. 퇴적물 내 인의 존재 형태를 분석한 결과, 영산강과 하구호에서 알루미늄 결합인(YR: 66%, YL: 40%)과 철 결합인(YR: 17%, YL: 30%)이 우세한 반면, 하구역의 경우 철 결합인(43%)과 자생성 칼슘 결합인(29%)이 우세하였다. 하구호는 빈산소 환경임에도 퇴적물 내 인이 알루미늄과 결합하여 비교적 안정한 형태를 유지함으로써, 인이 공극수 내로 분리되어 수층으로 용출되는 과정이 제한되었다. 반면, 하구역에서 인 형태 중 철 결합인의 비중은 우세하지만 철과 황화수소의 결합과정에서 공극수로의 인 배출이 일어날 수 있기 때문에 상대적으로 산화철에 대한 인의 흡착이 제한될 수 있음을 보여주었다. 이러한 결과는 하구둑 건설로 인한 환경변화(빈산소 형성, 황산염 공급 등)가 인의 거동을 조절하는 주요 인자로 작용할 수 있음을 제시하고 있다.
Abstract
To understand the behavior of phosphorus in the sediment of the Yeongsan River (YR), Lake (YL) and Estuary (YE), we investigated the characteristics of geochemical constituents and solid phase phosphorus. A hypoxic condition was confirmed in the lake sediment near the dyke (YL, 10 μM), where, freshwater discharge had not occurred for the 15 days prior to sample collection, whereas the dissolved oxygen concentration at the estuarine site (YE) was relatively high (165 μM). The high values of NH4+ (65.7 mmol m-2) and Fe2+ (14.9 mmol m-2) was integrated in the pore water at the lake (YL). On the other hand, PO43- in pore water was relatively at least 4-8 times higher in the estuary sediment (YE). Phosphorus release rates were twice as high in the estuary (0.047 mmol m-2 d-1) as the lake (0.021 mmol m-2 d-1), while the total phosphorus in the sediment was higher in the lake (6,665 mmol m-2) and decreased rapidly in the estuary (1,000 mmol m-2). After analyzing the speciation of phosphorus in the sediment, aluminum bound phosphorus (YR: 66%, YL: 40%) and iron bound phosphorus (YR: 17%, YL: 30%) were dominant for the Yeongsan river and lake, whereas the estuary dominated iron (43%) and authigenic calcium bound phosphorus (29%). Although the lake was a hypoxic environment, phosphorus in the sediment combined with aluminum to maintain a relatively stable form, limiting the process of phosphorus separated into the pore water and released into the water layer. Whereas, the ratio of iron binding in the phosphorus form in the estuary was dominant, but shows the adsorption of phosphorus to iron oxide might be relatively limited because release of phosphorus to the pore water might occur during the bonding process of iron and hydrogen sulfide. These results suggest environmental changes (e.g., environment of hypoxic, supply of sulfate) due to the construction of estuary dikes can act as a major factor in controlling phosphorus behavior.
Keywords:
Hypoxic environment, Phosphorus speciation, Aluminum bound phosphorus, Yeongsan River estuary키워드:
빈산소 환경, 인 존재형태, 알루미늄 결합 인, 영산강 하구1. 서 론
영양염류 중 인은 담수와 해양에서 식물플랑크톤의 생장을 제한하거나, 과도한 공급이 일어날 경우 부영양화를 유발하는 생태-환경 및 생지화학적으로 중요한 원소이다(Schindler[1974]; Tyrrell[1999]; Slomp[2011]; Kamarainen et al.[2009]; Michalak et al.[2013]). 인의 생지화학적인 순환은 수층과 퇴적물에서의 밀접한 상호 관계를 통해 이루어지며, 특히 퇴적물은 수층으로 인을 공급하거나 퇴적물 내에 저장하는 중요한 역할을 하고 있다(Ruttenberg[2003]; Paytan and McLaughlin[2007]; Slomp[2011]; Kraal et al.[2015]). 수심이 얕은 연안해양이나 담수호의 경우, 식물플랑크톤 생장에 필요한 영양염의 상당부분은 저층-수층 상호작용(benthic-pelagic coupling)을 통해 공급되기도 하는데(Bulleid[1984]; Hopkinson et al.[2001]; Kemp and Boynton[1984]; Lawrence et al.[2004]), 퇴적물에서 과도한 영양염 용출은 부영양화뿐만 아니라 (유해)조류의 대증식을 유발할 수 있다(Schindler[1974]; Meyer-Reil and Köster[2000]; Rozan et al.[2002]). 특히 인의 순환을 연구하기 위해서는 퇴적물 내에 인의 존재형태와 존재형태별 공급과 소비의 조절요인 규명이 중요하다. 철과 인의 결합은 환경 과학에서 중요한 연구 대상이 되어 왔으며 부영양화된 담수에서 인산염 제거에 대한 개선 방안으로 검토되고 있다(Ruttenberg[2003]). 퇴적물 내 인은 산화된 형태의 철과 결합 하여 존재하다가 산소가 부족한 혐기성 환경에서 철 환원에 의한 유기물 분해를 통해 산화철이 환원될 때 결합해 있던 인이 해리된다(Mortimer[1941]; Holdren and Armstrong[1980]; Thouvenot-Korppoo et al.[2012]). 또한 황산염(약 28 mM)이 풍부한 해양 퇴적환경에서는 황산염 환원 과정에서 만들어진 HS-가 Fe(II)와 결합하여 FeS, FeS2을 형성함에 따라, 상대적으로 철과 결합하지 못한 인은 공극수 내에 머무르거나 수층으로 이동되기도 한다(Hartzell and Jordan[2012]; Slomp et al.[2013]; An et al.[2019]).
한편, 하구역은 생산성이 높은 육상-해양 전이 생태계로써 오염물질 정화, 야생생물의 산란장 및 서식지 역할, 홍수나 태풍의 영향 완화 기능, 교육 및 휴양지 제공 등, 생태적인 가치 뿐만 아니라, 경제적인 가치도 높은 연안환경으로 인식된다(Hewson and Fuhrman[2004]). 급증하는 인구에 의해 초래된 물부족 문제를 해결하고 농업 및 산업 활동에 대한 수요가 증가함에 따라 전 세계적으로 45,000개 이상의 큰 댐과 약 80만개의 작은 댐이 건설되었다(Manatunge et al.[2008]; Rockström et al.[2009]). 그러나 일부 하구환경에서는 하구둑 및 방조제 건설로 하천과 해양의 자연적인 물질순환이 차단 되었으며, 하구호에서 수위조절을 위한 간헐적 방류를 통해 해양환경과 하구생태계의 순환이 이루어지고 있다. 하계 동안 하구역에서 둑 운영에 따라 정체가 지속되면 수온성층이 강화되어 저층으로 산소공급이 차단되므로 저층 빈산소를 야기할 수 있다(Diaz and Rosenberg[1995]; Park et al.[2001]; Youn et al.[2003]). 또한 하구둑으로 인한 담수와 해수 교환의 단절은 유속의 감소와 조간대의 감소, 조석의 진폭확장 등과 같이 수층과 퇴적물에서의 물리·화학적 특성을 변하게 하는 원인으로 작용할 수 있다(Portnoy and Giblin[1997]; Kang[1999]; Han and Park[1999]; Byun et al.[2004]). 일반적으로 하구둑 부근에서의 유속의 감소는 부유 퇴적물의 침전을 가속화 시키거나 수층에서 식물플랑크톤의 대증식을 야기시켜(Moon[1990]; Kim et al.[2006]; Min et al.[2012], Yoon et al.[2013]), 표층 퇴적물 내 유기물 축적을 가중시킨다. 퇴적물에 침전된 유기물은 산소, 질산염, 산화망간, 산화철, 황산염과 같은 다양한 전자수용체를 이용하는 호기성 및 혐기성 박테리아에 의해 분해되며(Canfield et al.[2005]), 표층 퇴적물에서 활발한 유기물 분해는 영양염의 재생 및 수층으로의 용출을 가속화시킬 수 있다(Boynton and Kemp[1985]; Giles et al.[2006]; Kim et al.[2017]; An et al.[2019]).
이 연구 지역인 영산강 하구를 대상으로 질소의 분해속도(Kim et al.[2009]), 방류에 의한 식물플랑크톤 생체량 및 환경인자 변동(Yoon et al.[2013]), 식물플랑크톤 1차 생산력에 관한 변화(Lee et al.[2011]), 인의 분해속도(Jahidul et al.[2008]), 지화학 및 유기물 분해 특성에 관한 연구(An[2013]) 등이 수행되었으며 영산강 외 한강하구에서 퇴적물의 생지화학적 반응에 관한 연구(Lim et al.[2009]), 낙동강 하구 퇴적물에서 생지화학적 유기탄소 순환(Lee et al.[2007]), 남해 하구 갯벌에서 탈질소화를 통한 질소 영양염 제거에 관한 연구(Heo et al.[2011]) 등이 보고되었다. 한편, 둑으로 단절되어 담수와 해수의 자연적 순환이 제한되고 간헐적 방류로 인한 정체가 지속되는 하구에서 인의 생지화학적인 특성과 존재형태에 관련된 연구는 드물게 진행되었다(An et al.[2019]).
따라서 이 연구는 하구역 퇴적물 내 지화학 성분 및 고형상 인의 형태별 분포 특성을 파악함으로써 하구둑으로 단절된 영산강 하구호와 하구역에서 빈산소 형성 및 황산염 공급 등에 따른 인의 거동을 이해하고자 하였다.
2. 재료 및 방법
2.1 연구지역
영산강 하구는 전라남도 목포시 영암군에 위치하며, 농지와 농업용수 공급 등을 위해 1981년 2월에 길이 4.3 km, 높이 19.5 m의 하구둑이 건설되었다. 이 연구는 2012년 8월에 영산강 하구둑을 기점으로 영산강 및 하구호 정점(YR, YL)과 하구역 정점(YE)에서 진행되었다(Fig. 1).
A map showing the sampling stations in the Yeongsan River (YR) and Yeongsan Lake (YL) and Yeongsan Estuary (YE).
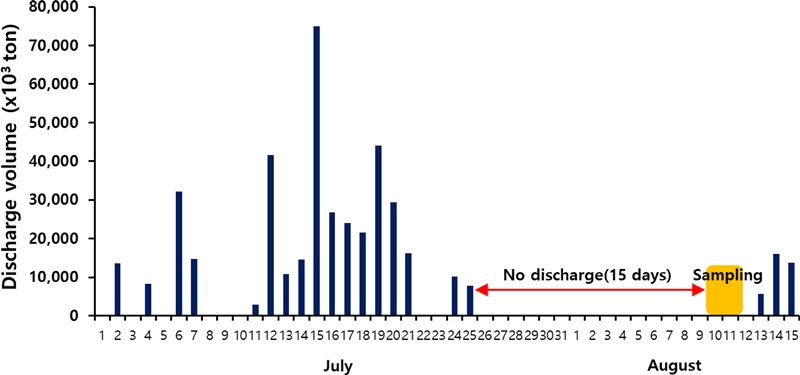
2012년 6-8월의 총 방류량은 약 11억톤으로 2-5월의 총 방류량(약 3억톤)보다 3.5배 가량 높았다(MOLIT[2012]). 하지만 이 연구조사시기 전 약 15일간 강우가 없었으며 수위조절을 위한 방류는 일어나지 않았다(Fig. 2).
2.2 환경요인
수온 및 염분, pH는 수질 다항목 측정기(YSI-6600V2)를 이용하여 관측하였다. 저층수 용존산소량(DO)은 150 mL의 용존산소병에 시료를 채수하여 윙클러(Winkler’s iodometric method) 개량법인 윙클러아지화변법에 의해 분석하였다(Carpenter[1965]).
2.3 퇴적물 시료 채집 및 전처리
퇴적물은 표층 교란을 최소화하기 위하여 잠수사가 아크릴 코어(내경 30 cm, 길이 45 cm)를 이용하여 퇴적물을 채취한 후, 각 분석 항목별로 부시료를 채취하였다. 공극수의 화학성분 분석을 위해 아크릴 코어(내경 5 cm, 길이 25 cm)를 이용하여 퇴적물을 채취하였으며 냉장 보관하여 실험실로 운반하였다. 질소가스로 충진된 혐기성 박스 안에서 깊이별로 퇴적물을 나눈 후, 50 mL conical tube에 담고 원심분리(3500 rpm, 10 min)하였다. 혐기성 박스 안에서 공극수를 취하여 syringe filter(MFS-25, CA, 0.2 μm)로 부유물을 제거시킨 다음, 각 분석항목별로 전처리를 하였다.
2.4 공극수 내 지화학 성분 분석
공극수 중 영양염(NH4+, PO43-) 분석 시료는 GF/F로 여과하여 냉동 보관한 후 영양염 자동분석기(QUAATRO SFA Analyzer, Seal Analytical)를 사용하여 각 파장별(630, 880 nm)로 분석하였다. 공극수 Fe2+ 분석은 ferrozine buffer(0.02% in 50 mM HEPES, pH7)에 산 처리된 시료를 넣고 10분 동안 200 rpm으로 흔들어 준 다음 UV-VIS recording spectrophotometer(UV-2401 PC, Shimadzu)로 측정하여 분석하였다(Stookey[1970]). SO42-의 농도 분석을 위해 퇴적물에서 뽑아낸 공극수 중 2 mL을 취하여 플라스틱 vial에 담고 20 μl의 진한 염산을 넣은 후 분석 전까지 냉동 보관하였으며, 이온 크로마토그래피(761 Compact IC, Metrohm)를 이용하여 농도를 측정하였다. HS-의 농도는 ZnAc(20%)로 고정된 시료를 Cline solution과 반응시킨 후 spectrophotometer를 이용하여 분석하였다(Parsons et al.[1984]). NH4+, PO43-, Fe2+, HS-, SO42-의 검출한계는 각각 0.021, 0.006, 1, 3 μM과 0.03 mM 이었다. 영양염의 경우 신뢰도 검증을 위해 NRC 표준물질 MOOS-3을 이용하였으며, 정확도는 96~108%로 분석되었다.
2.5 인 용출률 계산
퇴적물로부터 용출되는 용존무기인 플럭스는 수층과 퇴적물간의 농도 차에 의해 발생하는 분자 확산식을 통해 계산했다(Berner[1980]). Cz는 공극수내 영양염이며 Co는 저층수의 인의 농도, C1과 k는 가장 좋은 기울기의 변수(Best fitting parameters)이다. 퇴적물-수층의 인확산분포는 Fick’s first law of diffusion을 사용하여 구하였다(Schulz[2006]).
| (1) |
| (2) |
Fsed[mmol m-2 d-1]는 인산염의 확산 플럭스이고, φ는 표층퇴적물의 공극률, Ds[m2 s-1]는 걷보기 확산계수, dC/dz|z=0는 퇴적물-해수 경계면에서 농도 기울기이다(Boudreau[1997]; Li and Gregory[1974]).
2.6 인의 형태별 분석
퇴적물 내 인의 존재형태 분석은 Jensen et al.[1998]의 방법을 이용하여 총 6단계의 연속 추출과정으로 진행되었다. 퇴적물의 산소노출 및 추출 과정 중 인의 재흡착 방지를 위해 퇴적물 준비부터 약한 흡착인과 철 결합인 추출은 N2 환경 아래에서 수행하였다(Kraal and Slomp[2014]; Anschutz and Deborde[2016]). 1단계에서 약한 흡착인(Loosely sorbed P; Lsor-P)을 추출하기 위해 퇴적물 1 g을 50 mL 원심분리관에 넣어 1 M MgCl2 25 mL을 넣고 1시간 동안 흔들어서 추출하였다. 2단계는 철 결합인(Fe bound P; Fe(BD)-P)를 추출하는 단계로 0.11 M NaS2O4와 0.11 M NaHCO3을 섞은 시약(BD solution) 25 mL을 넣고 1시간 동안 흔들어서 추출하였다. 특히, 2단계 추출 마지막에 인을 추출한 용액을 1시간 동안 통기(aeration)시켜 dithionite에 의한 반응을 중단시켰다. 3단계는 알루미늄 결합인(Al bound P; Al-P)을 추출하는 단계로 0.1 M NaOH 25 mL을 넣고 18시간 동안 흔들어서 추출하였다. 4 단계는 자생성칼슘 결합인(Authigenic P; CFA-P)를 추출하기 위해 acetate buffer 25 mL을 넣고 3시간 동안 흔들어서 추출하였다. 1부터 4단계까지 각 추출 단계 마지막에 0.5 M NaCl로 시료를 세척하였다. 5단계는 쇄설성 인(Detrital P; Detr-P)를 추출하는 단계로 0.5 M HCl 25 mL을 넣고 1시간 동안 흔들어서 추출하였다. 마지막 6단계는 불용성 유기인(Refractory organic P; Ref-OP)을 추출하는 단계로 5단계에서 추출하고 남은 퇴적물 시료를 MQ water로 세척하고 105 °C에서 건조시킨 후, 520 °C에서 2시간 동안 태운 다음, 1 M HCl 25 mL을 넣고 10분 동안 끓여서 추출하였다. 단계별로 추출된 인은 molybdate blue method를 이용하여 spectrophotometer로 측정하였다(Parson et al.[1984]).
3. 결 과
3.1 환경요인
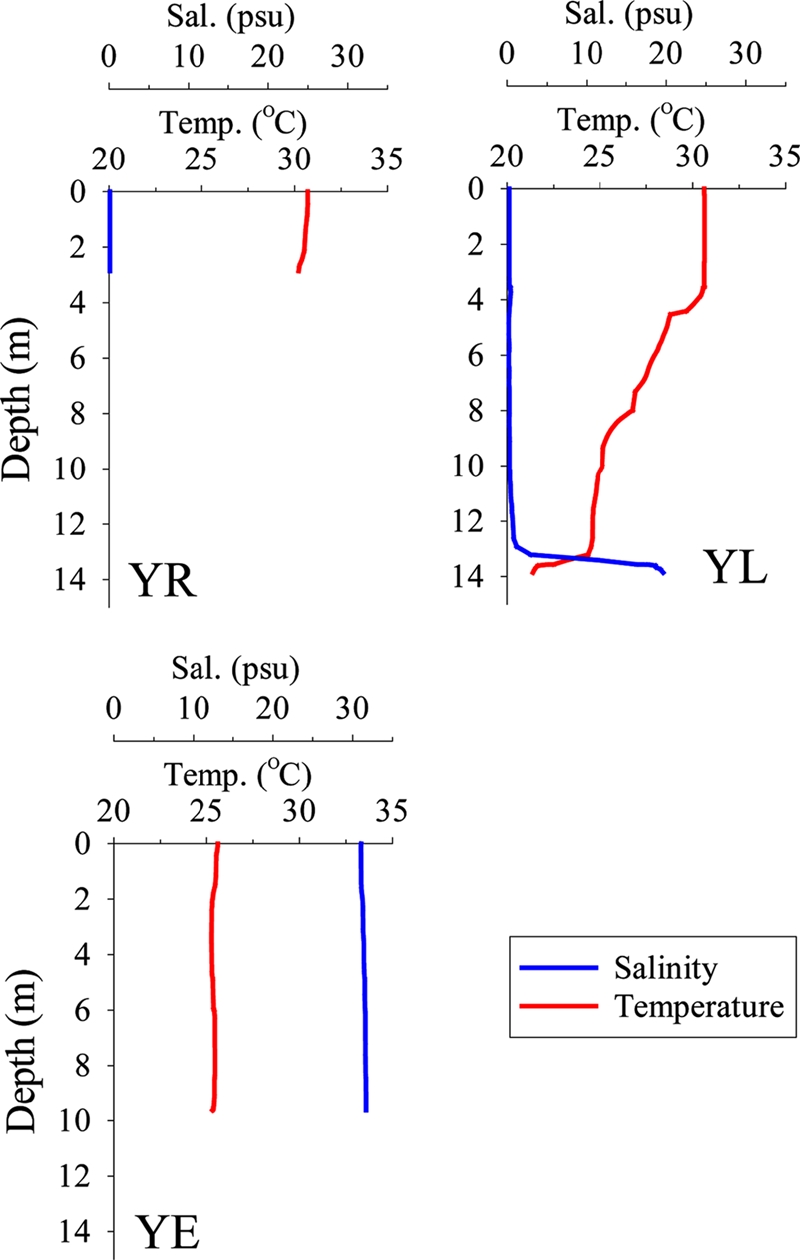
수온은 하구호 정점(YL)에서 표·저층간 수직적인 구배가 뚜렷한 반면, 하구역 정점(YE)에서는 비교적 일정한 수직 분포를 보였다. 상류에 위치한 영산강 정점(YR)은 3 m 이하의 낮은 수심으로 표·저층간 수온 차이는 작게 나타났다. 염분은 하구역(YE)의 저층에서 31.7를 보였으며 영산강(YR)에서 0.1로 낮게 나타났다. 한편, 둑 인근의 하구호(YL)의 경우, 담수환경에도 불구하고 저층에서 19.6로 비교적 높은 염분 농도를 나타내어 만조시 퇴적물을 통해 기수역으로부터의 해수 유입의 영향을 받는 것으로 여겨진다(Table 1, Fig. 3). 하구역(YE)에서 저층의 용존산소 농도가 165 μM로 호기성 환경을 나타낸 반면, 영산강(YR)과 하구호(YL)의 경우 저층에서 각각 84 μM, 10 μM의 낮은 용존산소 농도를 보여 혐기성 환경을 나타냈다. 저층 내 수소이온농도(pH)는 6.3-8.5의 분포 범위를 보였다(Table 1).
3.2 퇴적물 내 공극수의 지화학 성분 및 인 용출률
NH4+의 깊이별 농도는 담수 정점들(YR, YL)에서 각각 177~549 μM, 496~966 μM, 하구역 정점(YE)에서 235~303 μM의 범위를 나타냈으며 전반적으로 깊이에 따라 증가하는 경향을 보였다(Fig. 4a). 퇴적물 표층부터 10 cm까지 누적한 결과, 하구호 정점 YL(65.68 mmol m-2)에서 하구역 정점 YE(19.98 mmol m-2) 보다 3배 이상 높았다(Table 2).
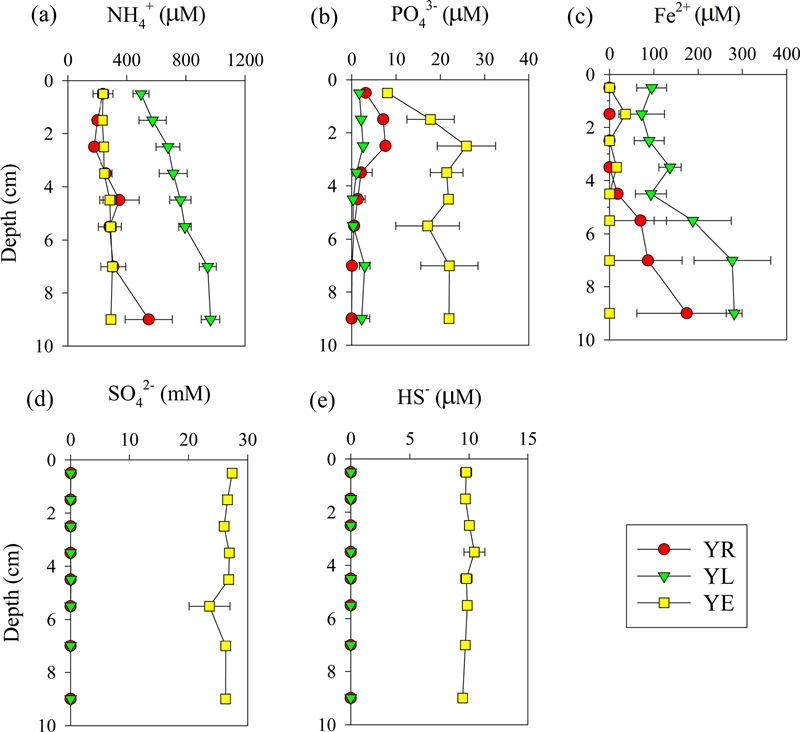
Vertical profiles of dissolved NH4+ (a), PO43- (b), Fe2+ (c), SO42- (d), HS- (e) in pore water at the three sampling stations. Error bars represent the mean ±1 SD from triplicate cores.

Depth integrated (0-10 cm) inventories of the porewater constituents (mmol m-2) dissolved inorganic phosphate (DIP) flux (mmol m-2 d-1) calculated with Fick’s first law
PO43-는 담수 정점들(YR, YL)에서 각각 0.06~7.60 μM, 0.31~2.94 μM, 하구역 정점(YE)에서 8.1~25.9 μM의 범위를 나타냈으며 하구호보다 하구역 정점에서 비교적 높은 농도를 보였다. 영산강과 하구호에서는 10 μM 이하 농도로 비교적 균일한 수직 분포를 보인 반면, 하구역에서는 깊이 3 cm에서 최대 25.9 μM 까지 나타났다(Fig. 4b). 퇴적물 표층부터 10 cm까지 누적한 결과, 하구역 정점 YE(1.44 mmol m-2)에서 하구호 정점 YL(0.17 mmol m-2)보다 8배 높게 나타났다(Table 2).
Fe2+는 담수 정점들(YR, YL)에서 각각 0~174 μM, 72~282 μM 의 범위를 나타냈으며 하구역 정점(YE)에서 0~36 μM의 농도 분포를 보였다(Fig. 4c). 퇴적물 표층부터 10 cm까지 누적한 결과, 하구호 정점 YL(14.88 mmol m-2)에서 하구역 정점 YE(0.37 mmol m-2)보다 약 40배 높게 나타났다(Table 2).
SO42-은 담수 정점들(YR, YL)에서는 모두 검출한계 0.03 mM 이하의 낮은 농도를 보였으며 하구역 정점(YE)에서는 평균 26.2 mM 로 나타났다(Fig. 4d). HS-는 담수 정점들 YR, YL에서 모두 검출한계 3 μM 이하의 낮은 농도로 나타났으며, 하구역 정점 YE에서 평균 9.8 μM로 비교적 균일한 수직분포를 보였다(Fig. 4e).
저층수와 공극수 내 인의 농도 구배에 따른 용출률을 계산한 결과, 빈산소 환경을 보였던 하구호 정점 YL(0.021 mmol P m-2 d-1)과 영산강 정점 YR(0.026 mmol P m-2 d-1)이 상대적으로 호기성 환경이었던 하구역 정점 YE(0.047 mmol P m-2 d-1)보다 약 2배 낮은 값을 나타냈다(Table 2).
3.3 퇴적물 내 인 존재형태
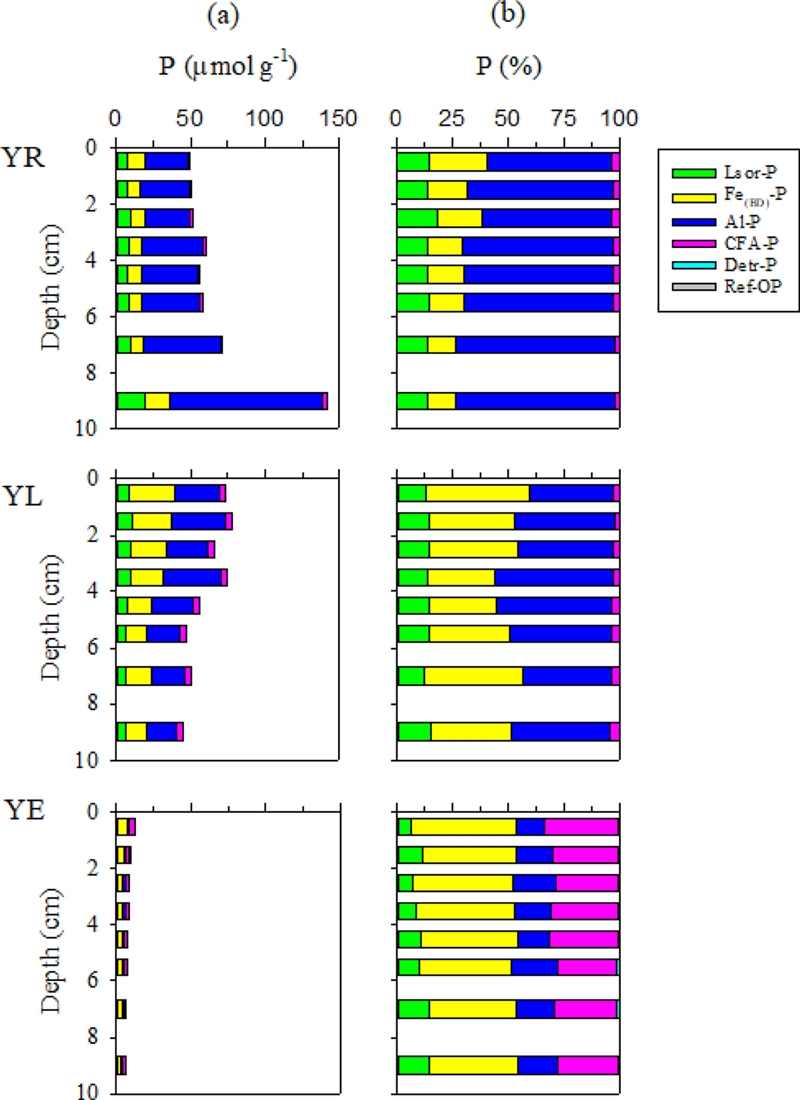
퇴적물 내 형태별 인 농도의 합으로 계산된 총인(Total P; TP)의 함량은 영산강 정점(YR)에서 가장 높았으며 하구역 정점(YE)으로 갈수록 감소하였다(Table 3).
퇴적물 내 인의 존재형태 가운데 약하게 흡착된 인(Lsor-P)은 산화-환원 상태에 따라 민감하게 반응하며 물에 잘 녹고 결합이 약하여 쉽게 용출될 수 있다(Jung et al.[2014]). 담수 정점들(YR, YL)에서 각각 7.02~19.37 μmol g-1, 5.64~10.10 μmol g-1 범위로 나타났으며, 하구역 정점(YE)에서는 0.62~1.06 μmol g-1로 하구호보다 낮은 농도 분포를 보였다(Fig. 5a). 퇴적물 표층부터 10 cm까지 누적한 결과, 영산강 정점 YR(1446 mmol m-2)부터 하구호 정점 YL(873 mmol m-2), 하구역 정점 YE(115 mmol m-2)에 이르기까지 점차 감소하는 것으로 나타났으며, 세 정점 모두 전반적으로 총인의 15% 이하를 차지하였다(Table 3, Fig. 5b).
철 결합인(Fe(BD)-P)은 산화철에 흡착되었거나 결합되어 있는 형태로(Jensen and Thamdrup[1993]), 담수 정점들(YR, YL)에서 각각 9.03~16.96 μmol g-1, 14.38~30.69 μmol g-1의 범위로 나타났으며 하구역 정점(YE)에서는 2.46~6.03 μmol g-1로 하구호보다 낮은 농도 분포를 보였다(Fig. 5a). 한편, 철 결합인은 하구역 정점(YE)에서 퇴적물 총인의 평균 42.6%로 인의 존재형태 중에서 가장 높은 비율을 차지하였으며, 하구호 정점 YR(16.9%), YL(29.5%) 보다 높아 해양환경으로 갈수록 퇴적물 내 그 비율이 상대적으로 높게 나타났다(Fig. 5b).
알루미늄 결합인(Al-P)은 주로 점토광물이나 산화알루미늄과 결합되어 있는 형태로(Jensen and Thamdrup[1993]), 상대적으로 산화-환원의 영향을 크게 받지 않는 것으로 알려져 있다(Moore and Reddy[1994]; Diaz et al.[2006]). 영산강 정점 YR에서 알루미늄 결합인은 65.6%로 퇴적물 내 존재형태 가운데 가장 높은 비율을 보였으며 27.84~102.35 μmol g-1의 범위로 퇴적물 깊이에 따라 증가하는 경향을 보였다. 하구호 정점 YL에서도 알루미늄 결합인이 퇴적물 내 총인의 평균 40.0%를 차지하여 YR과 동일하게 퇴적물 내인의 존재형태 중 가장 높은 비율을 보였으며, 20.29~38.60 μmol g-1의 수직분포 범위로 3~4 cm 깊이층에서 가장 높았다. 반면에 하구역 정점 YE에서는 알루미늄 결합인이 평균 16.7%로 철 결합인(평균 42.6%), 칼슘 결합인(평균 29.0%)보다 낮은 비율로 나타났다(Fig. 5a, b).
자생성 칼슘 결합인(CFA-P)은 탄산칼슘에 흡착된 인과 자생적으로 형성된 fluoroapatite로 구성되며 영산강 정점 YR과 하구호 정점 YL에서 각각 1.44~2.88 μmol g-1, 4.26~4.66 μmol g-1의 범위를 보였으며 평균 2.8%, 6.7%로 존재하였다. 하구역 정점 YE에서 1.64~4.24 μmol g-1의 범위로 하구호와 유사한 농도 수준으로 나타났지만 총인의 평균 29.0%를 차지하여 해양환경으로 갈수록 퇴적물 내 칼슘결합인이 높아지는 경향을 보였다(Fig. 5a, b).
쇄암질의 인회석(Detr-P)은 육상기원으로 자생적으로 형성되지 않고 퇴적이나 유입에 의해 생성되며(Jensen et al.[1998]), 담수 정점들(YR, YL)과 하구역 정점(YE)에서 0.01~0.16 μmol g-1의 범위를 보였고 총인의 2% 미만을 차지하였다(Fig. 5a, b). 불용성 유기인(Ref-OP)은 퇴적물 깊이에 따라 뚜렷한 변화 없이 일정하였으며 총인 중 낮은 분포 비율(0.2% 이하)을 보였다(Fig. 5a, b).
4. 고 찰
4.1 하구호 내 빈산소 수괴 형성시 인의 거동
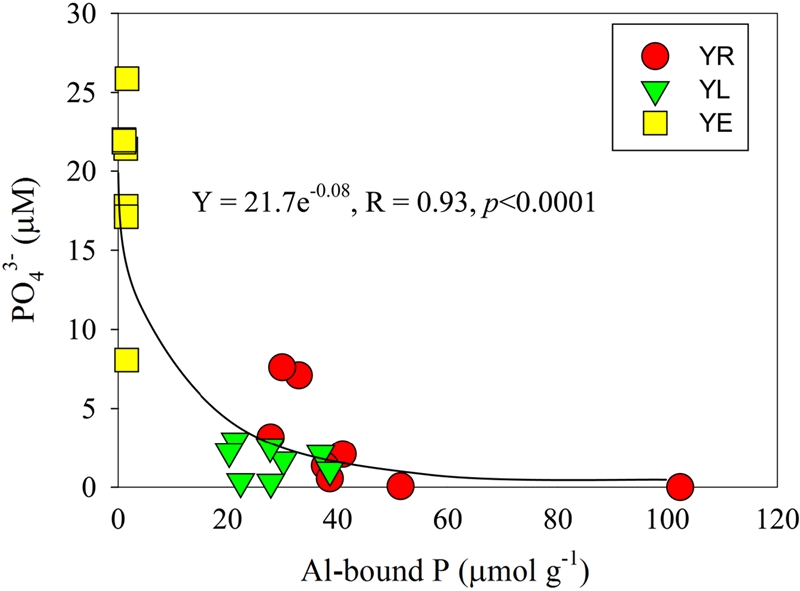
하구둑 인근 하구호 정점 YL에서 정체로 인한 빈산소 형성으로 공극수 내 NH4+와 Fe2+이 농축되었다. 반면에 영산강 정점인 YR은 3 m 이내의 낮은 수심으로 성층이 형성되지 않았고 상대적으로 표층 퇴적물로의 산소 공급이 원활하여 공극수 내 NH4+와 Fe2+가 재산화되어 낮은 농도를 보인 것으로 사료된다. 공극수 내 PO43-는 담수 정점들(YR: 0.34 mmol m-2, YL: 0.17 mmol m-2)에서 하구역(YE: 1.44 mmol m-2)보다 4~8배 이상 낮게 나타났지만, 퇴적물 내 총인은 담수 정점들(YR: 10,173 mmol m-2, YL: 6,665 mmol m-2)에서 하구역(YE: 1,000 mmol m-2)보다 6~10배 높게 나타났다(Table 2, Table 3). 일반적으로 산화환경에서 퇴적물 내 인은 철 산화물에 흡착되어 공극수 내 인의 농도가 낮아지고(Moore and Reddy[1994]), 빈산소 환경에서는 철산화물이 환원되는 과정에서 철에 결합되어 있는 인이 공극수로 해리되어 수층으로 용출되거나, 퇴적물 내 알루미늄과 결합하여 다시 퇴적물 내 축적되는 것으로 알려져 있다(Norton et al.[2008]). 본 결과에서 하구호 퇴적물의 공극수 내 인농도와 퇴적물로부터의 인 용출률은 하구역과 비교하였을 때 낮은 것으로 나타났다. 또한, 퇴적물 내 인의 존재형태 결과, 담수인 두 정점(YR, YL) 모두 알루미늄에 결합된 인의 형태가 가장 우세하였다. 이러한 결과들은 빈산소 환경 시 퇴적물 내 철 결합인에서 해리된 인이 수층으로 용출되지 않고 상대적으로 산화-환원에 영향을 받지 않는 알루미늄과 결합했기 때문으로 인식된다(Kopáček et al.[2000]; Kopáček et al.[2005]; Shim et al.[2001]). 실제로, 퇴적물 공극수 내 인의 농도와 알루미늄 결합인의 상관성 분석 결과, 통계적으로 유의하게 반비례 하는 결과를 보여(r=0.93, p<0.0001) 알루미늄 결합 인의 농도가 높을수록 공극수 내 인이 낮아지는 것으로 나타났다(Fig. 6). 따라서 하구호에서 빈산소 환경 임에도 퇴적물 공극수 내 인과 용출률이 낮았던 원인은 인이 대부분 고체상의 알루미늄과 결합되어 안정한 형태로 존재하였기 때문이다. 한편, 담수인 두 정점에서 동일하게 알루미늄에 결합된 인의 비율이 높았으나 퇴적물 내 누적된 알루미늄 결합인의 함량은 영산강 정점인 YR(6,956 mmol m-2)이 하구호 정점 YL(2,926 mmol m-2)보다 2.4배 높았으며, 철 결합인은 반대로 YL(2,333 mmol m-2)가 YR(1,515 mmol m-2)보다 더 높게 나타났다(Table 3). 영산강 정점 YR에서 알루미늄 결합 인이 더 높게 측정된 것은 주변의 삼포강, 영암천 등 육상으로부터 유입되는 알루미늄이 상대적으로 인과의 결합에 유리하게 작용한 것으로 사료된다(Kopáček et al.[2000]; Oh et al.[2005]; Diaz et al.[2006]).
하계시 하구둑에서 갑문 운영으로 인한 장기적 방류 제한으로 정체가 지속되면 수계 내 체류 시간이 길어진다. 또한 대기 복사열에 의한 표층 수온 상승으로 성층이 강화되어 표층과 저층 사이의 산소교환은 단절된다. 이러한 환경에서는 퇴적물과 저층에서의 산소소비 속도가 표층으로부터 공급되는 속도보다 빠르기 때문에 저층 빈산소 환경을 유발하고 저층에서 혐기성 유기물 분해는 더욱 촉진 될 수 있다. 이러한 결과로 하구호 퇴적물 내 암모니아성 질소의 축적이 초래된 반면, 인은 빈산소 환경임에도 불구하고 알루미늄 산화물과의 결합을 통해 퇴적물 내 저장되는 특성을 보였다. 따라서 영산강 하구호 내·외부로부터 유입되는 다량의 인은 상당부분 퇴적물에 의해 제거되는 것으로 나타나 하구호 퇴적물이 해양으로 이동되는 인을 조절하는 것으로 판단된다.
4.2 하구호와 하구역에서 인의 생지화학적 특성 변화
퇴적물 공극수 내 유기물 분해 산물인 암모니아성 질소는 하구역 정점(YE)에서 혐기성 환경이었던 담수 정점들(YR, YL)에 비해 낮게 존재하는 반면, 인은 하구역에서 하구호보다 높게 나타난 것을 확인할 수 있었다. 퇴적물의 인 존재형태를 살펴보면 하구호에서 알루미늄 결합인이 우세하였으나, 하구역에서는 철 결합인이 우세한 것으로 나타났다. 하구호는 정체시 빈산소 환경이 형성된 반면, 하구역은 조석 순환에 의해 상대적으로 산화된 환경이 유지되었다. 일반적으로 산화환경에서 퇴적물에 존재하는 인 형태는 주로 철산화물과 결합되어 존재하는 것으로 알려져 있다(Jensen et al.[1995];Filippelli and Delaney[1996]). 하구역에서 인의 형태적인 비율은 철 결합인이 우세하였지만 함량은 하구호보다 낮게 나타났다. 산화환경인 하구역 주변은 하구호의 간헐적 담수 유입 영향으로 유기물이 축적되어 분해시 산화철이 환원되면서 철과 결합되어 있던 인이 공극수로 해리되기 때문에 하구호 보다 철 결합인의 함량은 낮고 공극수 인은 높게 나타나 용출이 활발한 것으로 여겨진다(Mortimer [1941]; Holdren and Armstrong[1980]; Thouvenot-Korppoo et al.[2012]). 또한 SO42-가 풍부한 하구역에서 황산염 환원의 결과물인 HS-가 Fe(II)과 결합하여 FeS, FeS2를 형성함에 따라 상대적으로 공극수 내 인이 철과 결합하지 못하고 공극수 내 높게 존재하는 것으로 판단된다(Aller et al.[1986]; Lovely et al.[1987]; Coleman et al.[1993]; Mortimer et al.[1997], Holmer and Storkholm[2001]; Nizzoli et al.[2005]; Middelburg and Levin[2009]; An et al.[2019]). 이 연구에서도 하구역 공극수 내 Fe2+가 낮았고 인의 용출이 높게 나타났다. 따라서 하구역 퇴적물은 총인의 농도가 하구호보다 낮으나, 퇴적물 내 생지화학적인 특성으로 인해 퇴적물에서 분해된 인이 공극수로 해리되어 수층으로 용출이 활발히 일어나고 있는 것으로 사료된다(An et al.[2019]). 한편, 자생성 칼슘 결합인의 함량은 하구호와 하구역이 유사한 수준으로 나타났으나 상대적인 비율은 하구역에서 높은 것으로 나타났다. 이는 하구역에서 염분의 증가로 인해 퇴적물에서 용출되는 인이 철산화물로 흡착이 제한되어 탄산칼슘으로 이뤄진 방해석(Calcite)이 생물활동 및 침전반응을 통해인과 흡착을 형성하여 연안성 하구역에서 자생성 칼슘 결합인의 비율이 높았던 것으로 판단된다(Coelho et al.[2004]).
5. 결 론
영산강 하구호는 하구둑 운영 과정에서 간헐적 방류에 따른 장기간의 정체로 인해 빈산소 환경이 형성되었고 퇴적물 내 풍부한 인은 유기물 분해로 인해 공극수로 용출이 많이 일어날 수 있는 환경이 형성되었으나, 퇴적물에서 해리된 인이 알루미늄과 결합되어 퇴적물 내에 상당량 저장되었다. 또한 하구역은 퇴적물 내 인이 적음에도 불구하고 퇴적물 내 철과 황의 결합이 우선적으로 일어나 퇴적물에서 분해된 인이 공극수를 통하여 용출이 활발하게 일어나고 있었다. 이러한 인 용출 증가는 하구역에서 퇴적물이 인의 주요 공급원이 될 수 있음을 시사한다. 이 연구는 하구 생태계 내 인의 순환을 규명하는 연구 결과로써 국내 하구 생태계 보전을 위한 기초 자료로 활용될 수 있으며 하구둑이 건설되어져 있는 연안환경에서 계속적인 용출 모니터링이 필요하다.
Acknowledgments
이 연구는 환경부 ‘보 퇴적환경 변화에 따른 퇴적물 수질영향 연구’의 일환으로 수행되었습니다.
References
-
Aller, R.C., Macklin, J.E. and Cox, R.T.J., 1986. Diagenesis of Fe and S in Amazon inner shelf muds: apparent dominance of Fe reduction and implications for genesis of ironstones. Cont. Shelf Res., 6, 263-289.
[https://doi.org/10.1016/0278-4343(86)90064-6]

- An, S.U., 2013. Environmental impact of artificial dyke on the sediment geochemistry and organic matter mineralization in the sediments of Yeongsan river estuary, M.S. thesis, Hanyang University, Ansan, South Korea.
-
An, S.U., Mok, J.S., Kim, S.H., Choi, J.H., Hyun, J.H., 2019. A large artificial dyke greatly alters partitioning of sulfate and iron reduction and resultant phosphorus dynamics in sediments of the Yeongsan River estuary, Yellow Sea. Sci. Total. Envir., 665, 752-761.
[https://doi.org/10.1016/j.scitotenv.2019.02.058]

-
Anschutz, P. and Deborde, J., 2016. Spectrophotometric determination of phosphate in matrices from sequential leaching of sediments. Limnol. Oceanogr.: Methods., 14, 245-256.
[https://doi.org/10.1002/lom3.10085]

-
Berner, R.A., 1980. Early Diagenesis: A theoretical approach. Princeton University Press, 241.
[https://doi.org/10.1515/9780691209401]

- Boudreau, B.P., 1997. Diagenetic Models and their Implementation: Modelling Transport and Reactions in Aquatic Sediment, fisrt ed. Springer-Verlag, New York, USA,
-
Boynton, W.R., Kemp, W.M., 1985. Nutrient regeneration and oxygen consumption by sedimets along an estuarine salinity gradient. Mar. Ecol. Prog. Ser., 23, 45-55.
[https://doi.org/10.3354/meps023045]

-
Bulleid, N.C., 1984. Deoxygenation and remineraization above the sediments-water interface; an in situ experimental study. Estuar. Coast. Shelf Sci., 19, 15-25.
[https://doi.org/10.1016/0272-7714(84)90050-7]

-
Byun, D.S., Wang, X.H., Holloway, P.E., 2004. Tidal characteristic adjustment due to dyke and seawall construction in the Mokpo. Estuar. Coast. Shelf Sci., 59, 185-196.
[https://doi.org/10.1016/j.ecss.2003.08.007]

- Canfield, D.E., Thamdrup, B., Kristensen, E. (Eds.), 2005. Aquatic geomicrobiology. Elsevier, San Diego, 640.
-
Carpenter, J.H., 1965. The accuracy of the Winkler method for dissolved oxygen analysis. Limnol. Oceanor., 10, 135-140.
[https://doi.org/10.4319/lo.1965.10.1.0135]

-
Coelho, J.P., Flindt, M.R., Jensen, H.S., Lillebø, A.I. and Pardal, M.A., 2004. Phosphorus speciation and availability in intertidal sediments of a temperate estuary: relation to eutrophication and annual P-fluxs. Estuar. Coast. Shelf Sci., 61, 583-590.
[https://doi.org/10.1016/j.ecss.2004.07.001]

-
Coleman, M.L., Hedrick, D.B., Lovely, D.R., White, D.C., and Pye, K., 1993. Reduction of Fe(III) in sediments by sulphate-reducing bacteria. Nature, 361, 436-438.
[https://doi.org/10.1038/361436a0]

-
Diaz, O.A., Daroub, S.H., Stuck, J.D., Clark, M.W., Lang, T.A. and Reddy, K.R., 2006. Sediment inventory and phosphorus fractions for water conservation area canals in the Everglades. Soil. Sci. Soc. Am. J., 70, 863-871.
[https://doi.org/10.2136/sssaj2005.0059]

- Diaz, R.J. and Rosenberg, R., 1995. Marrine benthic hypoxia: a review of its ecological effects and the behavioural responses of benthic macrofauna. Oceanogr. Mar. Biol., 33, 245-303.
-
Filippelli, G.M. and Delaney, M.L. 1996. Phosphorus geochemistry of equatorial pacific sediments. Geochim. Cosmochim. Acta, 60, 1479-1495.
[https://doi.org/10.1016/0016-7037(96)00042-7]

-
Giles, H., Pilditch, C.A., Bell, D.G., 2006. Sedimentation form mussel (Perna canaliculus) culture in the Firth of Thames, New Zealand: impacts on sediment oxygen and nutrient fluxes. Aquaculture, 261, 125-140.
[https://doi.org/10.1016/j.aquaculture.2006.06.048]

-
Han, M.W., Park, Y.C., 1999. The development of anoxia in the artificial lake Shihwa, Korea, as a consequence of intertidal reclamation. Mar. Poll. Bull., 38, 1194-1999.
[https://doi.org/10.1016/S0025-326X(99)00161-7]

-
Hartzell., J.L. and Jordan, T.E., 2012. Shift in the relative availability of phosphorus and nitrogen along estuarine salinity gradient. Biogeochem., 107, 489-500.
[https://doi.org/10.1007/s10533-010-9548-9]

-
Heo, N.W., Lee, J.Y., Choi, J.U., An, S.M., 2011. Nitrogen removal via sediment denitrification and its seasonal variations in major estuaries of south coast of Korean peninsula. J. Korean Soc. Oceanogr., 16, 81-96.
[https://doi.org/10.7850/jkso.2011.16.2.081]

-
Hewson, I. and Fuhrman, J.A., 2004. Richness and diversity of bacterioplankton species along an estuarine gradient in Moreton bay, Australia. Environ. Microbiol., 70(6), 3425.
[https://doi.org/10.1128/AEM.70.6.3425-3433.2004]

-
Holdren, G.C. and Armstrong, D.E., 1980. Factors affectiong phosphorus release from intact lake sediment cores. Environ. Sci. Technol., 14, 79-87.
[https://doi.org/10.1021/es60161a014]

-
Holmer, M. and Storkholm, P., 2001. Sulphate reduction and sulphur cycling in lake sediment; a review. Freshw. biol., 46, 431- 451.
[https://doi.org/10.1046/j.1365-2427.2001.00687.x]

-
Hopkinson, C.S., Giblin, A.E., Tucker, J., 2001. Benthic metabolism and nutrient regeneration on the continental shelf of eastern Massachusetts, USA. ar. Ecol. Prog. Ser., 224, 1-19.
[https://doi.org/10.3354/meps224001]

- Jahidul, M. I., Kim B.C., Han, J.S., Kim, J.K., Jung, Y.K., Jung, S.M., Shin, M.S. and Park, J.H., 2008. Organic phosphorus decomposition rates in the Youngsan river and the Sumjin river, Korea. J. Korean Soc. Water Qual., 24(3), 354-364.
-
Jensen, H.S. and Thamdrup, B., 1993. Iron-bound phosphorus in marine sediments as measured by bicarbonate-dithionite extraction. Hydrobiologia, 253, 47-59.
[https://doi.org/10.1007/978-94-011-1598-8_4]

-
Jensen, H.S., P.B. Mortensen, F.ø. Andersen, E. Rasmussen and A. Jensen. 1995. Phosphorus cycling in a coastal marine sediment, Aarhus Bay, Denmark. Limnol. Oceanogr., 40, 908-917.
[https://doi.org/10.4319/lo.1995.40.5.0908]

-
Jensen, H.S., McGlathery K.J., Marino, R. and Howarth R.W., 1998. Forms and availability of sediment phosphorus in carbonate sand of Bermuda seagrass beds. Limnol. Oceanogr., 43(5), 799-810.
[https://doi.org/10.4319/lo.1998.43.5.0799]

-
Jung, K.W., C.G. Yoon, I.H. Lee, S.I. Lee, S.M. Kang and J.H. Ham, 2014. Pollutants release from sediments in estuarine reservoir. Kor. J. Soc. Agricultural Eng., 56(1), 1-9.
[https://doi.org/10.5389/KSAE.2014.56.1.001]

-
Kamarainen, A. M., R.M. Penczykowski, M.C. Vande Bogert, P.C. Hanson and S.R. Carpenter, 2009. Phosphorus sources and demand during summer in a eutrophic lake. Aquat. Sci., 71, 214-227.
[https://doi.org/10.1007/s00027-009-9165-7]

-
Kang, J.W., 1999. Changes in tidal characteristics as a result of the construction of sea-dyke/sea-walls in the Mokpo coastal zone in Korea. Estuar. Coast. Shelf Sci., 48, 429-438.
[https://doi.org/10.1006/ecss.1998.0464]

- Kemp, W.M., Boynton, W.R., 1984. Spatial and temporal coupling of nutrient inputs to estuarine primary production. Bull. Mar. Sci., 35, 522-535.
- Kim, J.H., B.C. Kim, M.S. Shin, J.K. Kim, S.M. Jung, Y.K. Lee and J.H. Park, 2009. The distribution of nitrogen and the decomposition rate of organic nitrogen in the Youngsan river and Sumjin river, Korea. Kor. J. Soc. Water Quality., 25, 142-150.
-
Kim, S.H., Lee, J.S., Hyun, J.H., 2017. Extremely high sulfate reduction, sediment oxygen demand and benthic nutrient flux associated with a large-scale artificial dyke and its implication to benthic-pelagic coupling in the Yeongsan River estuary, Yellow Sea. Mar. Pollut. Bull., 120, 126-135.
[https://doi.org/10.1016/j.marpolbul.2017.04.047]

-
Kim, T.I., Choi, B.H., Lee, S.W., 2006. Hydrodynamics and sedimentation induced by large-scale coastal developments in the Keum Estuary, Korea. Estuar. Coast. Shelf Sci., 68, 515-528.
[https://doi.org/10.1016/j.ecss.2006.03.003]

-
Kopáček, J., Hejzlar, J., Borovec, J., Porcal, P., Kotorová, I., 2000. Phosphorus inactivation by aluminum in the water column and sediment: Lowering of in lake phosphorus availability in an acidified watershed lake ecosystem. Limnol. Oceanogr., 45, 212-225.
[https://doi.org/10.4319/lo.2000.45.1.0212]

-
Kopáček, J., Borovec, J., Hejzlar, J., Ulrich, K.U., Norton, S., Amirbahman, A., 2005. Aluminum control of phosphorus sorption by lake sediments. Eviron. Sci, Technol., 39, 8784-8789.
[https://doi.org/10.1021/es050916b]

-
Kraal, P. and Slomp, C.P., 2014. Rapid and extensive alteration of phosphorus speciation during oxic storage of wet sediment samples. PLOS ONE, 9(5), e96859.
[https://doi.org/10.1371/journal.pone.0096859]

-
Kraal, P., Burton, E.D., Rose, A.L., Kocar, B.D., Lockhart, R.S., Grice, K., Bush, R.T., Tan, E., Webb, S.M., 2015. Sedimentary iron-phosphorus cycling under contrasting redox conditions in a eutrophic estuary. Chem. Geol., 392, 19-31.
[https://doi.org/10.1016/j.chemgeo.2014.11.006]

-
Lawrence, W., Dagg, M.J., Liu, H., Cummings, S.R., Ortner, P.B., Kelble, C., 2004. Wind events and benthic-pelagic coupling in a shallow subtropical bay in Florida. Mar. Ecol. Prog. Ser., 266, 1-13.
[https://doi.org/10.3354/meps266001]

- Lee, J.S., Park, M.O., An, S.M., Kim, S.G., Kim, S.S., Jung, R.H., Park, J.S., Jin, H.G., 2007. Biogeochemical organic carbon cycles in the intertidal sandy sediment of Nakdong estuary. J. Korean Soc. Oceanogr., 12, 349-358.
- Lee, Y.J., J.O. Min, Y.S. Shin, S.H. Kim and K.H. Shin, 2011. Temporal and spatial variations of primary productivity in estuary of Youngsan river and Mokpo coastal areas. Kor. J. Soc. Limnology, 44(4), 327-336.
-
Li, Y.H., Gregory, S., 1974. Diffusion of ions in sea water and in deep-sea sediment. Geochim. Cosmochim. Acta, 38, 708-714.
[https://doi.org/10.1016/0016-7037(74)90145-8]

- Lim, B.M., Ki, B.M., Choi, J.H., 2009. A study on the biogeochemistry of the sediments in the Han river estuary. J. Korean Soc. Environ. Eng., 31, 839-844.
-
Lovely, D.R., Stolz, J.F., Nord, G.L.Jr. and Phillips, E.J.P., 1987. Anaerobic production of magnetite by a dissimilatory ironreducing microorganism. Nature, 330, 252-254.
[https://doi.org/10.1038/330252a0]

- Manatunge, J., Priyadarshana, T., Nakayama, M., 2008. Environmental and social impacts of reservoirs: issus and mitigation. Ocean and Aquatic Ecosystems, 1, 212-255.
-
Meyer-Reil L-A and Kӧster M., 2000. Eutrophication of marine water: effects on benthic microbial communities. Mar. Poll. Bull., 41, 255-263.
[https://doi.org/10.1016/S0025-326X(00)00114-4]

-
Michalak A.M., E.J. Anderson, D. Beletsky, S. Boland, N.S. Bosch, T.B. Bridgeman, J.D. Chaffin, K. Cho, R. Confesor, I. Daloglu, J.V. DePinto, M.A. Evans, G.L. Fahnenstiel, L. He, J.C. Ho, L. Jenkins, T.H. Johengen, K.C. Kuo, E. LaPorte, X. Liu, M.R. McWilliams, M.R. Moore, D.J. Posselt, R.P. Richards, D. Scavia, A.L. Steiner, E. Verhamme, D.M. Wright and M.A. Zagorski., 2013. Record-setting algal bloom in Lake Erie caused by agricultural and meteorological trends consistent with expected future conditions. Proc. Natl. Acad. Sci. USA., 110, 6448-6452.
[https://doi.org/10.1073/pnas.1216006110]

-
Middelburg, J.J. and Levin, L.A., 2009. Coastal hypoxia and sediment biogeochemistry. Biogeosciences, 6, 1273-1293.
[https://doi.org/10.5194/bg-6-1273-2009]

-
Min, J.-E., Ryu, J.-H., Lee, S., Son, S., 2012. Monitoring of suspended sediment variation using Landsat and MODIS in the Saemangeum coastal area of Korea. Mar. Poll. Bull., 64, 382-390.
[https://doi.org/10.1016/j.marpolbul.2011.10.025]

- MOLIT(Ministry of Land, Infrastructure and Transport), Yeongsan River flood control office, http://www.yeongsanriver.go.kr/, 2012.
- Moon, M.H., 1990. A variation on the marine environments in the Yeongsan river estuary, M.S. thesis, Chosun Univ., Gwangju, South Korea.
-
Moore, P.A. and Reddy, K.R., 1994. Role of Eh and pH phosphorus geochemistry in sediment of lake Okeechobee, Florida. J. Environ. Qual., 23, 955-964.
[https://doi.org/10.2134/jeq1994.00472425002300050016x]

-
Mortimer, C.H., 1941. The exchange of dissolved substances between mud and water in lakes: I and II. J. Ecol., 29, 280-329.
[https://doi.org/10.2307/2256395]

-
Mortimer, R.J.G., Coleman, M.L., and Rae. J.E., 1997. Effect of bacteria on the trace element composition of early diagenetic siderite: implications for palaeoenvironmental interpretations. Sedimentology, 44, 759-765.
[https://doi.org/10.1046/j.1365-3091.1997.d01-45.x]

-
Nizzoli, D., Welsh, D.T., Bartoli, M. and Viaroli, P., 2005. Impacts of mussel(Mytilus galloprovincialis) farming on oxygen consumption and nutrient recycling in a eutrophic coastal lagoon. Hydrobiologia, 550, 183-198.
[https://doi.org/10.1007/s10750-005-4378-9]

-
Norton, S.A., Coolidge, K., Amirbahman, A., Bounchard, R., Kopáček, J. and Reinhardt, R., 2008. Speciation of Al, Fe, and P in recent sediment from three lakes in Maine, USA. Sci. Total Environ., 404, 276-283.
[https://doi.org/10.1016/j.scitotenv.2008.03.016]

- Oh, K.H., J.Y. Kim, Y.K. Koh, S.T. Yoon, G.W. Seo, B.Y. Park, S.E. Shin and H.G. Kim, 2005. Geochemical characteristics and contamination of surface sediments in upper Yeongsan river system. Kor. J. Soc. Water Quality, 21(5), 520-527.
- Park, L.H., Y.K. Cho, C. Cho, Y.J. Sun and K.Y. Park, 2001. Hydrography and circulation in the Youngsan river estuary in summer, 2000. Kor, J. Soc. Oceanogr., 6, 218-224.
- Parsons, T.R., Maita, Y. and Lalli, C.M., 1984. A manaul of chemical and biological methods for seawater analysis, Pergamon press, 173.
-
Paytan, A. and Mclaughlin, K., 2007. The oceanic phosphorus cycle. Chem. Rev., 107, 563-576.
[https://doi.org/10.1021/cr0503613]

-
Portnoy, J.W., Giblin, A.E., 1997. Effects of historic tidal restrictions on salt marsh sediment chemistry. Biogeochem., 36, 275-303.
[https://doi.org/10.1023/A:1005715520988]

-
Ruttenberg, K. C., 2003. The global phosphorus cycle. Treatise on Geochemistry. Elsevier, 8, 585-643.
[https://doi.org/10.1016/B0-08-043751-6/08153-6]

-
Rockström, R., Falkenmark, M., Karlberg, L., Hoff, H., Rost, S., Gerten, D., 2009. Future water availability for global food production: the potential of green water for increasing resilience to global change. Water Resour. Res., 45, W00A12.
[https://doi.org/10.1029/2007WR006767]

-
Rozan, T.F., Taillefert, M., Trouwborst, R.E., Glazer, B.T., Ma, S.F., Herszage, J., Valdes, L.M., Price, K.S., and Luther, G.W., 2002. Iron-sulphur-phosphorus cycling in the sediments of a shallow coastal bay: Implications for sediment nutrient release and benthic macroalgal blooms, Limnol. Oceanogr., 47, 1346-1354.
[https://doi.org/10.4319/lo.2002.47.5.1346]

-
Schindler, DW., 1974. Eutrophication and recovery in experimental lake: Implications for lake management. Science, 184, 897-899.
[https://doi.org/10.1126/science.184.4139.897]

-
Schulz, H.D., 2006. Quantification of early diagenesis: Dissolved constituents in pore water and signals in the solid phase. In: Schulz, H.D., Zabel, M.(eds) Marine geochemistry. Springer, New York, 73-124.
[https://doi.org/10.1007/3-540-32144-6_3]

- Shim, M.J., S.R. Cho, K.T. Na, J.S. Shin and E.S. Kim, 2001. The geochemical properties of phosphorus from sediments of lake Shihwa. Kor, J. Soc. Mar. Environ. Eng., 4(3), 16-27.
-
Slomp, C.P., 2011. Phosphorus cycling in the estuarine and coastal zone: Sources, sinks, and transformations. Treatise on estuarine and coastal science, 5, 201-229.
[https://doi.org/10.1016/B978-0-12-374711-2.00506-4]

-
Slomp, C.P., Mort, H.P., Jilbert, T., Reed, D.C., Gustafsson, B.G. and Wolthers, M., 2013. Coupled dynamics of iron and phosphorus in sediments of an oligotrophic coastal basin and the impact of anaerobic oxidation of methane. PLOS ONE.
[https://doi.org/10.1371/journal.pone.0062386]

-
Stookey, L.L., 1970. Ferrozine-A new spectrophotometric reagent for iron. Anal. Chem., 42(7), 779-781.
[https://doi.org/10.1021/ac60289a016]

- Thouvenot-Korppoo, M., Lukkari, K., Jarvela, J., Leivuori, M., Karvonen, T. and Stipa, T., 2012. Phosphorus release and sediment geochemistry in a low-salinity water bay of the Gulf of Finland. Boreal Environ. Res., 17, 237-251.
-
Tyrrell, T., 1999. The relative influences of nitrogen and phosphorus on oceanic primary production. Nature, 400, 525-531.
[https://doi.org/10.1038/22941]

-
Yoon, B.B., E.J. Lee, T.A. Kang and Y.S. Shin, 2013. Long-term change of phytoplankton biomass (chlorophyll-a), environmental factors and freshwater discharge in Youngsan estuary. Kor. J. Soc. Limnology, 46(2), 205-214.
[https://doi.org/10.11614/KSL.2013.46.2.205]

- Youn, S.T., Y.K. Koh, K.H. Oh, B.C. Moon and H.G. Kim, 2003. Water quality assesment of the lower Yeongsan river system. Korea. Environmental Impact Assessment, 12, 259-270.