생물검정법을 통한 부유사의 해양생물 영향평가
초록
인간 활동으로 발생하는 부유사로 인해 생태계 및 일부 어족의 어업피해가 발생하고 있다는 의견들이 제시되어왔다. 부유사의 발생량 및 수층 부유사 농도 등 수치의 비교만으로 상호 간에 직접적인 인과관계를 파악하기는 쉽지 않다. 부유사로 인한 국내 유용 어족자원인 붕장어(Astroconger myriaster), 흰다리새우(Litopenaeus vannamei) 그리고 넙치(Paralichthys olivaceus) 3 종의 영향을 생물검정법으로 평가하였고 넙치의 발생단계별 민감도를 평가하였다. 붕장어는 노출 4 일째부터 사망이 관찰되었고 6d-LC50은 62,335 mg/L, 7d-LC50은 54,838 mg/L 이었다. 흰다리새우는 부유사 농도가 약 47,152 ± 1691 mg/L 이상에서 최소 5일 이상 노출되었을 때 생존에 영향이 있었고 넙치 치어는 부유사 농도 약 18,185 ± 926 mg/L 이상에서 최소 6 일 이상 노출되었을 때 생존에 영향을 받았다. 그리고 부유사 농도 4,763 ± 76 mg/L까지는 넙치 수정란 부화율에 영향을 미치지 않았다. 하지만 부화에는 영향이 없었으나 형태적 기형이 관찰되었다. 넙치 부화자어는 부유사 농도 100.9 ± 2.6 mg/L에 1 일간 노출시 사망한 개체가 관찰되었다. 반수치사농도를 추정한 결과, 4d-LC50은 99.4 mg/L이었다. 어류인 붕장어나 넙치보다 갑각류인 흰다리새우의 부유사 내성이 더 강함을 확인하였다. 문헌조사에서도 생물들은 높은 농도의 부유사 환경에서도 90% 이상의 생존율을 보여 전반적인 부유사 내성이 강함을 알 수 있었다. 그러나 부화 직후 넙치 자어는 비교적 낮은 부유사 농도 조건에서 영향을 확인하였다. 서식지 주변, 산란기 부유사는 생존에 직접적인 영향을 줄 수 있어, 산란기에 행해지는 부유사 유발 행위는 해역에서 산란하는 어족의 개체군 변동에 영향을 미칠 수 있을 것으로 예상된다.
Abstract
It has been suggested that the suspended sediment in water column resulting from human activities is causing damage to the ecosystem and particluar species of fish. It is not easy to identify a direct causal relationship between impacts of organisms and suspended sediment just by comparing the amount of suspended sediment generated or the suspended sediment concentration. The impact on conger(Astroconger myriaster), whiteleg shrimp (Litopenaeus vannamei) and olive flounder(Paralichthys olivaceus), that are considered as a useful resource in Korea, due to suspended sediment were evaluated by bioassays. Sensitivity of olive flounder by stage of occurrence was also evaluated. Mortality of conger was observed on 4-day exposure at the suspended sediment concentration of 46,752 mg/L. Estimated the median lethal concentration, 6d-LC50 and 7d-LC50 were 62,335 mg/L and 54,838 mg/L respectively. Whiteleg shrimps had an effect on survival when exposed for at least 5 days at a suspended sediment concentration of about 47,152 ± 1691 mg/L or higher, where olive flounders had an effect on survival when exposed for at least 6 days at a suspended sediment concentration of about 18,185 ± 926 mg/L or higher. The suspended sediment concentration until 4,763 ± 76 mg/L did not affect the flounder embryo hatching rate. Although, there was no effect on hatching, but morphological deformities were observed. Mortality of olive flounder fry was observed at a suspended sediment concentration of 100.9 ± 2.6 mg/L with a single day exposure. After estimating the median lethal concentration, 4d-LC50 was 99.4 mg/L. It was confirmed that the suspended sediment tolerance of the crustacean such as whiteleg shrimp was stronger than that of the fish such as conger and olive flounder. Other researches also showed that organisms had a survival rate of more than 90% even in high concentrations of suspended sediment, indicating that overall tolerance to suspended sediment is strong. However, lethality under relatively low suspended sediment concentration conditions was observed for olive flounders that had been just hatched. Suspended sediment around the habitat can have a direct impact on survival, which is expected to have an effect on the change in fish populations during spawning season.
Keywords:
Suspended sediment, Bioassay, Astroconger myriaster, Litopenaeus vannamei, Paralichthys olivaceus키워드:
부유사, 생물검정, 붕장어, 흰다리새우, 넙치1. 서 론
생물검정이란 어떠한 물질(비 생물적 요인)이 살아있는 생물에게 미치는 악영향을 직접적으로 알아보기 위한 실험을 의미한다. 따라서, 환경오염 혹은 생태계 교란을 일으키는 원인물질에 관한 정량적 정보만으로는 예측할 수 없는 직접적인 결과를 측정할 수 있으며, 생태계 군집 조사와 같이 오염 및 영향의 최종 결과만으로써는 추정하기 어려운 원인물질과의 인과관계를 알아낼 수 있다는 장점이 있다. 어떠한 요인으로 생물에 영향을 미쳐 생태계의 변형이 관찰되는 현장에서 둘 사이의 관계를 파악하고, 향후 추이를 예측하고자 한다면 생물검정이 필요하다.
부유사는 수체로 운반되는 작은 입자(일반적으로 63-μm 이하 입경의 실트와 점토)의 부유물을 말한다(Waters[1995]; Garcia[2008]). 퇴적물의 부하는 인위적인 활동(선박, 항만 정비 및 건설, 도로건설 광업, 개발 등)과 직접적인 관련이 있고 기타 강우, 기우 기상 등과 간접적인 관련이 있다. 해안 및 해양에서 매립, 준설, 골재 채취 등 사업은 해양환경에 직접적이며 다양한 영향을 미칠 수 있다. 부유사는 대표적인 영향 원인 중 하나이다(Maeng et al.[2006]; Kim et al.[2014]). 발생하는 부유사로 인하여 생태계 및 일부 어족의 어업피해가 발생하고 있다는 의견들이 제시되어왔다. 부유사의 발생량 혹은 해수 중에서 농도는 측정 가능하고, 어족자원의 변화 또한 자료를 통하여 얻을 수 있으나, 단지 수치의 비교만으로 이들 간에 직접적인 인과관계를 파악하기는 쉽지 않다(U.S. ACE, [2015]). 어류가 부유사에 노출되면 적극적으로 회피할 수 있으며 민감도는 종마다 유전적 차이로 인해 다르고 상대적으로 덜 민감한 발달 단계(자어, 치어 성어 등)에 노출되면 영향은 과소평가될 수 있다(Mohammed, [2013]).
부유사 연구는 1930-40년대 실험실 또는 특수하게 제작한 챔버를 이용한 현장실험(Ellis[1931]; Ellis[1936]; Ellis[1944]; Moore[1937]; Moore[1944])을 시작으로, 1950-60년대에는 아주 제한된 현장 연구를 통한 탁도와 어류 개체군과의 관계 연구 등 생태학적 접근이 시도되었다(Moore[1950]; Hambric[1953]; Cordone and Kelly[1961]). 1970년대에 들어 준설, 해안침식의 영향에 대한 새로운 관심의 결과로 일부 생물검정과 현장 연구가 진행되었다(Gammon[1970]; Froshage and Carter[1974]; Doudoroff[1976]; Morton[1977]; Forester and Lawrence[1978]). 부유사의 일반적인 생태 영향으로 1차 생산력 연구(Irwin and Stevenson[1951]; Claffey[1955]; Toetz[1967]; Iwamoto et al.[1978]), 영양염류 관계 연구(Toetz[1967]; Beaumont[1975]; Kelley et al.[1976]; Jones and Bachmann[1978]), 어류의 먹이생물에 대한 영향 연구(Toetz[1966]; Winner[1975]; Doudoroff[1976]) 그리고 어류의 생식 관련하여 생식소 발달 연구(June[1977]; Schwassmann[1971]; Peters and Hontela[1978]; Schreck and Scanlon[1977]) 등이 진행되었지만 생태적 영향을 유추하는 수준에서의 연구로 생태적 반응의 직접적인 근거를 제시하지 못하였다. 이후 하천이나 호소 중심의 부유사 연구는 해양 및 해안 이용도가 높아짐에 따라 해양생물의 생물검정을 통한 생리 생태연구로 점차 확대되었다.
최근 부유사로 인한 어류 아가미 구조의 변화와 기능의 손상 연구에서도 시험한 3종의 어류 모두 노출 중 산소 흡수가 저하되어 산소 소비율은 모두 증가하였지만 노출 중단 후 종에 따라 가역 또는 비가역적인 반응을 나타낸 결과를 보고하였다(Hess et al.[2017]). 오염원이 없는 지역 서식 어류를 대상으로 하였고, 이처럼 한 서식지 내에서 같은 농도의 부유사에 노출되더라도 대사 기능을 유지할 수 있는 종들이 있고 상대적으로 취약한 종들이 존재함을 확인하였다.
본 연구에서는 인위적으로 부유사가 발생하였을 때 해양 생물에게 어떠한 직접적 영향을 주는가를 파악하고자 국내 서식 생물 3종을 이용한 생물검정법을 적용하여 평가하고 평가 결과와 기존 연구의 결과들을 종합하여 부유사가 해양생물에 미치는 영향을 평가하였다. 3종 중 붕장어는 성체, 흰다리새우는 치하를 대상으로 하였다. 일반적으로 수생생물의 생활사 중 발달(발생) 초기 단계가 성체보다 더 민감하다고 알려져 있다(Middaugh and Dean,[1977]; Ringwood[1990]; Schmieder et al.[2000]; Mohammed et al.[2009]; Mohammed[2013]). 흰다리새우의 발생 실험은 연중 산란기를 제외한 다른 기간의 적용은 제한적이며 붕장어는 생식 관련 연구가 진행중에 있어 생식제어가 초기 단계로, 시험의 적용은 불가능하다. 그 이유는 수정란을 확보하여 시험한다고 해도 물리적 조건이나 환경적인 요인으로 영향을 받았는지, 노출로 인한 영향인지 구분할 수 없기 때문이다. 그러나 넙치는 연중 수정란을 구할 수 있어 시험 기간에 제약이 없으며 초기생활사 단계에 대한 시험법이 제안되어있는 넙치를 대상으로 발생 초기 단계의 영향을 평가하였다(Kim et al.[2010]; Whang et al.[2012]; Sung[2020]).
부유물질은 크게 무기물과 유기물 두 가지 일반 유형으로 나눌 수 있으며 유기성 부유물질은 생분해성이며 입자 크기 기원물질 양 등에 따라 달라진다(Wood[1997]). 무기성 물질은 광물 조성, 입자 모양이나 크기 분급 등으로 상세 구분된다(Nichols[1999]; Beussink[2007]). 본 연구에서는 유기성 부분을 제거한 무기성 물질부만을 시험에 적용하여 유기성 물질로 인한 수질의 변화나 유기 독성물질을 제어하였다.
2. 재료 및 방법
2.1 시험생물의 선정
부유사가 해양 생물에게 미치는 영향을 알아보기 위한 실험의 대상 생물로 붕장어(Astroconger myriaster), 흰다리새우(Litopenaeus vannamei) 및 넙치(Paralichthys olivaceus)를 선정하였다. 붕장어는 국내 배타적 경제수역 내 서식하는 아주 중요한 수산자원이며, 새우류는 붕장어의 주요 먹이생물이다. 넙치는 초기생활사의 개체를 손쉽게 구할 수 있으므로 어린 개체에 관한 영향을 알아보기 위한 좋은 모델생물이다. 붕장어는 성체를 실험에 사용하였으며, 흰다리새우는 붕장어의 먹이 크기 정도인 어린 개체를, 그리고 넙치는 수정란, 부화자어, 치어 등 생활사의 초기 3단계에 해당하는 개체를 대상으로 실험에 사용하였다.
2.2 부유사의 준비
퇴적물은 남해안 배타적 경제수역 내 대륙붕에서 채취하여 실험에 사용하였다. 채취된 퇴적물은 전기로에서 완전히 태워 유기물을 제거한 다음 순수 실트 및 점토 크기의 입자(<62 μm)만을 이용하여 실험에 사용하였다.
시험구의 부유사 농도는 해양환경공정시험기준(Ministry of Oceans and Fisheries[2018]) 제4장의 제5항 부유 입자 물질(SPM: Suspended Particulate Matter) 측정 방법에 따라 측정하였다. 고농도의 시료는 희석 측정한 후 희석배수를 곱하여 농도를 계산하였다.
2.3 붕장어 생존율 측정 실험
실험에 사용된 붕장어는 경남 통영의 활어 도매상으로부터 구하였다. 붕장어를 실험실로 옮긴 후 순치 수조 주변 사람의 움직임에 반응하지 않고 먹이 반응이 있을 때까지 최소 3 일간 실험실 조건에 순치시켰다. 이후 외상이 전혀 없고 움직임이 가장 활발한 개체만을 선별하여 실험에 이용하였다. 부유사가 붕장어의 생존에 미치는 영향을 평가하기 위한 7 일 노출 평균 농도는 0, 10 ± 0.4, 49.2 ± 2.1, 97.3 ± 1.7, 246.9 ± 3.7, 288.2 ± 8.2, 487.3 ± 14.9, 986.4 ± 14.1, 2448 ± 48, 4806 ± 209, 9496 ± 289, 18398 ± 877, 47808 ± 1670 그리고 90930 ± 3549 mg/L (총 14 농도 단계) 이었다(Table 1). 100-L 용량의 수조에 농도별로 희석한 부유사 용액 30 L를 주입하고, 각 처리구별로 붕장어 성체(길이 42.5 ± 4.8 cm, 무게 111.0 ± 37.7 g)를 10 마리씩 투입하였다. 퇴적물의 부유 상태 유지를 위하여 기포 발생기로 해수를 격렬하게 순환시켰다. 실험이 시작된 후 매 24 시간 생존 개체 수를 확인, 기록하였으며, 총 7 일간 노출하였다. 실험은 온도가 18oC로 유지되는 항온 배양실에서 실시하였으며, 실험에 사용된 해수의 염분은 32 psu 이었다. 부유사 노출 실험 중 먹이는 공급하지 않았으며, 실험용 해수는 매일 전량 교체하였다. 교체 전순환되는 시료를 일부 취하여 부유사의 농도를 측정하였다.
실험에 사용한 퇴적물은 유기물이 포함되지 않은 것으로 환경에서 관찰할 수 있는 퇴적물로 인한 용존산소 농도의 감소는 확인되지 않았으며 부유 농도 유지를 위해 기포 발생장치를 사용하였고 매일 시험수를 교환하여 용존산소로 인한 영향을 제어하였다. 실험 종료 시 용존산소 농도는 8.72-8.94 mg/L 범위이었다.
2.4 흰다리새우 생존율 측정 실험
실험에 사용된 흰다리새우는 충남 태안의 양식장에서 구하였다. 흰다리새우를 실험실로 옮긴 후 최소 2 일간 실험실 조건에 순치시켰고, 탁색과 외상이 없고 움직임이 활발한 개체를 선별하여 실험에 이용하였다. 부유사가 흰다리새우의 생존에 미치는 영향을 평가하기 위한 7 일 노출 평균 농도는 0, 10.4 ± 0.5, 49.2 ± 1.9, 98.2 ± 1.7, 248.7±7.5, 288.3±6.5, 489.4±9.0, 979.1±11.1, 2420±46, 4829±207, 9697 ± 247, 18352 ± 862, 47152 ± 1691 그리고 90306 ± 2967 mg/L (총 14 농도 단계) 이었다(Table 2). 4-L 용량의 수조에 농도별로 희석한 부유사 용액 2 L를 주입하고, 각 처리구별로 흰다리새우(길이 4.10 ± 0.24 cm, 무게 0.415 ± 0.043 g)를 10 마리씩 투입하였다. 퇴적물의 부유 상태 유지 및 시험 방법은 붕장어의 방식과 같게 수행하였다.
2.5 넙치 치어의 생존율 측정 실험
실험에 사용된 넙치 치어는 경남 거제의 종묘배양장에서 구하였다. 넙치 치어를 실험실로 옮긴 후 최소 3일간 실험실 조건에 순치시켰고, 육안으로 보았을 때 외상이 전혀 없고 움직임이 가장 활발한 개체만을 선택하여 실험에 이용하였다. 부유사가 넙치 치어의 생존에 미치는 영향을 평가하기 위한 7일 노출 평균 농도는 0, 10.2 ± 0.5, 30.9 ± 1.4, 48.9 ± 1.8, 100.2 ± 2.8, 291.6 ± 9.9, 490.8 ± 12, 976.1 ± 22, 2404 ± 34, 4770 ± 161, 9730 ± 151, 18185 ± 926, 47298 ± 851 그리고 91147 ± 4927 mg/L (총 14 농도 단계) 이었다(Table 3). 4-L 용량의 수조에 농도별로 희석한 부유사 용액 2L를 주입하고, 각 처리구별로 넙치 치어(길이 2.49 ± 0.34 cm, 무게 0.109 ± 0.050 g)를 10마리씩 투입하였다. 퇴적물의 부유 상태 유지 및 시험 방법은 붕장어의 방식과 같게 수행하였다.
2.6 넙치 수정란의 부화율 측정 실험
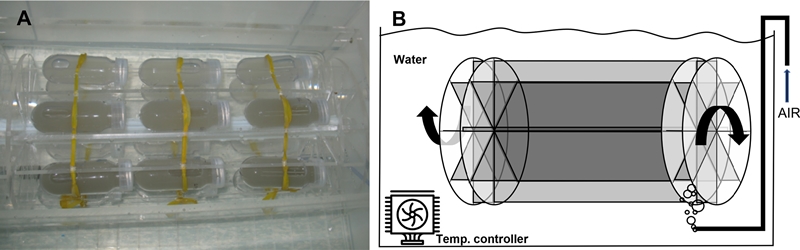
실험에 사용된 넙치 수정란은 제주도의 종묘배양장에서 구하였다. 넙치 수정란은 수정이 이루어진 후 4시간 이내에 실험에 사용하였다. 수정란 노출 실험 시 반복구 간 평균 노출 농도는 0, 48.4 ± 1.5, 240.9 ± 3.4, 475.4 ± 11.3, 2347 ± 90 그리고 4762.6 ± 76mg/L(총 6 농도 단계) 이었고, 농도별로 3 반복 실험하였다(Table 4). 80ml 용량의 투명 폴리카보네이트 용기에 농도별로 희석한 부유사 용액을 주입하고, 용기마다 넙치 수정란을 50 개씩 투입하였다. 수정란은 발생 시 주변 용존산소를 거의 소모하지 않기 때문에 밀폐하여 실험하였고 초기 용존산소 농도는 8.62 mg/L 이었고, 실험 종료시 농도는 7.88 mg/L 이었다. 퇴적물의 부유 상태 유지를 위하여 아크릴 재질의 rotating wheel에 각 실험 용기를 설치하여 5 rpm의 속도로 회전하며 노출하였다(Fig. 1). 실험이 시작된 후 12 시간마다 발생단계를 관찰하였고, 대조구에서의 부화가 90% 이상 이루어진 수정 후 약 72 시간 경과 시점에서 노출을 종료하였다. 실험은 18oC가 유지되도록 냉각장치가 부착된 항온수조에서 이루어졌으며, 실험에 사용된 해수의 염분은 32 psu 이었다.
2.7 넙치 부화자어의 생존율 측정 실험
실험에 사용된 넙치 부화자어는 제주도의 종묘배양장에서 구한 수정란을 부화시켜 실험에 사용하였다. 부유사가 넙치 부화자어의 생존에 미치는 영향을 평가하기 위한 4 일 노출 평균 농도는 0, 10 ± 0.2, 32.3 ± 1, 48.1 ± 1.1, 100.9 ± 2.6, 240.1 ± 7.1, 290.6 ± 10.7, 481.3 ± 13.2, 971.4 ± 14, 2378 ± 77, 4719 ± 119, 9767 ± 137, 18519 ± 908 그리고 46627 ± 1455 mg/L (총 14 농도 단계) 이었다(Table 5). 부화자어는 생존 개체를 계수하는 과정에서 물리적 상처나 스투입하지 않게끔 실험을 디자인하였다. 80 ml 용량의 투명 폴리카보네이트 용기를 처리구 마다 4 개씩 준비하였다. 농도별로 희석한 부유사 용액을 주입하고, 용기마다 넙치 부화자어를 20 개체씩 투입하였다. 퇴적물의 부유상태 유지를 위해 rotating wheel을 이용하였다. 실험이 시작된 후 각각 24, 48, 72, 96 시간이 되는 시점에 각 처리구별로 1 개씩 용기를 회수하여 생존 개체를 계수하였다. 실험 종료 시 마지막 용기 내 용존산소 농도는 7.15-7.61 mg/L 범위이었다.
3. 결 과
3.1 붕장어 생존율
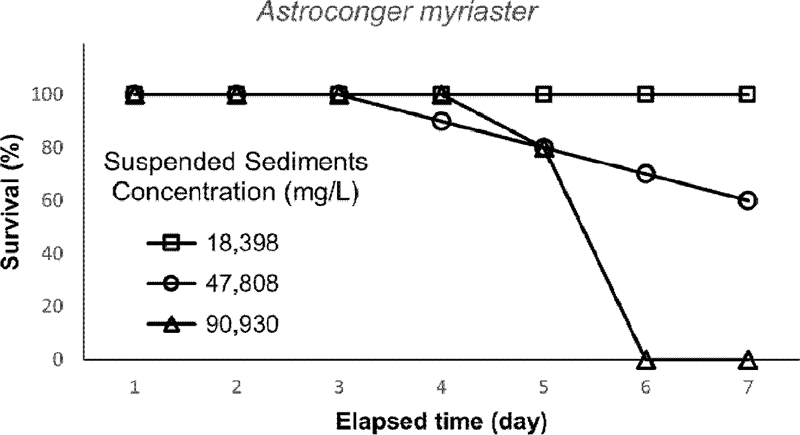
다양한 부유사 농도에서 7 일간 노출한 결과, 부유사 농도 47808 ± 1670 mg/L 에서 4 일째부터 사망 개체가 관찰되었다. 생존율은 노출시간이 길어지면서 일정하게 감소하여 실험이 종료되는 7 일째에는 60%의 생존율을 보였다. 부유사 농도 90930 ± 3549 mg/L에서는 5 일째부터 사망 개체가 나타났고, 6 일째에는 모두 사망하였다(Fig. 2). 따라서 붕장어는 부유사 농도가 약 47800 mg/L 이상에서 최소 4 일 이상 노출되었을 때 생존에 영향을 받는 것으로 여겨진다. 실험 최고농도 결과로부터 노출시간 6 일과 7 일은 반수치사농도(LC50, median lethal concentration)를 계산하였다. 선형내삽법(Linear interpolation method, USEPA[2002])을 이용하여 LC50을 추정한 결과, 6d-LC50은 62335 mg/L, 7d-LC50은 54838 mg/L로 계산되었다.
3.2 흰다리새우 생존율
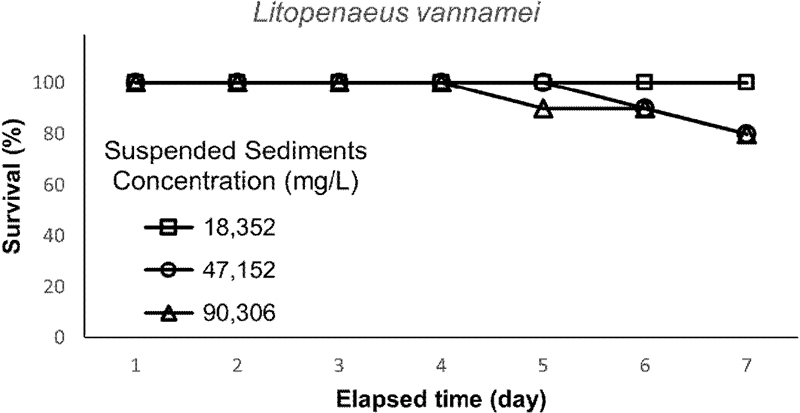
부유사 농도 18352 ± 862 mg/L 이하 모든 처리구에서 7 일간 노출한 결과, 사망한 흰다리새우는 한 개체도 없었다. 부유사 농도 47152 ± 1691 mg/L에서는 6 일째부터 사망 개체가 관찰되었고, 7일째의 생존율은 80%이었다. 부유사 농도 90306 ± 2967 mg/L에서는 5 일째부터 사망 개체가 나타났고, 7 일째의 생존율 역시 80%이었다(Fig. 3). 따라서 흰다리새우는 부유사 농도가 약 47152 ± 1691 mg/L 이상에서 최소 5일 이상 노출되었을 때 생존에 영향을 받는 것으로 여겨진다.
3.3 넙치 치어 생존율
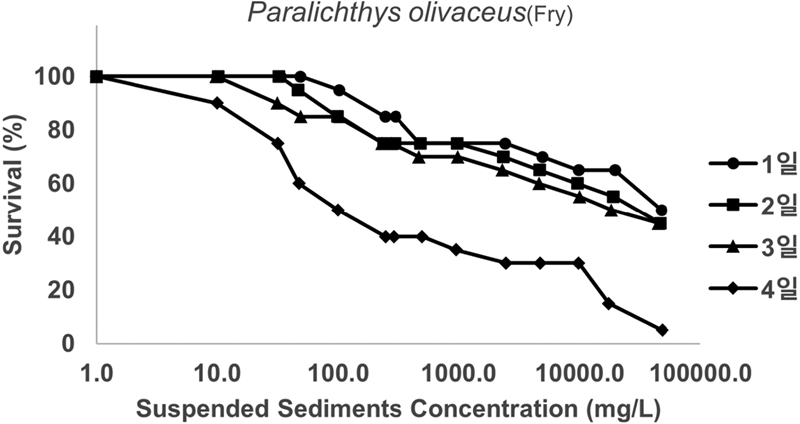
부유사 농도 9730 ± 151 mg/L이하 실험구에서 7 일간 노출된 넙치 치어는 한 개체도 사망하지 않았다. 부유사 농도 18185 ± 926 mg/L에서는 6 일째 되는 날에 사망이 관찰되어 생존율은 90%이었고 이보다 높은 농도인 47298 ± 1851 mg/L에서는 사망한 개체가 한 마리도 없었으며, 91147 ± 4927 mg/L에서는 노출 6 일째까지 100% 생존율을 보였으나 7 일째 70%로 감소하였다(Fig. 4). 이상의 결과를 종합하면, 넙치 치어는 부유사 농도 약 18185 ± 926 mg/L 이상에서 최소 6 일 이상 노출되었을 때 생존에 영향을 받는 것으로 여겨진다.
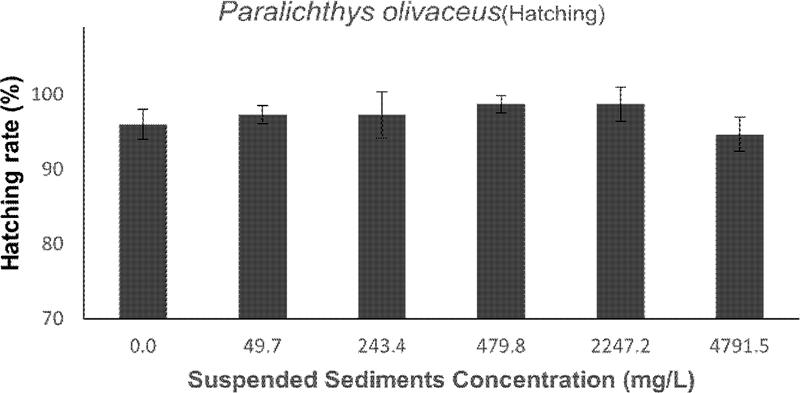
3.4 넙치 수정란 부화율
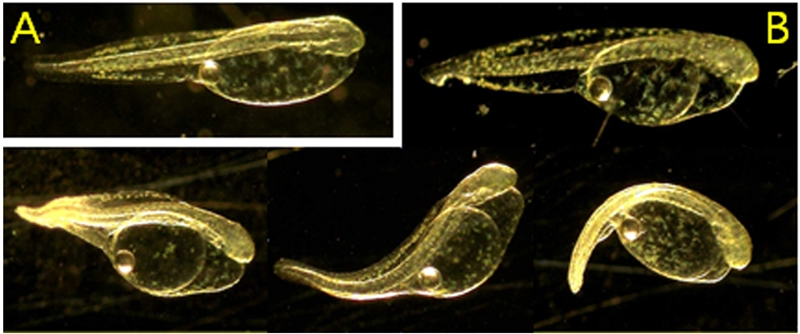
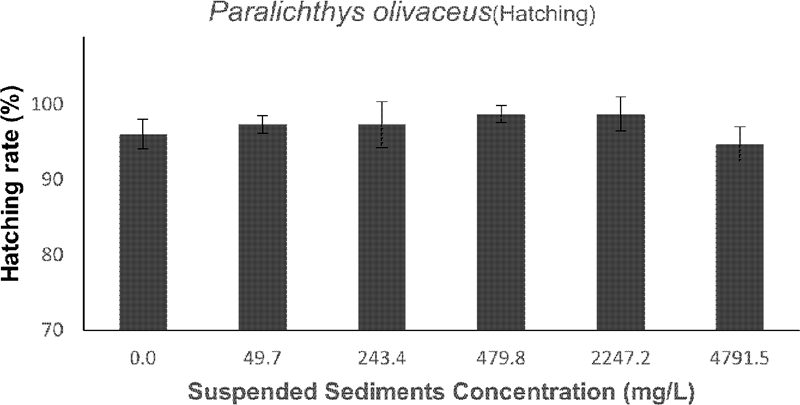
넙치 수정란의 부화율은 모든 처리구에서 90% 이상으로 나타났다(Fig. 5). 따라서 부유사 농도 4762.6 ± 76 mg/L까지는 넙치 수정란 부화율에 영향을 미치지 않는 것으로 여겨진다. 그러나, 막 부화해 나온 유생의 형태를 관찰한 결과, 가장 높은 농도에서 부화에는 영향이 없었으나 형태적 기형이 관찰되었다. 자어 체장이 대조구 평균 체장 2.41 ± 0.13 mm 보다 짧은 2.13 ± 0.23 수준이었다. 그리고 척추만곡 및 지느러미의 기형 또한 일부 관찰되었다(Fig. 6). 이러한 비정상적인 기형 개체는 전체의 약 30% 정도를 차지하였다.
Hatching rate of olive flounder, Paralichthys olivaceus to various concentrations of Suspended Sediment.
3.5 넙치 부화자어 생존율
넙치 부화자어의 생존율은 1 일간 노출시 부유사 농도 100.9 ± 2.6 mg/L에서 사망한 개체가 관찰되었다. 2 일간 노출시에는 48.1 ± 1.1mg/L에서, 3 일간 노출시에는 32.3 ± 1.0mg/L에서 사망 개체가 나타났고, 4 일간 노출시에는 실험 최저농도인 10.0 ± 0.2mg/L에서도 사망 개체가 관찰되었다(Fig. 7). 부유사 농도 971.4 ± 14 mg/L에서 3일째 생존율이 70%이었고, 4 일째에 35%로, LC50은 4 일째의 생존율로 계산하였다. 선형내삽법(USEPA, 2002)을 이용하여 LC50을 추정한 결과, 4d-LC50은 99.4 mg/L로 계산되었다. 부유사 농도 4719 ± 119mg/L에서 3 일째 생존율이 60%, 4 일째에 30% 이었다. 부유사 농도 46627 ± 1455 mg/L에서의 생존율이 1 일째부터 50%로 감소하였고 1d-LC50은 >47285 mg/L, 2d-LC50은 31305 mg/L, 3d-LC50은 18261 mg/L으로 계산되었다.
4. 고 찰
본 연구에서는 부유사가 붕장어(Astroconger myriaster), 흰다리새우(Litopenaeus vannamei), 넙치(Paralichthys olivaceus) 수정란, 부화자어 및 치어의 생존과 부화에 미치는 영향을 생물검정 하였다. 부화자어를 제외하면, 이들 세 종은 비교적 높은 농도의 부유사 조건에도 잘 견디는 것으로 확인되었다. 약 18,000 mg/L의 농도에서 붕장어와 흰다리새우는 7 일 동안 모두 생존하였고, 넙치치어는, 대조구와 유의미한 차이 없이, 90%가 생존하였다. 이보다 더 높은 농도에서 7 일 동안 노출한 결과 붕장어는 약 48,000 mg/L에서 60%가 생존하였으나, 90,000 mg/L에서는 모두 사망하였다. 반면, 흰다리새우와 넙치 치어는 90,000 mg/L에서도 각각 80%, 70%의 높은 생존율을 보여 부유사에 대한 내성이 붕장어보다 높음을 알 수 있었다. 넙치 수정란의 부화율은, 실험 최고농도인 약 4,700 mg/L에서도 95% 부화율을 보여 대조구에서의 부화율인 96%와 큰 차이를 보이지 않았다. 다만, 부화한 유생의 외형이 정상적이지 않고 등이 휘어져 있는 개체가 일부 발견되어, 부화 이후에 유생의 생존에는 영향을 미칠 수 있음을 유추할 수 있다. 부화자어의 생존율은 비교적 낮은 농도에서도 많이 감소하였다. 정상적으로 부화한 개체를 대상으로, 저농도의 부유사 농도에서도 영향이 있음을 보여주었고 이는 치어나 성체의 부유사 내성이 강하다 하더라도 상대적으로 적극적 회피 능력이 낮고 외부환경에 민감한 초기 발생단계에는 치명적일 수 있음을 시사한다.
부유사가 해양생물에 미치는 영향을 조사한 기존의 연구인 Gyeongsang National University[2002]의 자료에서는 부유사의 7일 동안 반수치사농도가 붕장어의 경우 172-437mg/L, 비단가리비는 131-201mg/L로 보고하였다. 본 연구에서 추정된 붕장어의 7 일 동안 반수치사농도는 약 54,838mg/L로 Gyeongsang National University[2002]의 자료와는 100배 이상의 상당한 차이가 있다. 따라서, 본 연구에서는 부유사가 수생생물에게 미치는 영향에 관한 자료들을 수집하여 비교 고찰하였다. 부유사가 생물에 미치는 영향으로는, 수정률, 착생률, 발생률, 부화율, 생식률, 성장률, 여과율, 호흡률, 생존율 등이 있다(Table 6). Gilmour[1999]는 돌산호 종류인 Acropora digitifera의 수정률, 발생률, 및 착생률에 미치는 부유사의 영향을 조사하였다. 수정률과 착생률은 비교적 낮은 농도인 50 mg/L에서 감소한다고 보고하였다. 이는 부유사가 정자 혹은 부유 유생과 직접 접촉하면 편모 및 섬모의 운동성을 감소시키기 때문으로 해석된다. 본 연구에서 넙치 부화자어의 생존율이 100-150 mg/L 범위에서 50%로 감소하는 것도 이와 유사한 이유에 기인한 것으로 여겨진다. 그러나 넙치자어는 척추동물로 산호충 등 자포동물의 유생보다 산소의 소모량이 많으므로 부유사가 물리적으로 아가미 조직에 흡착하여 용존산소 농도와 무관하게 가스교환이 원활하지 못하여 질식하였을 것으로 추정할 수 있다. 그러나 발생률은 100 mg/L에서도 영향을 받지 않는다고 하였는데, 이는 수중에 부유사가 존재하더라도 발생 중인 배아(embryo)는 수정막으로 보호되기 때문에 부유사 농도가 증가하더라도 배아에 직접적인 영향을 미치지 않기 때문으로 해석된다. 이는 본 연구에서 약 5000 mg/L의 상대적으로 높은 부유사 농도에서도 넙치 수정란의 부화율이 감소하지 않은 결과와도 일치한다. Sellner and Bundy[1987]는 요각류인 Eurytemora affinis가 부유사 농도 350 mg/L에서 42 일간의 생존율과 생식률이 부유사가 없는 조건과 차이가 없음을 보고하였다. Sutherland and Meyer[2006]는 담수어류인 Cyprinella galactura와 Erimonax monachus의 21 일간 성장률이 각각 100 mg/L, 25 mg/L 이상일 때 감소한다고 보고하여, 성장은 부유사의 영향을 비교적 크게 받고 있음을 알 수 있다.
Shin et al.[2002]은 담치류인 Perna viridis가 14 일간 600mg/L의 부유사에 노출되어도 여과율과 호흡률이 변화하지 않는다고 하였다. 이는 여과율과 호흡률 또한 비교적 높은 부유사 농도에서도 큰 영향을 받지 않음을 의미한다. Preez et al.[1996]은 담수어류인 Tilapia rendalli의 호흡률이 부유사 농도가 10,000 mg/L 이상의 고농도가 되면 증가한다고 보고하였다. 일반적으로 대사 생리의 지표로 측정되고 있는 여과율과 호흡률은 환경 스트레스가 생물의 성장잠재력(scope for growth)에 어떠한 영향을 주는지 알아보기 위한 구성 인자로 측정되고 있다(Bayne et al.[1985]). 성장잠재력은 A = (C-F) - (R+U)의 형태로 표현되는데, C는 먹이로 흡수한 에너지, F는 변으로 배설된 에너지, R은 호흡으로 소모한 에너지, U는 분비물을 통하여 소모된 에너지를 의미한다. 환경으로부터 물리, 화학적 스트레스가 존재하게 되면 생물의 성장잠재력은 감소하게 되는데 이는 섭식률(여과율)의 감소, 먹이 흡수율의 감소, 호흡률의 증가, 분비율의 증가 등에 기인한 결과이다. 일반적으로 스트레스가 작용하게 되면 먹이를 먹으려는 노력을 적게 하게 되므로 생물이 흡수하는 에너지의 총량이 감소하게 되고, 스트레스에 대항하기 위하여 기초대사 이외의 초과 에너지를 사용하게 되므로 호흡률이 증가하게 되고, 이 결과 분비되는 배설량도 증가하게 된다. 이러한 생물 반응의 결과는 최종적으로 성장과 생식에 투입할 수 있는 총 에너지의 양을 감소시키게 되므로 궁극적으로는 성장률과 생식률이 감소하는 결과로 나타나게 된다. 여과율이 감소하거나, 호흡률이 증가하게 되는 외부자극의 강도는 스트레스의 종류에 따라 다를 수 있는데, <Table 6>의 자료를 통하여 유추하여 보면, 최소한 부유사 농도가 10,000 mg/L 이상이 되어야 호흡률의 증가를 일으킬 정도의 자극인 것으로 보인다. Gyeongsang National University[2002]의 보고에 의하면 붕장어와 비단가리비의 호흡률이 부유사 농도가 증가할수록, 노출시간이 길어질수록 호흡률이 감소하는 것으로 보고하고 있으며, 각각 부유사 농도 59-96mg/L 및 49-72mg/L의 매우 낮은 농도(연안역에서 흔히 관측 가능한 농도 범위임)에서 호흡률이 평상시의 절반으로 감소한다고 하였는데, 이는 부유사 농도가 증가하면 성장잠재력이 증가한다는 의미가 되며, 부유사가 증가하면 할수록 오히려 생물의 성장에 좋은 역할을 하는 것으로 해석되어, 일반적인 독성학적 개념과는 일치하지 않는다.
부유사가 생물의 생존에 미치는 영향은 비교적 다양한 생물군에 대해 조사가 이루어져 있다. Suren et al.[2005]은 담수산 곤충류인 Deleatidium sp., Zephlebia sp., Polyplectropus sp., Triplectides obsoletus, Xanthocnemis zealandica와 가재류인 Paranephrops planifirons가, 최대 20,000 mg/L 이상의 농도에 24 시간 노출되어도 모두 생존한다고 하였고, 어린 개체를 이용한 실험에서 Deleatidium sp 유충은 1,000 mg/L 정도에서 14일간 노출되어도 모두 생존한다고 보고하였다. Buermann et al.[1997]은 담수어류인 Tilapia rendalli의 생존율이 성어는 20,000 mg/L 까지 영향이 없고, 치어도 15,000 mg/L 까지는 영향이 없다고 하였으며, LC50은 성어 42,000-48,000mg/L, 치어 21,000-24,000 mg/L의 범위로 보고하였다. McFarland and Peddicord[1980]는 다양한 저서동물의 부유사에 대한 반응을 조사하였는데, 성게류인 Strongylocentrotus purpuratus, 이매패류인 Tapes japonica, 집게류인 Pagurus hirsutiusculus, 등각류인 Sphaeroma pentodon, 복족류인 Nassarius obsoletus 등은 100,000 mg/L의 아주 높은 농도에서 5-10 일간 노출되어도 사망한 개체는 없었다고 하였고, 담치류인 Mytilus edulis와 피낭류인 Molgula manhattensis, Styela montereyensis는 같은 조건에서 사망률이 10% 이내였다고 하였다. 고농도 노출실험을 통하여 추정한 LC50 값이 담치류인 Mytilus californianus가 96,000mg/L, 새우류인 Crangon nigromaculata가 50,000mg/L, 게류인 Cancer magister가 32,000mg/L, 갯지렁이류인 Neanthes succinea가 48,000 mg/L, 피낭류인 Ascidia ceratodes가 38,000mg/L, 단각류인 Anisogammarus confervicolus가 78,000mg/L, 어류인 Cymatogaster aggregata가 6,000 mg/L 등인 것으로 보고하였다. 이상의 연구들을 종합해 보면, 부유사에 의하여 생존에 영향을 받는 가장 민감한 종은 Cymatogaster aggregata 이었고(LC50 = 6,000 mg/L), 대부분은 LC50값이 10,000-100,000 mg/L 정도의 범위에 위치하며, 본 연구에서 추정된 붕장어의 LC50 값인 60,284 mg/L도 이 범위 수준에 포함된다. 또한 많은 경우 생물들은 100,000 mg/L 정도의 높은 농도의 부유사 환경에서도 90% 이상의 생존율을 보여 전반적으로 부유사에 대한 내성이 강함을 알 수 있다.
부유사의 직접적인 작용 이외에 수중의 용존물질의 흡착을 통한 해수 독성에 미치는 부유사의 영향에 관한 연구들도 있다. Boeckman and Bidwell[2006]은 물벼룩인 Daphnia pulex의 구리에 대한 LC50이 부유사의 농도가 증가하면서 함께 증가한다고 하였는데 이는 부유사가 용존상태의 구리이온을 흡착하여 구리의 독성을 감소시킨 결과로 해석된다. Pyle et al.[2002] 또한 담수어류인 Pimephales promelas 유생의 니켈에 대한 96hr-LC50이 부유사 농도가 증가하면서 함께 증가한다고 보고하였다. Schrap and Opperhuizen[1989]는 담수어류인 Poecilia reticulata의 체내에 1,2,3- trichlorobenzene(TCB)과 hexachlorobenzene(HCB)의 축적률이 수중에 부유사가 존재할 때와 존재하지 않을 때를 비교하였는데, 수용성이 강한 TCB는 부유사의 영향을 적게 받으나, 수용성이 약한 HCB는 부유사에 흡착이 많이 되어 체내 축적량이 많게 나타난다고 하였다. 이러한 연구들은 부유사의 존재가 오염된 해역에서는 오히려 생물의 생존에 도움이 될 수도 있다는 측면을 알 수 있게 해준다.
본 연구 결과를 종합해보면, 비 산란기에 부유사 농도가 최소 18,000 mg/L 이상으로 6 일 이상 지속될 때 생물의 생존에 영향을 미칠 수 있는 것으로 나타났다. 그러나, 실제 해사채취 및 공사해역의 부유사 농도가 18,000 mg/L 이상으로 6 일 이상 지속될 가능성은 없다고 여겨진다. 따라서, 해사채취를 포함한 해양 개발행위로 인한 부유사가 생물의 생존을 위협할 정도는 아닌 것으로 판단 된다. 추가로 부유사가 발생하게 되면 생물들은 이동성이 있으므로 그 해역을 벗어나 자신들이 선호하는 환경으로 옮겨갈 것으로 예측된다. 실제로 Wildish and Power[1985]는 어류인 Osmerus mordax가 부유사의 농도가 22 mg/L 이상으로 증가하면, 그 해역에 머무르지 않고 새로운 서식처로 옮겨가려 한다는 사실을 실험적으로 규명하였다. 따라서, 해사채취 및 해양 개발 해역에서의 어족자원 감소는 부유사로 인한 폐사에 기인한 것이 아니라, 생물들의 능동적 회피로 인한 이동에 기인한 것으로 보아야 할 것이다. 그러나, 부화율 측정 실험 및 부화 유생의 생존율 측정 실험의 결과에서, 부화 직후의 유생은 부유사의 비교적 낮은 농도에서도 치명적인 영향을 직접 받을 수 있으므로, 산란기 전후에 행해지는 부유사 유발행위는 해역에서 산란하는 어족의 개체군 변동에 영향을 미칠 수 있을 것으로 예상된다.
Acknowledgments
본 연구는 2021년 해양수산부 재원으로 해양수산과학기술진흥원(과학기술기반 해역이용영향평가 기술개발, 20210427)의 지원을 받아 수행하였습니다.
References
- Bayne, B.L., Brown, D.A., Burns, K., Dixon, D.R., Ivanovici, A., Livingstone, D.R., Lowe, D.M., Moore, M.N., Stebbing, A.R.D. and Widdows, J., 1985, The effects of stress and pollution on marine animals, Praeser Publisher. New York, 384 pp.
- Beaumont, P., 1975, Hydrology, in: Whitton, B.A. (Eds.), River ecology. Univ. Calif. Press, Berkeley, 1-38.
- Beussink, Z.S., 2007, The effects of suspended sediment on the attachment and metamorphosis success of freshwater mussel parasitic life stages, Missouri State University, Springfield, Missouri, 30-55.
-
Boeckman, C.J. and Bidwell, J.R., 2006, The effects of temperature, suspended solids, and organic carbon on copper toxicity to two aquatic invertebrates. Water, Air, and Soil Pollution, 171, 185-202.
[https://doi.org/10.1007/s11270-005-9036-3]

-
Buermann, Y., Du Preez, H.H., Steyn, G.J. and Smit, L., 1997, Tolerance levels of redbreast tilapia, Tilapia rendalli (Boulenger, 1896) to natural suspended silt, Hydrobiologia, 344, 11-18.
[https://doi.org/10.1023/A:1002985707694]

- Claffey, F.J., 1955, The Productivity of Oklahoma waters with special reference to relationship between turbidity from soil, light penetration, and the populations of plankton. Doctoral dissertation, Oklahoma State Univer. Stillwater, 100.
- Cordone, A.J. and Kelley. D.W., 1961, The influences of inorganic sediment on the aquatic life of streams. Calif. Fish and Game., 47(2), 189-228.
- Doudoroff P., 1976, Keynote address-Reflections on pickle-jar ecology, in: J. Cairns, Jr., Dickson, K.L. and Westlake, G.F. (Eds.), Biological monitoring of water and effluent quality, Am. Soc. Test. Materials Spec. Techn. Publ., 607.
- Ellis, M.M., 1931, Some factors affecting the replacement of the commercial fresh-water mussel. U.S. Dept. Commerce, Bur. Fish., Fish. Circ., 7(10).
-
Ellis, M.M., 1936, Erosion silt as a factor in aquatic environment. Ecology, 17(1), 29-42.
[https://doi.org/10.2307/1932951]

- Ellis, M.M., 1944, Water purity standards for fresh-water fish. U.S. Fish and Wild. Serv. Spec. Sci. Rept., 2, 18.
-
Forester, T.S. and Lawrence, J.M., 1978, Effects of grass carp and carp on populations of bluegill and largemouth bass in ponds. Trans. Am. Fish. Soc., 107(1), 172-175.
[https://doi.org/10.1577/1548-8659(1978)107<172:EOGCAC>2.0.CO;2]

- Forshage, A. and Carter, N.E., 1974, Effects of gravel dredging on the Brazos River. Proc. Southeastern Assoc. Fish and Game Comm., 27, 695-709.
- Gammon, J.R., 1970, The effect of inorganic sediment on stream biota. U.S. Environ. Protection Agency, Water Poll. Cont. Res. Ser., 18050 DWC, 12(70), 1-141.
- Garcia M.H., 2008, Sedimentation engineering: processes, measurements, modeling, and practice. ASCE Manuals and Reports on Engineering Practice No. 110. American Society of Civil Engineers, Reston, VA, 1132.
-
Gilmour, J., 1999, Experimental investigation into the effects of suspended sediment on fertilization, larval survival and settlement in a scleractinian coral. Marine Biology, 135, 451-462.
[https://doi.org/10.1007/s002270050645]

- Gyeongsang National University, 2002, Report on the damage investigation service of sea sand harvesting and fishing for construction of Busan New Port -Within the exclusive economic zone-, 353-367. 경상대학교, 2002, 제 6장 생물검정실험. -배타적경제수역 (EEZ) 내에서의 - 부산신항만 건설공사용 바다모래채취 어업피해조사용역 보고서, 353-367.
- Hambric, R.N., 1953, Some effects of turbidity on bottom fauna, M.S. thesis, Oklahoma State Univ., Stillwater, 34.
-
Hess, S., Prescott, L.J., Hoey, A.S., McMahon, S.A., Wenger, A.S., Rummer, J.L., 2017, Species-specific impacts of suspended sediments on gill structure and function in coral reef fishes, Proc. R. Soc. B 284, 20171279.
[https://doi.org/10.1098/rspb.2017.1279]

- Hwang, U.K., Ryu, H.M., Kim, S.G., Park, S.Y. and Kang, H.S., 2012, Acute Toxicity of Heavy Metal (Cd, Cu, Zn) on the Hatching Rates of Fertilized Eggs in the Olive Flounder (Paralichthys olivaceus), Korean J. Environ. Biol., 30(2), 136-142.
- Irwin, W.H. and Stevenson, J.H., 1951, Physicochemical nature of clay turbidity with special reference to clarification and productivity of impounded waters, Oklahoma A & College(Okla. Atate Univ.), Stillwater, Bull., 48, 54.
- Iwamoto, R.N., Salo, E.O., Madej, M.A., McComas R.L. and Rulifson, R.L., 1978, Sediment and water quality: A review of the literature including a suggested approach for water quality criteria with summary of workshop and conclusions and recommendations, EPA 910/9-78-048.
-
Jones, J.R. and Bachmann, R.W., 1978, Trophic ststus of Iowa lakes in relation to origin and glacial geology, Hydrobiologia, 57(3), 267-273.
[https://doi.org/10.1007/BF00014580]

-
June, F.C., 1977, Repoductive patterns in seventeen erosion in the United States, J. Geophys. Res., 69, 3395-3401.
[https://doi.org/10.1029/JZ069i016p03395]

- Kilkus, S.P., LaPerriere J.D. and Cosby, B.J., 1976, Automated measurment of river productivity for eutrophication prediction, 133-146 in: J. Cairnts, Jr., Dickson, K.L. and Westlake, G.F. (Eds.), Biological monitoring of water and effluent quality, ASTM Techn. Publ. 607, Am. Soc. Testing and materials, Philadelphia, Pa.
- Kim, Y.S., Do, Y.H., Kim, S.Y. and Chang, Y.J., 2010, Developmental Speed of Olive Flounder Paralichthys olivaceus Eggs in Various Water Temperatures, Dev. Reprod., 14(2), 59-63.
-
Kim, Y.T., Kim, G.Y., Jeon K.A., Eom, K.H., Kim, I.C., Choi, B.R., Kim, H.J., Kim J.M., 2014, Improvements in the Marine Environmental Survey on Impact of Seawater Qualities and Ecosystems due to Marine Sand Mining, Journal of the Korean Society of Marine Environment & Safety, 20(2), 143-156.
[https://doi.org/10.7837/kosomes.2014.20.2.143]

- Maeng, J.H., Cho, K.W., Joo, Y.J., 2006, Status and Improvement of the Mitigation Option to the Suspended Sediments in Coastal Development Projects - Focused on Silt Protector -, Journal of environmental impact assessment, 15(5), 289-297.
-
McFarland, V.A. and Peddicord, R.K., 1980, Lethality of a suspended clay to a diverse selection of marine and estuarine macrofauna, Archives of Environmental Contamination and Toxicology, 9, 733-741.
[https://doi.org/10.1007/BF01055548]

-
Middaugh, D.P, and Dean, J.M., 1977, Comparative sensitivity of eggs, larvae, and adults of the estuarine teleosts, Fundulus heteroclitus and Menidia menidia to cadmium, Bulletin of Environmental Contamination and Toxicology, 17(6), 645-652.
[https://doi.org/10.1007/BF01685947]

- Ministry of Oceans and Fisheries, 2018, Marine Environment Process Test Standards (Chapter 4, Section 6). 해양수산부, 2018, 고시 제2018-143호. 해양환경공정시험기준, 제4장, 제5항
-
Mohammed, A., 2013, Why are Early Life Stages of Aquatic Organisms more Sensitive to Toxicants than Adults?, in: Gowder, S.J.T.(Eds), New Insights into Toxicity and Drug Testing.
[https://doi.org/10.5772/55187]

-
Mohammed, A., Halfhide, T., and Elias-samlalsingh, N., 2009, Comparative sensitivity of six toxicants of two life stages of the tropical mysid, Metamysidopsis insularis, Toxicology and Environmental Chemistry, 97(7), 1331-1337.
[https://doi.org/10.1080/02772240802608038]

- Moor, M., 1937, The effect of silting on the productivity of waters, Trans. N. Am. Wild. Conf., 2, 658-661.
-
Moor, M., 1944, Notes on the early life history of Notropis Girardi. Copeia, 1944(4), 209-214.
[https://doi.org/10.2307/1438675]

-
Moor, M., 1950, The Cutaneous sense organs of barbled minnows adapted to life in the muddy waters of the Great Plains Resion, Trans. Am. Micro. Soc., 69, 69-95.
[https://doi.org/10.2307/3223350]

- Morton, J.W., 1977, Ecological effect of dredging and dredge spoil disposal: a literature review, U.S. Fish and Wild, Serv. Techn. Paper, 94, 33.
- Nichols, G., 1999, Sedimentology and stratigraphy. Blackwell Science, Oxford, 355.
-
Peters, R.E. and Hontela, A., 1978, Annual gonadal cycles in teleosts: Environmental factors and gonadotropin levels in blood, in: I. Assenamacher and D.S., Farner, (Eds.), Environmental endocrinology. Springer-Verlag. N.Y., 20-25.
[https://doi.org/10.1007/978-3-642-66981-1_4]

-
Preez, H.H., Buermann, Y., Steyn, G.J. and Smit L., 1996, The influence of suspended silt on oxygen consumption by the redbreast tilapia, Tilapia rendalli (Boulenger, 1986), Hydrobiologia, 325, 31-38.
[https://doi.org/10.1007/BF00023665]

- Pyle, G.G., Swanson, S.M., and Lehmkuhl, D.M., 2002, The influence of water hardness, pH, and suspended solids on nickel toxicity to larval fathead minnows (Pimephales promelas), Water, Air, and Soil Pollution, 133, 215-226.
- Schmieder, P.K., Jensen, K.M., Johnson, R.D. and Tietge, J.E., 2000, Comparative sensitivity of different life-stages of medaka and salmonid fishes to 2,3,7,8-TCDD, in proc. of International Symposium on Endocrine-Disrupting Substances Testing in Medaka, Nagoya, Japan, March, 17-20.
-
Schrap, S.M. and Opperhuizen, A., 1989, Preliminary investigations on the influence of suspended sediments on the bioaccumulation of two chlorobenzenes by the guppy (Poecilia reticulata), Hydrobiologia, 188(189), 573-576.
[https://doi.org/10.1007/BF00027825]

- Schreck, C.B. and Scanlon, P.F., 1977, Endocrinology in fisheries and wildlife: biology and management. Fisheries, 2, 20-30.
-
Schwassmann, H.O., 1971, Biological rhythms, in: W.S., Hoar and D.J., Randall, (Eds.), Fish Physiology, Academic Press, New York, 6, 371-428.
[https://doi.org/10.1016/S1546-5098(08)60151-X]

-
Sellner, K.G. and Bundy, M.H., 1987, Preliminary results of experiments to determine the effects of suspended sediments on the estuarine copepod Eurytemora affinis, Continental Shelf Research, 7(11/12), 1435-1438.
[https://doi.org/10.1016/0278-4343(87)90051-3]

-
Shin, P.K.S., Yau, F.N., Chow, S.H., Tai, K.K. and Cheung, S.G., 2002, Responses of the green-lipped mussel Perna viridis (L.) to suspended solids, Marine Pollution Bulletin, 45, 157-162.
[https://doi.org/10.1016/S0025-326X(01)00298-3]

-
Ringwood, A.M., 1990, The Relative Sensitivities of Different Life Stages of Isognomon californicum to Cadmium Toxicity, Archives of Environmental Contamination and Toxicology, 19(3), 338-340.
[https://doi.org/10.1007/BF01054975]

- Sung, C.G., 2020, Development of alternative ecotoxicity test based on early life stage of Korean native marine fish and it’s application to Hebai Spirit oil spill monitoring, Ph.D. dissertation, Dept. Energy and Environmental System Eng, University of Seoul, Seoul, Republic of Korea.
-
Suren, A.M., Martin, M.L. and Smith, B.J., 2005, Short-term effects of high suspended sediments on six common New Zealand stream invertebrates, Hydrobiologia, 548, 67-74.
[https://doi.org/10.1007/s10750-005-4167-5]

-
Sutherland, A.B. and Meyer, J.L., 2006, Effects of increased suspended sediment on growth rate and gill condition of two southern Appalachan minnows, Environ. Biol. Fish.
[https://doi.org/10.1007/s10641-006-9139-8]

- Toetz, D.W., 1966, The change from endogenous to exogenous sources of energy in bluegill sunfish larvae, Invest. Indiana Lakes & Streams, 7(4), 115-146.
- Toetz, D.W., 1967, Ecological factors affecting turbidity and productivity in prairie pond in the Southern Great Plains, Okla. Water Resources res. Inst., Proj. Compl. Rept. OWRRI Proj., No, A-001, 34.
- U.S. Army Corps of Engineers(U.S. ACE), 2015, U.S. waterway system: transportation facts and information. Navigation and Civil Works Decision Support Center, http://www.navigationdatacenter.us/factcard/factcard.htm, , Accessed 08 April 2015.
- USEPA, 2002, Short-term methods for estimating the chronic toxicity of effluents and receiving waters to marine and estuarine organisms, 3rd Edition, EPA-821-R-02-014.
- Waters T.F., 1995, Sediment in streams: sources, biological effects, and control, American Fisheries Society Monograph 7, Bethesda, 251.
-
Wildish, D.J. and Power, J., 1985, Avoidance of suspended sediments by smelt as determined by a new “single fish” behavioral bioassay, Bulletin of Environmental Contamination and Toxicology, 34, 770-774.
[https://doi.org/10.1007/BF01609805]

- Winner, J.M., 1975, Zooplankton, in: B.A. Whitton, (Eds.), River ecology, Univ. Calif. Press, Berkeley, 155-169.
-
Wood, P.J., 1997, Biological effects of fine sediments in the lotic environment, Environ. Manag., 21, 203-217.
[https://doi.org/10.1007/s002679900019]