갯벌 및 염습지 환경 내 유기물질의 제거효율에 대한 고찰
초록
무분별한 산업화와 해안 개발로 인해 해양생태계의 부영양화가 빈번하게 일어나고 있다. 이에 연안 내 염습지의 정화능력에 대해 관심이 고조되고 있지만, 염생식물의 종류에 따른 유기물 정화능 연구는 여전히 미흡한 실정이다. 본 연구에서는 국내 연안의 유기물 발생량을 파악하고 식생별 유기물 제거능력을 분석하여 각 염생식물의 유기물 제거효율을 평가하였다. 분석 결과, 갈대는 총 인(최대 99%) 및 화학적 산소 요구량(최대 98%)에 대한 제거효율이 가장 높았으며, 갯끈풀은 총 질소 제거효율(최대 99%)이 가장 높은 것으로 나타났다. 이를 통해 염생식물마다 최적의 제거효율을 가지는 영양염의 종류가 다른 것을 알 수 있었다. 추후 연구를 통해 각 염생식물의 물질 특이적인 정화 프로세스를 규명할 필요가 있을 것이다. 본 연구 결과는 염생식물의 유기물 제거율에 대한 기본적인 정보를 제공하며 염습지를 이용한 자연정화가 효율적인 폐수처리 대안책으로 제공될 수 있음을 시사한다.
Abstract
Industrialization and coastal development have altered the major biogeochemical cycles in coastal systems causing serious outcomes from eutrophication coastal pollution, leading to red tide blooms. In coastal environments tidal flat and saltmarshes have been known to be purifiers for excessive effluents. Here we show, a review to assess the past and present trend of nutrient removal of excessive nutrients in wastewaters. The main contributing halophytes (Phagmites sp., Spartina sp., Typha sp., etc.) were reviewed to current status. Results showed that Phragmites sp. showed the highest nutrient removal rate of total phosphorus (99%) and chemical oxygen demand (98%). Total nitrogen removal rates were highest in Spartina sp. habitats (99%) and bare tidal flats (97%). Overall, the study addresses the nutrient removal capacity of halophytes and tidal flats, and suggests as natural alternatives for wastewater treatments.
Keywords:
Nutrient removal, Wastewater treatment, Halophytes, Total nitrogen, Total Phosphorus, COD키워드:
영양염 제거, 폐수 처리, 염생식물, 총 질소, 총 인, 화학적 산소 요구량1. 서 론
연안 생태계 중 염습지는 해양생물의 서식지 제공, 홍수 및 침식 방지 등 다양한 생태계 서비스를 제공한다(Chapman[1960]). 특히 해양 생태계에서 염습지가 차지하는 비율은 상대적으로 작지만 (<10%, 약 435,000 km2), 해양 생태계에서 총 일차생산량의 약 20%(연간 총 일차생산량: 150−700 g C m-2 y-1)를 차지한다(Pedersen et al.[2004]).
더불어 연안 생태계는 육상과 해양을 연결하는 지리적 연결고리로서 육상으로부터 유입되는 오염원들을 정화, 분해하는 등 환경적 완충 역할을 담당한다(Mcleod et al.[2011]; Shepard et al.[2011]). 하지만 무분별한 해안개발로 인해 오염원의 유입이 증가하면서 생지화학적 순환은 부정적인 영향을 받고 있다(Deegan et al.[2012]; Suddick et al.[2013]). 갯벌은 유기탄소(Lee et al.[2019])와 질소(Brin et al.[2010]; Galloway et al.[2008])를 저장하며 유기물 오염원을 제거하는데, 이때 퇴적물 성상과 식생 유무에 따라 각 물질의 침적률은 크게 차이가 나타난다(Lee et al.[2021]). 특히 염생식물은 대기 중 탄소원 및 질소원을 흡수함으로써 갯벌의 유기물 정화에 도움을 주는 것으로 알려져 있다(Bouchard and Lefeuvre[2000]; Chmura et al.[2003]; Middelburg et al.[2004]).
육상기원 오염물질의 정화를 극대화하기 위한 연구는 과거부터 활발히 진행되어 왔다(You and Kim[1999]). 첫번째로 자유수면습지(free water surface wetlands)를 활용한 방법은 표면의 흐름을 이용한 정화방법으로 오염된 폐수를 수평으로 습지를 통과시킨다. 두번째로 여과습지(subsurface-flow wetlands)를 활용한 방법은 폐수를 수직으로 여과하여 정화하는 방법이다. 이렇듯 인공습지의 질소 제거는 3차처리(tertiary treatment) 수준의 정화를 목표로 하여 오염된 유입수를 정화하는 것을 중점으로 둔다(Green et al.[1996]; Reed et al.[1995]). 2005년 이후 선진국을 중심으로 인공습지를 활용한 폐수처리 연구가 진행되고 있다. 그러나 염습지와 갯벌의 유기물 정화에 대한 정량적 연구는 여전히 미비하며 이를 활용한 자연정화 기법 연구의 필요성이 대두되고 있다(You and Kim[1999]; Kim et al. [2019]).
이에, 본 연구의 목적은 1) 국내 연안 유기물 발생량, 해양 적조 발생 빈도와 규모를 파악하고, 2) 식생별 유기물 제거능력에 대한 연구동향을 분석하여, 3) 국내 대표 염생식물의 유기물 제거 능력을 평가하는 것이다. 이 연구 결과는 향후 연안환경의 유기물 제거 능력을 연구하는데 있어 기초데이터로 활용될 수 있을 것이다.
2. 재료 및 방법
염생식물의 제거능력 평가에 앞서 대상지역의 하수종말 처리장의 정확한 진단과 평가가 진행되야 한다. 이를 위해 국내 산업폐수의 발생 및 정화효율을 확인하였다. 본 연구에서는 과거 30년 데이터 베이스를 활용하여 염생식물의 유기물 제거에 대한 연구문헌을 검색하였으며 분석에 필요한 문헌을 선별하였다.
2.1 데이터 수집
본 연구에서는 2000-2020년 국가별 총 폐수 처리 정도(OECD [2021])를 확인하여 한국과 다른 국가들을 비교하였다(Fig. 1). 또한, 2018년-2020년 국내 연안의 산업폐수 발생 및 처리 현황(국가정보자원관리원: https://kosis.kr/)을 조사하였고(Fig. 2; Table 1), 국내 해양 적조 발생 현황(국립수산과학원: http://www.nifs.go.kr/)을 파악하여 부영양화로 인한 적조 발생빈도와 적조를 유발하는 생물종을 확인하였다(Fig. 2).
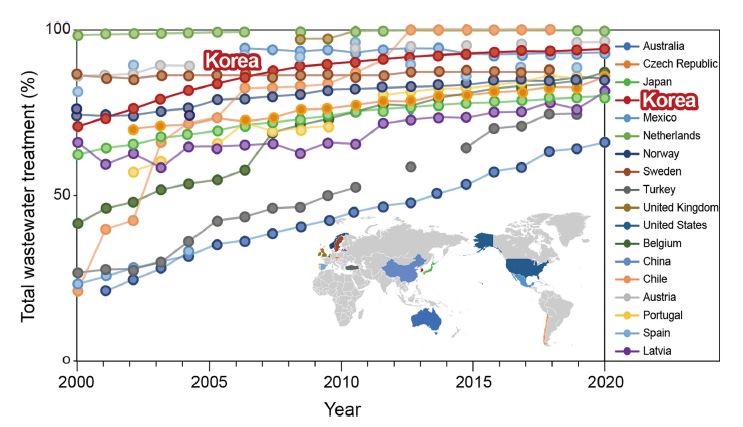
The amount percentage of treated wastewater from total generated amounts as total wastewater treatment (%) for 18 counties (OECD [2021]).
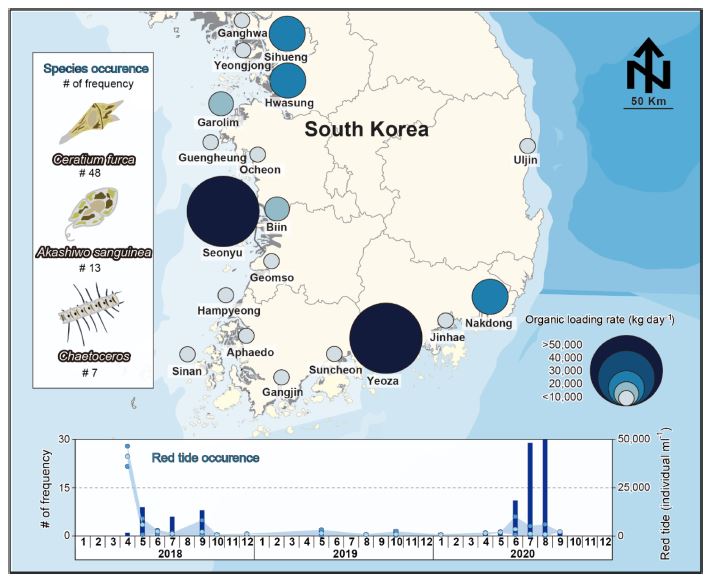
Spatiotemporal variation of organic loading rates and red tide occurrence across the entire coastline of South Korea. Total organic loading rates across the Korean Peninsula are presented on the map. Size and color correspond to the amount of organic loading rates. The number of frequencies of a) species occurred (dots) and b) red tide events (bars) are shown.

Spatial variation of industrial and municipal wastewater generated amount across South Korea, between 2018-2020 (KOSIS[2019])
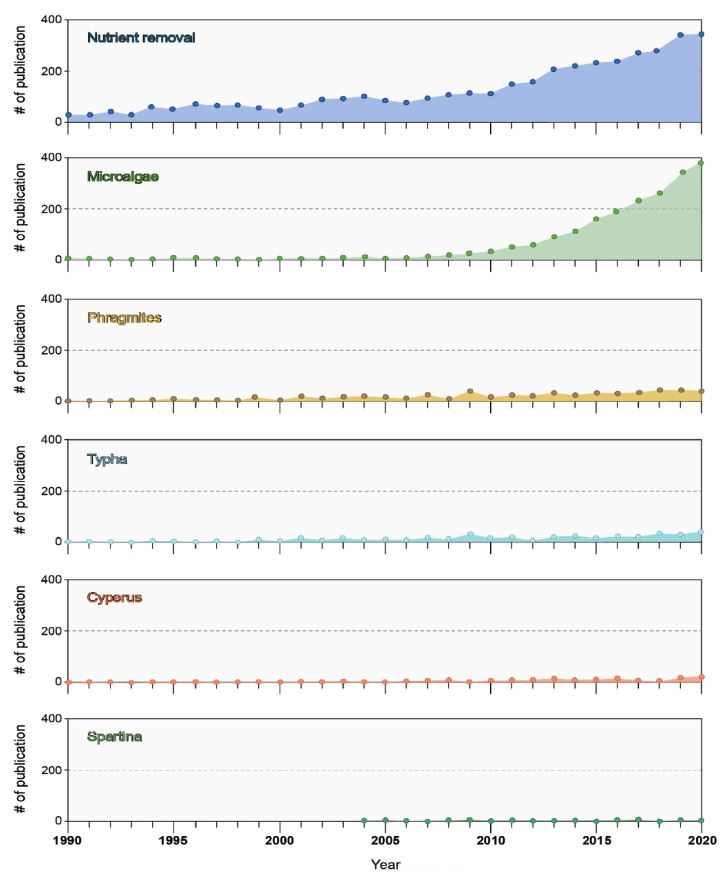
Scopus 검색을 통해 1990년부터 2020년까지 발간된 연구논문중 염생식물의 총 질소, 총 인, 화학적 산소 요구량 제거율을 제시하는 46편의 문헌을 수집하였다. 검색 키워드는 “Nutrient removal”, “Phragmites”, “Spartina”, “Microalgae”, “Typha”, “Cyperus”를 이용하였다. 해당 데이터는 염생식물 종에 따른 연구 문헌 수를 비교하는데 활용하였고(Fig. 4, Table 2), 국내 대표적인 염생식물(갈대, 갯끈풀) 및 일차생산자(해조류, 저서미세조류)의 정화효율 및 질소순환을 모식화 하는데 활용하였다(Fig. 5).
2.2 자료 분석
VOS 뷰어 소프트웨어(van Eck and Waltman[2010])를 이용하여 키워드 네트워크 분석을 수행하였다. 이를 통해 1990년과 2020년의 유기물 정화 분야 연구 동향을 시각화하여 직관적으로 비교하고자 하였다. 키워드는 “Wastewater treatment”, “nutrient removal”를 사용하였다.
3. 결과 및 고찰
3.1 국내 유기물 발생량 및 해안 적조 발생 빈도
OECD[2021]에서 제시한 폐수 처리 자료를 통해 2000년부터 2020년까지 전 세계 국가별 총 폐수 처리효율을 확인하였다(Fig. 1). 우리나라의 경우 2000년에는 총 폐수처리율이 70%로 미국과 노르웨이 등과 유사한 수준이었다. 이 수치는 점차 증가하여 2019년 국내 폐수처리율은 94%로 네덜란드(99%), 룩셈부르크(99%), 호주(96%) 다음으로 높게 나타났다. 총 폐수의 높은 처리율에도 불구하고 총 폐수 발생량과 방류량 또한 높은 수준이다. 전세계 폐수처리 현황을 평가한 연구에 따르면 연간 환경으로 유입되는 미처리 폐수량은 남아시아 및 동남아시아 전역에서 가장 높게 나타났고 한국도 높은 수준으로 나타났다(Jones et al.[2021]). 국내 자료에 따르면, 2019년도에만 폐수 발생량과 방류량이 각각 4,755,000 m3 day-1과 3,866,000 m3 day-1로 나타났다(National Statistics[2021]). OECD[2021]에서 제시한 폐수처리 자료만으로 폐수처리 시스템 내에서 미처리된 물질의 양과 불법으로 방류되는 폐수량을 파악하는데 한계가 있기 때문에 국내 연안으로 여전히 많은 양의 폐수가 유입될 것으로 예상된다.
KOSIS[2019] 자료에 의하면 국내 폐수 발생량이 가장 높은 지역은 경기도(402,069 kg day-1)로 나타났고 가장 낮은 지역은 제주도(6,570 kg day-1)였다. 폐수처리 시설은 경기도(14,132 개소)와 경상남도(4,728 개소)에 가장 많은 것으로 나타났다(Table 1). 실제로 경기도 지역에서 유기물 함량이 높게 나타났으며(Lee et al.[2021]), 경기 지역 내 미처리된 폐수의 유입이 원인일 것으로 판단된다. 마산만, 여자만, 낙동강 하구는 산업시설 근처에 위치하며 유입된 폐수가 강을 통해 연안으로 유입되면서 상대적으로 높은 유기물 함량을 보인다(Kim et al.[2019]; Lee et al.[2019]).
유기물 방류량과 적조 발생의 연관성을 파악하기 위하여 국내 지역별 유기물 방류량과 적조발생 빈도 및 규모를 함께 확인하였다(Fig. 2). 적조 발생 우점종은 Ceratium furca(총 48회), Akashiwo sanguinea(총 13회), Chaetoceros sp.와 Noctiluca sp.(각 7회) 순으로 나타났다. 2020년에는 지난 2년에 비해 적조가 더 많이 발생하였고 수온이 높고 육상 기원의 유기물 유입이 높은 봄철(3월-5월)과 여름철(6월-9월)에 주로 발생하였다(You and Kim[1999]). 지역적으로 남해안에 위치한 전남과 경남에서 적조가 주로 발생하였는데 이는 높은 수온과 유기물 유입이 높기 때문으로 판단된다(Lee and Choi[2009]). 그러나 서해안의 선유도는 높은 유기물 유입에도 불구하고 적조가 거의 발생하지 않았는데 이 이유는 넓게 발달된 조차(최대 9 m) 및 수온차이 때문으로 보인다([Lee et al.[2020]).
3.2 유기물 정화 논문의 시공간적 변화(1990년-2020년)
1990년에는 크게 3가지 그룹으로 나뉘었다(Fig. 3a). 그룹 A(영양염 제거)의 주요 키워드는 “영양염 제거”, “폐수 처리”, “폐수 처리 관리”, “영양염”이며 주로 폐수 내 영양염을 제거하는 설비 구축을 위한 연구가 수행되었다. 그룹 B(하수 처리)의 주요 키워드는 “하수 처리”, “폐수처리장”, “인”, “질소”로 나타났고 그룹 C(활성 슬러지)의 주요 키워드는 “활성 슬러지”, “질소 제거”, “인 제거”, “하수종말 처리장”으로 나타났다. 3가지 그룹의 키워드를 종합하였을 때 1990년에는 무분별한 산업화로 인해 발생하는 산업폐수의 처리시설이 주요 연구대상인 것으로 보인다.
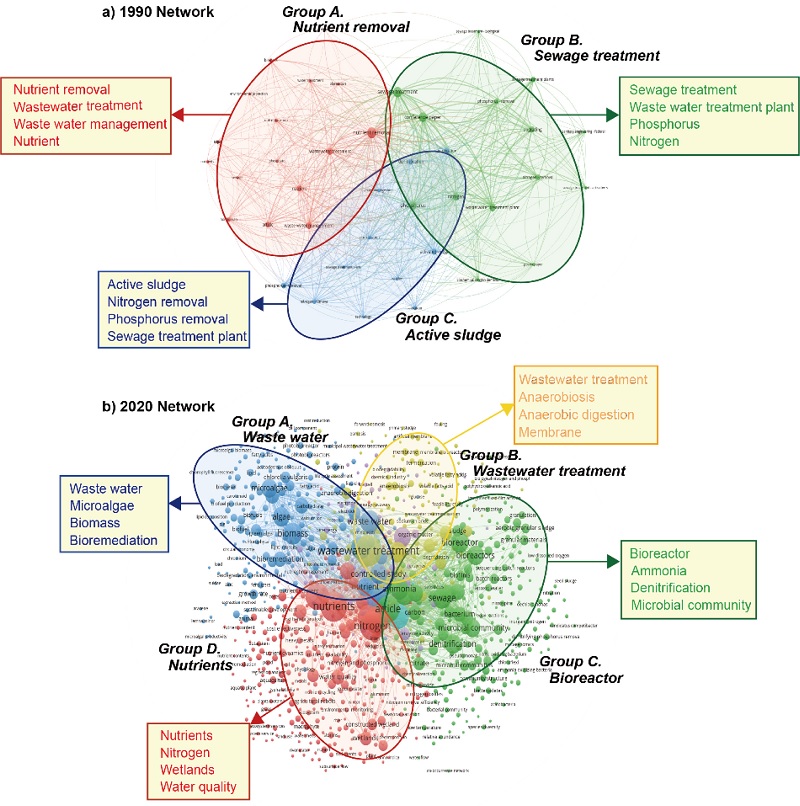
Keyword network-based analysis between 1990 and 2020. The size of the nodes corresponds to the frequency of occurrence. The curves represent the strength of networks between keywords. Each color represents a distinctive group, top keywords for each group are presented in the order of high occurrence.
2020년에는 크게 4가지 그룹으로 나뉘었다(Fig. 3b). 그룹 A(폐수)의 주요 키워드는 “폐수”, “저서미세조류”, “생물량”, “생물적 환경 정화”이며 주로 저서미세조류의 질소 처리에 대한 연구로 보인다. 그룹 B(폐수 처리)의 주요 키워드는 “폐수 처리”, “혐기성 생활”, “혐기성 소화”, “세포막”으로 나타났고, 그룹 C(생물 반응)의 주요 키워드는 “생물 반응”, “암모니아”, “탈질화”, “미생물 군집”으로 나타났다. 그룹 D(영양염)의 주요 키워드는 “영양염”, “질소”, “염습지”, “수질”로 인공습지의 자연정화에 대한 연구가 활발하게 이루어졌다. 4가지 그룹의 키워드를 종합하였을 때 2020년에는 주로 염생식물 및 일차생산자의 유기물 분해에 초점을 맞춘 연구가 활발하게 이루어진 것으로 보인다. 특히, 해양공간에 대한 연구가 선진국 중심으로 관심이 증가하고 있으며 염습지의 수질 정화에 대한 연구가 활발하게 진행되고 있다.
문헌 조사를 통해 1990년부터 2020년까지의 국내·외 저서미세 조류와 염생식물의 영양염 제거율에 대한 논문을 분석하였다(Fig. 4). 영양염 제거율에 대한 전체 논문은 2000년대 후반부터 수가 늘어났으며 저서미세조류에 대한 논문 연구는 2010년 이후로 급격히 증가하였다. 갈대와 부들은 다른 염생식물에 비해 상대적으로 많은 연구가 진행되었으나 저서미세조류에 대한 연구보다는 훨씬 낮은 수준이었다. 2000년 초반에 생활폐수 속 혐기성 암모늄 산화 세균이 질소화합물을 분해한다는 것이 보고되면서 해양생태계 내 탈질화 및 영양염 제거로 확대하는 연구가 시작되었다. 연안지역에서는 해초(seagrass), 대형조류 층(macroalgal mat), 저서미세조류(microphytobenthos)와 같은 일차생산자가 주요한 질소 흡수원으로 보고되었다(McGlathery et al.[2004]; Thamdrup and Dalsgaard[2002]). 강하구와 갯벌에서 일차생산의 50% 이상을 차지하는 저서미세조류의 질소 흡수와 침적에 대한 관심이 높아지면서 이와 같은 일차생산자에 대한 관심 또한 높아지고 있다. 염생식물에 대한 연구는 염습지에 주로 서식하는 갈대와 부들에 치우쳐 있어 염생 식물 내에 서식하는 다른 식생에 대한 연구가 수행될 필요가 있다.
3.3 해양환경 내 주요 일차생산자들의 유기물 정화 비교
문헌 조사를 통해 1990년부터 2020년까지 보고된 염생식물의 총 질소, 총 인, 화학적 산소 요구량 제거율에 대한 논문을 분석하였다(Table 2). 총 질소의 제거율은 갯끈풀(28-99%)과 비식생 갯벌(17-97%) 순으로 높게 나타났다. 암모늄은 모든 염생식물에서 90%이상 제거되었으며 질산염은 갈대에서 가장 높은 제거율(50-85%)을 보였다. 총 인의 제거율은 갈대 서식지(0-99%)에서 가장 높게 나타났으며 화학적 산소 요구량의 제거율은 총 인과 비슷한 결과로 갈대에서 가장 높은 최대 제거율(1-98%)을 보였다.
국내 연안환경을 대표하는 염생식물(갈대와 갯끈풀) 그리고 일차생산자(저서미세조류와 해초)를 선택하여 질소 제거 및 질소순환을 모식화하고 영양염의 제거율을 비교하였다(Fig. 5). 국내 고유종인 갈대는 국내 조간대에 서식하는 고유 염생식물 종으로 1 m이상 깊게 뿌리를 내리며 상부 조간대에 서식한다(Fig. 5a). 갈대는 모든 오염 물질에서 다른 염생식물 대비 상대적으로 높은 최대 제거율(총 질소: 86%, 총 인: 99%, 화학적 산소 요구량: 98%)을 보였다. 특히 갈대는 총 인 제거(최대: 99%)가 다른 종에 비해 더 효과적인 것으로 보인다(Fig. 5a; Table 2).
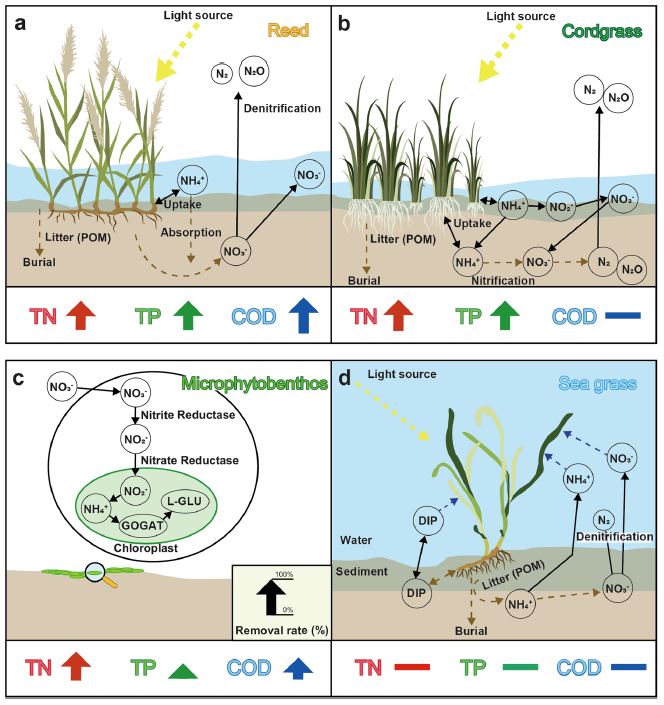
Representation of nutrient processes for (a) reed, (b) cordgrass, (c) microphytobenthos, (d) sea grass. Arrows (black) represent the direction of nutrient flow. Large arrows below each scheme shows the nutrient efficiency based on the review; Total nitrogen (TN) as red, Total phosphorus (TP) as green and Chemical oxygen demand (COD) as blue. Bars indicate no data available. For visualization refer to the online version of the paper.
반면 생태계 교란종으로 지정된 갯끈풀은 높은 번식력과 강한 뿌리 밀집도를 보이며, 초기 발생지인 강화도 갯벌과 전남 진도에 가장 많이 분포하는 것으로 보고되었다(Kim and Kim[2019]). 갯끈풀은 어떤 환경변화(온도, 염분, 영양염 등)에도 높은 성장율을 보이며 빠른 번식력으로 생태계 교란종의 대표적인 특징을 보여준다. 갯끈풀 또한 갈대와 유사한 수준의 높은 총 질소 제거율을 보이지만 다른 오염물질에 대한 제거율은 보고되지 않고 있다(Fig. 5b; Table 2). Rickey and Anderson[2004]의 연구에 따르면 갈대는 영양염 증가에 따라 더 높은 생물량을 보인 반면, 갯끈풀은 높은 영양염 농도에도 생물량에 큰 차이를 보이지 않았다. 또한 해당 연구에서는 갈대는 증가된 질소로부터 영양염을 공급받아 성장하며 질소 농도가 높은 환경에서 갯끈풀을 대체할 가능성이 높다고 제시했다. 국내 갯벌에서 갯끈풀의 유기물 저장에 대한 긍정적 측면의 연구결과가 제시된 바 있으나(Lee et al.[2019]) 오염물질 정화 측면에서 그 가치를 평가하기에는 더 많은 연구가 필요할 것으로 보인다.
저서미세조류의 유기물 정화율은 일차생산자 중 가장 잘 알려져 있다(Fig. 4; Fig. 5c). 저서미세조류은 영양소와 주변 환경에 따라 성장률, 번식률 및 생산량이 달라진다(Kwon et al.[2018]). 또한 저서미세조류는 다양한 해양 환경에서 발견되는 일차생산자로 성장을 위한 에너지원으로 빛과 이산화탄소, 질소, 인이 필요하다(Kwon et al.[2018]; Rimmer and Shorttle[2019]). 저서미세조류는 광합성을 통해 성장에 필요한 케토산, ATP, NADPH와 같은 생체 분자를 생성하나(Fernandez and Galvan[2007]), 성장에 필요한 영양분을 선택할 수 있는 저서미세조류 종 수는 제한되어 있다. 기존 연구에 따르면 독립 영양 상태에서 저서미세조류가 성장하면 케토산이 감소하지만 종속 영양 조건과 질소 기아 상태에서는 크게 증가한다(Perez-Garcia et al.[2011]). 이처럼 저서미세조류를 통한 질소 기작은 다양한 형태로 이루어진다(Fig. 5c).
해초는 대체로 해수면이 얕고 영양이 제한된 해안 생태계에서 서식하는 일차생산자이다(McGlathery et al.[2007]). 해초는 질소 고정과 불활성 질소 가스를 사용 가능한 형태로 전환하는 등 총 질소 수요의 상당한 부분에 기여하는 것으로 알려져 있다(Cole and McGlathery[2012]). 해초는 다른 육상식물 및 해조류와 다르게 주로 잎과 뿌리를 통해 영양염을 흡수하며, 잎을 통한 정화가 상당한 부분을 차지한다 (Pedersen et al.[1997]). 또한 퇴적물에 해초 조직이 침적되면서 퇴적물 내 유기물질의 주 공급원 역할을 한다(Lee et al.[2007]). 따라서 해초는 연안생태계에 중요한 구성 요소로 평가되고 있으나, 해초의 유기물 제거능력에 대한 연구는 아직 보고되어 있지 않았으며 추후 연구가 필요하다(Fig. 5b).
4. 결 론
본 연구에서는 갯벌 및 염습지 환경에서 유기물질의 제거효율에 대해 고찰하였다. 국내 연안환경의 오염현황을 파악하였고, 갯벌과 염습지에서 일차생산을 담당하는 저서미세조류, 해초, 염생식물 등의 정화효율을 비교 분석하였다. 그 결과, 갈대 군락지에서 총 인과 화학적 산소요구량이 가장 많이 제거되는 것으로 확인되었고, 총 질소의 경우 갯끈풀 군락지에서 최대 제거효율을 보였다. 한편, 현재까지 염생식물의 유기물 정화능력에 관한 국내 연구는 갈대에 국한되어 있어, 향후 다양한 염생식물에 대한 연구가 시급하다. 나아가 염생식물 및 그 주변서식지의 유기물 거동 프로세스에 대한 규명을 통해 연안환경의 정화 능력과 조절서비스 가치에 대한 종합적 평가가 매우 중요하다. 본 연구 결과는 향후 훼손된 갯벌 및 염습지 환경의 복원과 생태계서비스 증진을 위한 기초자료로 활용될 것으로 기대된다.
Acknowledgments
본 연구는 2017년 해양수산부 재원으로 “생태계기반 해양공간분석 및 활용기술 개발(과제 번호: 20170325)” 지원을 받아 수행하였습니다.
References
-
Abdelhakeen, S.G., Aboulroos, S.A. and Kamel, M.M., 2016, Performance of a vertical subsurface flow constructed wetland under different operational conditions, J. Advance Res., 7, 803-814.
[https://doi.org/10.1016/j.jare.2015.12.002]

-
Abdel-Shafy, H.I., El-Khateeb, M.A., Regelsberger, M., El-Sheikh, R. and Shehata, M., 2009, Integrated system for the treatment of blackwater and greywater via UASB and constructed wetland in Egypt. Desalin. Water Treat, 8(1-3), 272-278.
[https://doi.org/10.5004/dwt.2009.788]

-
Ahmed, S., Popov, V. and Trevedi, R.C., 2008, Constructed wetland as tertiary treatment for municipal wastewater. J. Waste Res. Manag, 161(2), 77-84.
[https://doi.org/10.1680/warm.2008.161.2.77]

-
Ávila, C., Salas, J.J., Martín, I., Aragón, C. and García, J., 2013, Integrated treatment of combined sewer wastewater and stormwater in a hybrid constructed wetland system in southern Spain and its further reuse. Ecol. Eng, 50, 13-20.
[https://doi.org/10.1016/j.ecoleng.2012.08.009]

-
Bilkovic, D.M., Mitchell, M.M., Isdell, R.E., Schliep, M. and Smyth, A.R., 2017, Mutualism between ribbed mussels and cordgrass enhances salt marsh nitrogen removal. Open Access Ecosphere, 8(4), 01795.
[https://doi.org/10.1002/ecs2.1795]

-
Bojcevska, H. and Tonderski, K., 2007, Impact of loads, season, and plant species on the performance of a tropical constructed wetland polishing effluent from sugar factory stabilization ponds, Ecol. Eng, 29(1), 66-76.
[https://doi.org/10.1016/j.ecoleng.2006.07.015]

-
Bouchard, V., Lefeuvre, J.C., 2000, Primary production and macro-detritus dynamics in a European salt marsh: carbon and nitrogen budgets, Aquat. Bot, 67(1), 23-42.
[https://doi.org/10.1016/S0304-3770(99)00086-8]

-
Brin, L.D., Valiela, I., Goehringer, D. and Howes, B., 2010, Nitrogen interception and export by experimental salt marsh plots exposed to chronic nutrient addition. Mar. Eco. Prog. Ser, 400, 3-17.
[https://doi.org/10.3354/meps08460]

- Chapman, J.V., 1960, Salt marshes and salt desert of the world. Leonard Hill books. Ltd. London, p. 392.
-
Chen, T.Y., Kao, C.M., Yeh, T.Y., Chien, H.Y. and Chao, A.C., 2006, Application of a constructed wetland for industrial wastewater treatment: A pilot-scale study, Chemosphere, 64(3), 497-502.
[https://doi.org/10.1016/j.chemosphere.2005.11.069]

-
Chmura, G.L., Anisfeld, S.C., Cahoon, D.R. and Lynch, J.C., 2003, Global carbon sequestration in tidal, saline wetland soils, Glob. Biogeochem. Cycles, 17(4), 1111.
[https://doi.org/10.1029/2002GB001917]

-
Cole, L.W. and McGlathery, K.J., 2012, Nitrogen fixation in restored eelgrass meadows, Mar. Ecol. Prog. Ser, 448, 235-246.
[https://doi.org/10.3354/meps09512]

-
Deegan, L.A., Johnson, D.S., Warren, R.S., Peterson, B.J., Fleeger, J.W., Fagherazzi, S. and Wollheim, W.M., 2012, Coastal eutrophication as a driver of salt marsh loss, Nature, 490, 388-394.
[https://doi.org/10.1038/nature11533]

-
Fernandez, E. and Galvan, A., 2007, Inorganic nitrogen assimilation in Chlamydomonas, J. Exp. Bot, 58, 2279-2287.
[https://doi.org/10.1093/jxb/erm106]

-
Galloway, J.N., Townsend, A.R., Erisman, J.W., Bekunda, M., Cai, Z., Freney, J.R., Martinelli, L.A., Seitzinger, S.P. and Sutton, M.A., 2008, Transformation of the nitrogen cycle: recent trends, questions, and potential solutions, Science, 320, 889-892.
[https://doi.org/10.1126/science.1136674]

-
Green, M., Safray, I. and Agami, M., 1996, Constructed wetlands for river reclamation: experimental design, start-up and preliminary results. Bioresource Technology, 55, 157-162.
[https://doi.org/10.1016/0960-8524(95)00164-6]

-
Greenway, M., 2005, The role of constructed wetlands in secondary effluent treatment and water reuse in subtropical and arid Australia, Ecol. Eng, 25(5), 501-509.
[https://doi.org/10.1016/j.ecoleng.2005.07.008]

-
He, L.S., Liu, H.L., Xi, B.D. and Zhu, Y.B., 2006, Effects of effluent recirculation in vertical flow constructed wetland on treatment efficiency of livestock wastewater. Water Sci. Technol, 54(11-12), 137-146.
[https://doi.org/10.2166/wst.2006.845]

-
Hsu, C.-B., Hsieh, H.-L., Yang, L., Ho, Y.-S. and Lin, H.-J., 2011, Biodiversity of constructed wetlands for wastewater treatment, Ecol. Eng, 37(10), 1533-1545.
[https://doi.org/10.1016/j.ecoleng.2011.06.002]

-
Jinadasa, K.B.S.N., Tanaka, N., Mowjood, M.I.M. and Werellagama, D.R.I.B., 2006, Free water surface constructed wetlands for domestic wastewater treatment: A tropical case study, Chem. Ecol, 22(3), 181-191.
[https://doi.org/10.1080/02757540600658849]

-
Jones, E.R., van Vliet, M.T.H., Qadir, M. and Bierkens, M.F.P., 2021, Country-level and gridded estimates of wastewater production, collection, treatment and reuse, Earth Syst. Sct. Data, 13, 237-254.
[https://doi.org/10.5194/essd-13-237-2021]

-
Katsenovich, Y.P., Hummel-Batista, A., Ravinet, A.J. and Miller, J.F., 2009, Performance evaluation of constructed wetlands in a tropical region, Ecol. Eng, 35(10), 1529-1537.
[https://doi.org/10.1016/j.ecoleng.2009.07.003]

-
Kim, T., Noh, J., Kwon, B.-O., Lee, C., Kim, B., Kwon, I., Hong, S., Chang, G.S., Chang, W.K., Nam, J. and Khim, J.S., 2020, Natural purification capacity of tidal flats for organic matters and nutrients: A mesocosm study, Mar. Pollut. Bull, 154, 11046.
[https://doi.org/10.1016/j.marpolbul.2020.111046]

- Korean Statistical Information Service (KOSIS), Environment, https://kosis.kr/statisticsList/statisticsListIndex.do?vwcd=MT_ZTITLE&menuId=M_01_01&outLink=Y&entrType=#content-group, , 2019 (Accessed on 04 July 2021).
-
Klomjek, P. and Nitisoravut, S., 2005, Constructed treatment wetland: a study of eight plant species under saline conditions, Chemosphere, 58(5), 585-593.
[https://doi.org/10.1016/j.chemosphere.2004.08.073]

-
Koh, C.H. and Khim, J.S., 2014, The Korean tidal flat of the Yellow Sea: Physical setting, ecosystem and management, Ocean Coast. Manage, 102, 398-414.
[https://doi.org/10.1016/j.ocecoaman.2014.07.008]

-
Kwon, B.-O., Kim, H.-C., Koh, C.H., Ryu, J., Son, S.H., Kim, Y.H. and Khim, J.S., 2018, Development of temperature-based algorithms for the estimation of microphytobenthic primary production in a tidal flat: A case study in Daebu mudflat, Korea, Environ. Pollut, 241, 115-123.
[https://doi.org/10.1016/j.envpol.2018.05.032]

-
Lee, J., Kim, B., Noh, J., Lee, C., Kwon, I., Kwon, B.-O., Ryu, J., Park, J., Hong, S., Lee, S., Kim, S.-G., Son, S., Yoon, H.J., Yim, J., Nam, J., Choi, K. and Khim, J.S., 2021, The first national scale evaluation of organic carbon stocks and sequestration rates of coastal sediments along the West Sea, South Sea, and East Sea of South Korea, Sci. Total Environ, 793, 148568.
[https://doi.org/10.1016/j.scitotenv.2021.148568]

-
Lee, J., Kwon, B.-O., Kim, B., Noh, J., Hwang, K., Ryu, J., Park, J., Hong, S. and Khim, J.S., 2019, Natural and anthropogenic signatures on sedimentary organic matters across varying intertidal habitats in the Korean waters, Environ. Int, 133, 105166.
[https://doi.org/10.1016/j.envint.2019.105166]

-
Lee, K.-S., Park, S.R. and Kim, Y.K., 2007, Effects of irradiance, temperature, and nutrients on growth dynamics of seagrass: A review. J. Exp. Mar. Biol. Ecol. 350, 144-175.
[https://doi.org/10.1016/j.jembe.2007.06.016]

- Lee, M.O. and Choi, J.H., 2009, Distributions of water temperature and salinity in the Korea Southern coastal water during Cochlodinium polykrikoides blooms, J. Korean. Soc. Mar. Environ. Energy, 12(4), 235-247.
-
Lee, M.O., Kim, J.K., Kim, B.K. and Kim, M.W., 2020, Past, present, and future directions in the study of Jinhae Bay, Korea, J. Korean Soc. Mar. Environ. Energy, 23(2), 57-69.
[https://doi.org/10.7846/JKOSMEE.2020.23.2.57]

-
Maine, M.A., Suñe, N., Hadad, H. and Sánchez, G., 2007, Temporal and spatial variation of phosphate distribution in the sediment of a free water surface constructed wetland, Sci. Total Environ, 380(1-3), 75-83.
[https://doi.org/10.1016/j.scitotenv.2006.11.036]

-
Martín, M., Oliver, N., Hernández-Crespo, C., Gargallo, S. and Regidor, M.C., 2013, The use of free water surface constructed wetland to treat the eutrophicated water of lake L'Albufera de Valencia (Spain), Ecol. Eng, 50, 52-61.
[https://doi.org/10.1016/j.ecoleng.2012.04.029]

-
Mburu, N., Tebitendwa, S.M., Rousseau, D.P.L., van Bruggen, J.J.A. and Lens, P.N.L., 2013, Performance evaluation of horizontal subsurface flow-constructed wetlands for the treatment of domestic wastewater in the tropics, J. Environ. Eng, 139(3), 358-367.
[https://doi.org/10.1061/(ASCE)EE.1943-7870.0000636]

-
McCarthy, M., Lavrentyev, P., Yang, L., Zhang, L., Chen, Y., Qin, B. and Gardner, W., 2007, Nitrogen dynamics and microbial food web structure during a summer cyanobacterial bloom in a subtropical, shallow, well-mixed, eutrophic lake (Lake Taihu, China), In: Qin, B., Liu, Z., Havens, K. (Eds.), Eutrophication of Shallow Lakes with Special Reference to Lake Taihu, China. Developments in Hydrobiology Springer Netherlands, pp. 195-207.
[https://doi.org/10.1007/978-1-4020-6158-5_22]

-
Mcglathery, K., Sundback, K. and Anderson, I.C., 2004, The importance of primary producers for benthic nitrogen and phosphorus cycling, In: S. L. Nielsen, B. T. Banta, and M. F. Pedersen (eds.), The Influence of Primary Producers on Estuarine Nutrient Cycling. Dordrecht, The Netherlands, 231-261.
[https://doi.org/10.1007/978-1-4020-3021-5_9]

-
Mcleod, E., Chnura, G.L., Bouillon, S., Salm, R., Björk, M., Duarte, C.M., Lovelock, C.E., Schlesinger, W.H. and Silliman, B.R., 2011, A blueprint for blue carbon: toward an improved understanding of the role of vegetated coastal habitats in sequestering CO2, Front. Ecol. Environ, 9(10), 552-560.
[https://doi.org/10.1890/110004]

-
Middelburg, J.J., Nieuwenhuize, J., Lubberts, R.K. and van de Plassche, O., 1997, Organic carbon isotope systematics of coastal marshes, Estuar. Coast. Shelf Sci, 45, 681-687.
[https://doi.org/10.1006/ecss.1997.0247]

- National Statistics, 2021, Industrial wastewater occurrence and treatment, http://www.me.go.kr/home/web/policy_data/read.do?pagerOffset=0&maxPageItems=10&maxIndexPages=10&search-Key=&searchValue=&menuId=10276&orgCd=&condition.toInpYmd=null&condition.fromInpYmd=null&condition.orderSeqId=7753&condition.rnSeq=17&condition.deleteYn=N&condition.deptNm=null&seq=7754, (Accessed on 10 November 2021).
-
Nielsen, K., NIELSEN, L.P. and Rasmussen, P., 1995, Estuarine nitrogen retention independently estimated by the denitrification rate and mass balance methods: A study of Norsminde Fjord, Denmark, Mar. Ecol. Prog. Ser, 119, 275-283.
[https://doi.org/10.3354/meps119275]

- Pedersen, M.F., Nielsen, S.L. and Banta, G.T., 2004, Interactions between vegetation and nutrient dynamics in coastal marine ecosystems: an introduction. In: Nielsen, S.L., Banta, G.T., Pedersen, M.F. (Eds.), Estuarine Nutrient Cycling: The Influence of Primary Producers. Kluwer Academic Publishers, Dordrecht, 1-15.
-
Pedersen, M.F., Paling, E.I. and Walker, D.I., 1997, Nitrogen uptake and allocation in the seagrass Amphibolis antartica. Aquat. Bot. 6, 105-117.
[https://doi.org/10.1016/S0304-3770(96)01100-X]

- OECD, Waste water treatment, https://data.oecd.org/water/waste-water-treatment.htm, , 2021 (Accessed on 05 July 2021).
-
Perez-Garcia, O., Escalante, F.M., de Bashan, L.E. and Bashan, Y., 2011, Heterotrophic cultures of microalgae: metabolism and potential products, Water Res, 45, 11-36.
[https://doi.org/10.1016/j.watres.2010.08.037]

-
Reed, S.C., Middlebrooks, E.J. and Crites, R.W., 1995, Natural Systems for Waste Management and Treatment. New York: McGraw-Hill. Spiels, D.J., and Mitsch, W.J., 2000, The effects of seasons and hydrologic and chemical loading on nitrate retention in constructed wetlands: a comparison of low-and high nutrient riverine systems. Eco. Eng, 14, 77-91.
[https://doi.org/10.1016/S0925-8574(99)00021-X]

-
Rickey, M.A. and Anderson, R.C., 2004, Effects of nitrogen addition on the invasive grass Phragmites australis and a native competitor Spartina pectinate, J. Appl. Ecol, 41, 888-896.
[https://doi.org/10.1111/j.0021-8901.2004.00948.x]

-
Rimmer, P.B. and Shorttle, O., 2019, Origin of life’s building blocks in carbon-and nitrogen rich surface hydrothermal vents, Life, 9(1), 12.
[https://doi.org/10.3390/life9010012]

-
Shepard, C.C., Crain, C.M. and Beck, M.W., 2011, The protective role of coastal marshes: a systematic review and meta-analysis, PLoS ONE, 6(11), e27374.
[https://doi.org/10.1371/journal.pone.0027374]

-
Suddick, E.C., Whitney, P., Townsend, A.R. and Davidson, E.A., 2013, The role of nitrogen in climate change and the impacts of nitrogen–climate interactions in the United States: foreword to thematic issue, Biogeochem, 114, 1-10.
[https://doi.org/10.1007/s10533-012-9795-z]

-
Tanner, C.C. and Headley, T.R., 2011, Components of floating emergent macrophyte treatment wetlands influencing removal of stormwater pollutants, Ecol. Eng, 37(3), 474-486.
[https://doi.org/10.1016/j.ecoleng.2010.12.012]

-
Thamdrup, B. and Dalsgaard, T., 2002, Production of N2 through anaerobic ammonium oxidation coupled to nitrate reduction in marine sediments, App. Environ. Microbiol, 68, 1312-1318.
[https://doi.org/10.1128/AEM.68.3.1312-1318.2002]

-
Trang, N.T.D., Konnerup, D., Schierup, H., Chiem, N.H., Tuan, L.A. and Brix, H., 2010, Kinetics of pollutant removal from domestic wastewater in a tropical horizontal subsurface flow constructed wetland system: effect of hydraulic loading rate, Ecol. Eng, 36(4), 527-535.
[https://doi.org/10.1016/j.ecoleng.2009.11.022]

-
Tsihrintzis, V.A., Akratos, C.S., Gikas, C.D., Karamouzis, D. and Angelakis, A.N., 2010, Performance and cost comparison of a FWS and a VSF constructed wetland system, Environ. Technol, 28(6), 621-628.
[https://doi.org/10.1080/09593332808618820]

-
van Eck, N.J., Waltman, L., 2010, Software survey: VOSviewer, a computer program for bibliometric mapping, Scientometrics, 84, 523-538.
[https://doi.org/10.1007/s11192-009-0146-3]

-
Yousaf, A., Khalid, N., Aqeel, M., Noman, A., Naeem, N., Sarfraz, W., Ejaz, U., Qaiser, Z. and Khalid, A., 2021, Nitrogen dynamics in wetland systems and its impact on biodiversity, Nitrogen, 2, 196-217.
[https://doi.org/10.3390/nitrogen2020013]

- You, S.J. and Kim, J.G., 1999, Evaluation on the purification capacity of pollutants in the Tidal Flat, J. Korean Fish. Soc, 32(4), 409-415.