서태평양 해저산 해역에서 수괴와 무기영양염 거동에 기초한 동적 수층환경 특성
초록
서태평양에 위치한 해저산 해역(150.2°E, 20°N 부근)에서 수층 환경의 동적 특성을 파악하고자 수괴 및 용존산소, 무기영양염(질소, 인), 엽록소-a 등과 같은 수층 환경 인자의 거동을 살펴보았다. 2014년 10월에 해저산(OSM14-2)을 중심으로 동-서 및 남-북 방향으로 총 9개의 정점에서 CTD system을 이용하여 물리·화학적 자료를 획득하였다. 수온-염분 도표로부터 연구 해역에서 파악된 수괴는 표층에서 북태평양 열대수와 수온약층수, 중층에서 북태평양 중층수 그리고 저층에서 북태평양 심층수로 구분되었다. 용존산소 농도가 낮은 최소층(평균 73.26 μM)은 산소 결핍 환경(dysoxic<90μM)으로 연구 해역 전반에 걸쳐 수심 700~1,200 m 사이에 분포하였다. 아질산염+질산염과 인산염으로 대표되는 무기 영양염은 표면혼합층 내에서 빈영양 환경을 보인 후 수심 증가에 따라 점차적으로 증가해 용존산소 최소층에서 최대 농도를 나타냈으며, N:P ratio(13.7) 결과로부터 연구 해역은 식물플랑크톤이 성장하기에 질소 성분이 제한된 환경으로 파악되었다. 해저산을 중심으로 동-서 및 남-북 정점 라인에서 환경 인자의 수직 분포는 서쪽과 남쪽 해역에서 저층수 유입에 의한 영향으로 수심 500 m 부근에서 그리고 수심 2,500 m 이하의 저층 내에서도 서쪽 해역과 남쪽 해역에서 반대 해역과 비교해 환경 인자의 농도가 다르게 분포하였다. Redfield ratio(N:P=16:1)을 이용하여 구해진 Excess N 값은 연구 해역 전반에 걸쳐 음의 값을 보여 질소 제거 기작이 우세한 환경임을 나타냈으며, 서쪽 해역과 남쪽 해역 저층에서 상대적으로 높은 값이 관측되었다. 이러한 결과들은 해저산의 지형적인 특성이 저층 해류 순환에 영향을 미치고 이는 수층 환경 인자들의 거동을 결정하는데 중요하게 작용함을 지시한다.
Abstract
In order to understand the dynamic characteristics of water column environments in the Western Pacific seamount area (approximately 150.2°E, 20°N), we investigated the water mass and the behavior of water column parameters such as dissolved oxygen, inorganic nutrients (N, P), and chlorophyll-a. Physico-chemical properties of water column were obtained by CTD system at the nine stations which were selected along the eastwest and south-north direction around the seamount (OSM14-2) in October 2014. From the temperature-salinity diagram, the main water masses were separated into North Pacific Tropical Water and Thermocline Water in the surface layer, North Pacific Intermediate Water in the intermediate layer, and North Pacific Deep Water in the bottom layer, respectively. Oxygen minimum zone (OMZ, mean O2 73.26 μM), known as dysoxic condition (O2 < 90 μM), was distributed in the depth range of 700~1,200 m throughout the study area. Inorganic nutrients typified by nitrite + nitrate and phosphate showed the lowest concentration in the surface mixed layer and then gradually increased downward with representing the maximum concentration in the OMZ, with lower N:P ratio (13.7), indicating that the nitrogen is regarded as limiting factor for primary production. Vertical distribution of water column parameters along the east-west and south-north station line around the seamount showed the effect of bottom water inflowing at around 500 m deep in the western and southern region, and concentrations of water column parameters in the bottom layer (below 2,500 m deep) of the western and southern region were differently distributed comparing to those of the other side regions (eastern and northern). The value of Excess N calculated from Redfield ratio (N:P=16:1) represented the negative value throughout the study area, which indicated the nitrogen sink dominant environments, and relative higher value of Excess N observed in the bottom layer of western and southern region. These observations suggest that the topographic features of a seamount influence the circulation of bottom current and its effects play a significant role in determining the behavior of water column environmental parameters.
Keywords:
Hydrogenetic Crust, Seamount, Inorganic Nutrients, Oxygen Minimum Zone, Water Column Environments키워드:
수성기원 망간각, 해저산, 무기영양염, 용존산소 최소층, 수층 환경1. 서 론
전 세계 대양 분지에서 기요 형태의 해저산 정상부(summit) 및 사면(flank)에 주요하게 분포하는 망간각(Fe-Mn crusts)은 코발트, 니켈, 구리와 같이 경제적 가치가 높은 금속원소뿐만 아니라 첨단산업에 필요한 희유금속(rare metal) 및 희토류원소(rare earth element)의 함량이 높아 잠재적 자원으로 각광을 받고 있다(Hein et al.[2000]; SPC[2013]). 주로 망간산화물(MnO2)과 철수화물(FeOOH)로 구성되어 있는 망간각은 수층으로부터 여러 금속 원소들이 콜로이드 형태의 망간산화물이나 철수화물에 흡착된 후 해저산의 암반기질에 직접적으로 침전되는 과정을 통해 형성되는 것으로 알려져 있다(Hein and Koschinsky[2014]). 이러한 수성기원의 망간각 침전 과정은 수괴(water mass) 특성에 영향을 받고, 상당히 느린 성장 속도(약 1~5 mm/My; Hein and Koschinsky[2014])와 매우 넓은 표면적(specific-surface, 평균 325 m2/g; Hein et al.[2000])을 갖는 특징이 있다. 특히, 망간각 형성 과정에서 수층환경 내 일차생산력(primary production), 용존산소 최소층(oxygen minimum zone), 저층 해류(bottom current) 등은 망간각 형성의 주요 유발 인자로 인식되고 있다(Verlaan et al.[2004]).
수층에서 일차생산 과정을 통해 형성된 유기물은 망간, 철, 니켈, 코발트, 구리 등과 같은 주요 금속원소에 대해 생물학적 운반자 역할을 하는데, 용존 상태에 있는 금속 원소들은 일차 생산 과정을 통해 입자 형태로 전환되고 저층으로 이동하게 된다. 저층으로 이동되는 입자유기물은 미생물에 의해 분해 작용을 받고, 그 과정에서 금속 원소들은 다시 수층으로 재 방출된다. 이러한 과정에서 용존산소 최소층은 입자유기물의 초기 원소 분할 과정에 기여하고 원소의 용존 상태(환원성 이온)를 유지시키는 작용을 한다. Klinkhammer and Bender[1980]는 약 100 μM 이하의 용존산소 농도에서 2가 망간(Mn2+)은 산화되지 않고 환원된 형태를 유지한다고 제시하였다. 한편, 해저면을 따라 흐르는 저층 해류는 해저산을 만나면 섬 효과(island effect)에 의해 상승하는데 이때 저층의 풍부한 용존산소도 같이 상층으로 공급되어 결과적으로 용존 상태의 금속이온들은 용존산소 최소층 아래에서 콜로이드 형태의 금속산화물을 형성한다. 또한, 해저산 주변의 저층 해류는 기요 형태를 갖는 해저산 정상부지역의 가장자리를 따라 강하게 흘러 퇴적물의 퇴적 작용을 방해하고, 용승(upwelling) 작용에 따른 무기영양염 공급으로 표층 내 일차생산 증가를 유발해 결과적으로 용존산소 최소층이 유지되는 순환 과정이 이루어진다(Hein et al.[2000]; Hein et al.[2013]).
연구지역이 속한 서태평양의 마젤란(Magellan) 해저산대는 서쪽의 마리아나 해구(Mariana Trench)와 동쪽의 마샬(Marshall) 해저산대 사이에 위치하며(GEBCO World Map 2014, http://www.gebco.net), 주로 정상부가 평탄한 기요 형태를 갖는 해저산들로 구성되어 있다. 서태평양 해역의 표층 해류 순환은 동태평양 해역과 동일하게 서향류인 남적도해류와 북적도해류 그리고 그 사이에 동향류인 북적도반류(3°N~9°N 사이)가 분포하며(Wijffels et al.[1998]), 동쪽에서 유입된 북적도해류는 필리핀 동쪽 연안의 약 12°N~13°N지점에서 북향류인 쿠로시오 해류와 남향류인 민다나오 해류로 양분된다(Qiu[2001]). 저층에서는 열염순환에 의해 남극 기원의 극환류수와 동태평양으로부터 북태평양 심층수가 마젤란 해저산대의 남쪽지역으로 유입된 후 북향의 흐름을 갖는데 해저산 지대와 같은 지형적인 특성과 그로 인해 유발된 다양한 용승 현상이 저층 순환을 결정하는데 중요하게 작용한다(Wijffels et al.[1998]; Siedler et al.[2004]). 한편, WOCE(World Ocean Circulation Experiment) Atlas 자료로부터 서태평양 해역에 설정된 P10 line(4°S~35°N, 149°E)에서 파악된 용존산소의 농도 분포는 약 40~220 μmol/kg(≈μM)의 범위로 저위도에서 고위도 해역으로 갈수록 저산소층(<100 μmol/kg) 수심이 깊어지는 특성이 있으며, 특히 40 μmol/kg 이하의 용존산소 최소층은 약 24°N~31°N 지점의 수심 1,000~1,500 m 사이에 분포하는 것으로 보고된 바 있다(Talley[2007]). 수층 내 일차생산력을 조절하는 요인 중 하나인 무기영양염 농도(인산염: 최대 약 3 μM, 질산염: 최대 약 42 μM) 또한 수심 500~2,500 m 사이에서 용존산소 최소층이 잘 발달한 고위도(24°N 이북) 해역이 저위도 해역보다 높게 분포하는 특징을 갖는다(Talley[2007]).
해저산 해역에서 망간각의 형성 기작과 분포 양상은 수층 환경 특성과 밀접하게 연관되어 있음이 여러 연구를 통해 제시되었다. Conrad and Hein[2013]의 연구에 의하면 캘리포니아 해안 주변부에 위치한 해저산을 대상으로 수심에 따른 망간각의 성장 속도를 파악한 결과, 용존산소 최소층 하부에서 가장 큰 성장 속도를 나타냈으며, 이는 주로 망간과 용존산소 사이의 관계에 기인한 것으로 해석하였다. Verlaan et al.[2004]은 남태평양 중앙 해역(135°W~175°E, 0°~25°S)을 대상으로 망간각 금속 성분의 조성과 환경 인자들(표층생산력, 용존산소 최소층, 탄산염 보상심도 등) 사이의 연관성을 조사하였고, 이러한 인자들이 지역적으로 금속 원소의 속성 작용 및 수성 기원 과정과 밀접한 연관이 있는 것으로 파악하였다. 또한, 해역별(북태평양, 남인도양, 북동대서양) 망간각 조성에 있어 수층 내용존산소 농도 및 수심의 관계(Glasby et al.[2010]), 해저산 해역에서의 생물-물리학적 상호 연관성(Mohn et al.[2009]), 일차 생산력 강화와 연관된 무기영양염 유입량(Machin et al.[2009]), 용존 및 입자 유기물 분포에 미치는 해저산의 영향(Vilas et al.[2009]) 등 해저산 해역의 수층 환경 특성을 파악하고자 하는 연구가 활발히 수행되고 있다.
우리나라는 서태평양 공해상에 위치한 해저산 지역을 대상으로 망간각 부존 유망 지역을 평가하고 국제해저기구에 탐사 광구를 등록하고자 해저산 지형, 음향매질 특성, 망간각 분포 및 조성, 해저면 영상조사 등의 연구를 수행하고 있다(Lee et al.[2005]; Kim et al.[2013]). 하지만 해저산 해역에서 망간각 형성 기작과 밀접한 연관이 있는 수층 환경에 대한 이해는 여전히 부족한 실정이며, 특히 해저산을 중심으로 동적인 환경 특성은 아직까지 알려진 바가 없다. 따라서 본 연구에서는 수괴 특성과 수층 환경 인자(용존산소, 무기영양염, 엽록소-a 등)의 거동 조사를 통해 해저산 해역의 수층 환경특성을 파악하고, 환경 인자들의 거동 변화를 일으키는 요인에 대해 알아보고자 한다.
2. 재료 및 방법
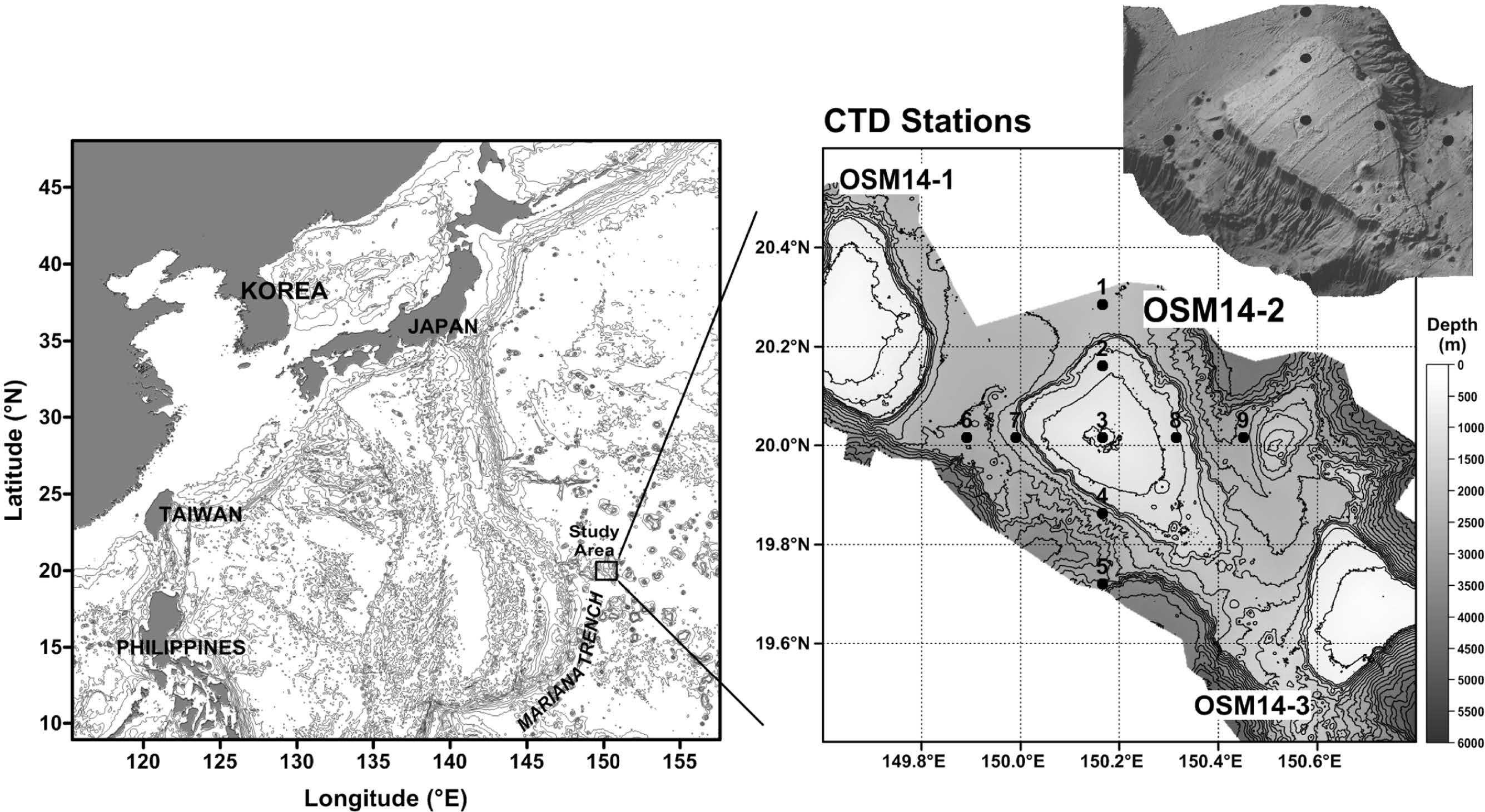
서태평양 공해상(150.2°E, 20°N 부근)에 위치한 해저산 지역 중 OSM14-2로 명명된 해저산 해역을 중심으로 수층 환경 특성을 파악하고자 2014년 10월에 동-서와 남-북 방향으로 총 9개의 정점(평균 15 km 간격)을 선정하였다(Fig. 1). 수층 환경의 물리 자료는 CTD system(Sea-Bird 911 plus)을 이용하여 1 m 간격으로 획득하였고, 해수 시료는 Carousel system의 Niskin 채수기로 수심 5 m부터 최대 3,371 m까지 수심별로 채취하였다.
용존산소는 현장에서 Winkler-Sodium Azide 방법으로 분석된 자료를 이용하여 Sea-Bird 사에서 제공하는 SBE Data Processing 프로그램을 통해 처리된 CTD 센서 값을 보정하였다(Parsons et al.[1984]). 수층 내 무기영양염 분석을 위한 해수 시료는 염산으로 처리된 플라스틱 병(60 mL HDPE, Nalgene)에 담아 -20 °C 이하의 냉동 상태로 보관 후 실험실로 옮겨 분석하였다. 분석된 항목은 영양염 자동분석기(Proxima, Alliance)를 이용하여 아질산염(nitrite), 질산염(nitrate) 그리고 인산염(phosphate)이며, 질산염의 경우 구리/카드뮴 관을 이용해 아질산염으로 환원시킨 후 분석하였다(Millero[2006]). 각각의 영양염 농도는 표준용액을 이용하여 구한 검증곡선(R2>0.99)으로 계산하였으며, 표준물질(RMNS, Kanso)로 정확도를 검증하였다(질소: 평균 105.6±5.6%, 인: 평균 100.0±9.1%).
일차 생산자의 양을 지시하는 엽록소-a 분석은 2 L의 해수 시료를 질소 가스 압력식 여과 장치를 이용해 0.45 μm membrane filter(25mm diameter, Whatman)로 거른 다음 필터지를 -60 °C 이하로 냉동 보관하였다. 분석은 90% 아세톤 용액에 담가 냉암소에서 24시간 동안 용출시킨 후 hydrophobic PTFE syringe filter(0.2 μm pore size, Advantec)를 이용해 부유물을 제거한 뒤 Turner 10-AU Fluorometer(Turner Designs)로 엽록소 농도를 측정하였다(Excitation 450 nm/Emission 670 nm). 또한 산(3% HCl) 처리 전과 후의 값으로부터 phaeo-pigment 값을 보정해 주었다(Parsons et al.[1984]).
3. 결과 및 고찰
3.1 물리적 환경 특성
해저산 OSM14-2가 위치한 지역은 북태평양 아열대 해역으로 전형적인 고온(약 29 °C), 고염분(35.10 psu)의 표층 해수 특성을 나타내었다(Figs. 2 and 3). 해수면으로부터 수심 60~70 m(평균 69 m)에는 수온 28~29 °C, 염분 35.07~35.20 psu의 표면혼합층(mixed layer depth, MLDT=Z(m, T(SST-0.5℃)); Cronin and Kessler[2002])이 존재 하였다. 수온-염분 도표(T-S diagram)로부터 연구해역은 수직적으로 4개의 주요 수괴가 분포하는 것으로 파악되었다(Fig. 4a). 수심 약 190 m 이내의 표층에는 북태평양 열대수(North Pacific Tropical Water)라고 부르는 수온 약 21~29 °C, 염분 35.0~35.2 psu 이상의 수괴가 분포하였다(Figs. 2 and 3). 수온-염분 도표에서는 A 영역의 고염분(Fig. 4a), 수온-용존산소 도표(T-DO diagram)에서는 E 영역의 고용존산소(190~220 μM)를 나타내는 수괴이다(Fig. 4b). 이 수괴의 중심은 북태평양 중앙 20°N~30°N 해역의 표층에 분포하는 35.5 psu 이상의 고염분을 나타내는 해수이며(Stommel and Yoshida[1972]), 본 연구해역은 그 가장자리에 위치하고 있다. 표층의 북태평양 열대수 아래에서는 수온약층수(Thermocline Water)가 수심 약 250~450 m의 수온약층에 분포하였다(Fig. 2). 이 수괴는 수온-염분도표에서 B 영역에 분포하는 수괴로 태평양 중앙에서 주로 수온약층을 형성하는 해수이다(Fig. 4a). 수온은 수심에 따라 12~19 °C 사이, 염분은 34.30~34.85 psu에 분포하였다(Figs. 2 and 3).
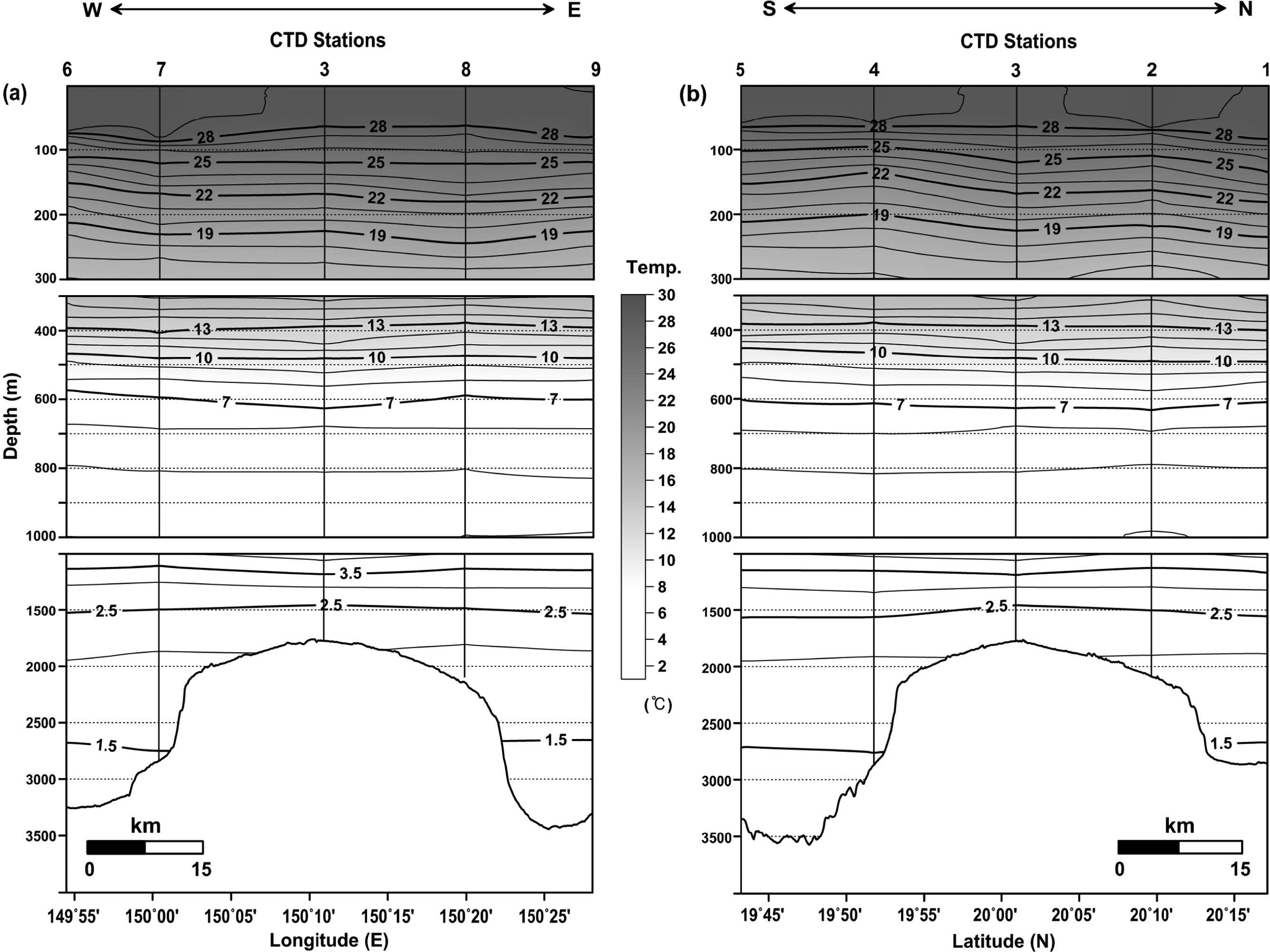
Vertical distributions of temperature in the (a) east-west line and (b) south-north line crossing the CTD sites (Contour intervals are 1 °C, 1 °C, and 0.5 °C in the upper, middle, and lower water column, respectively).
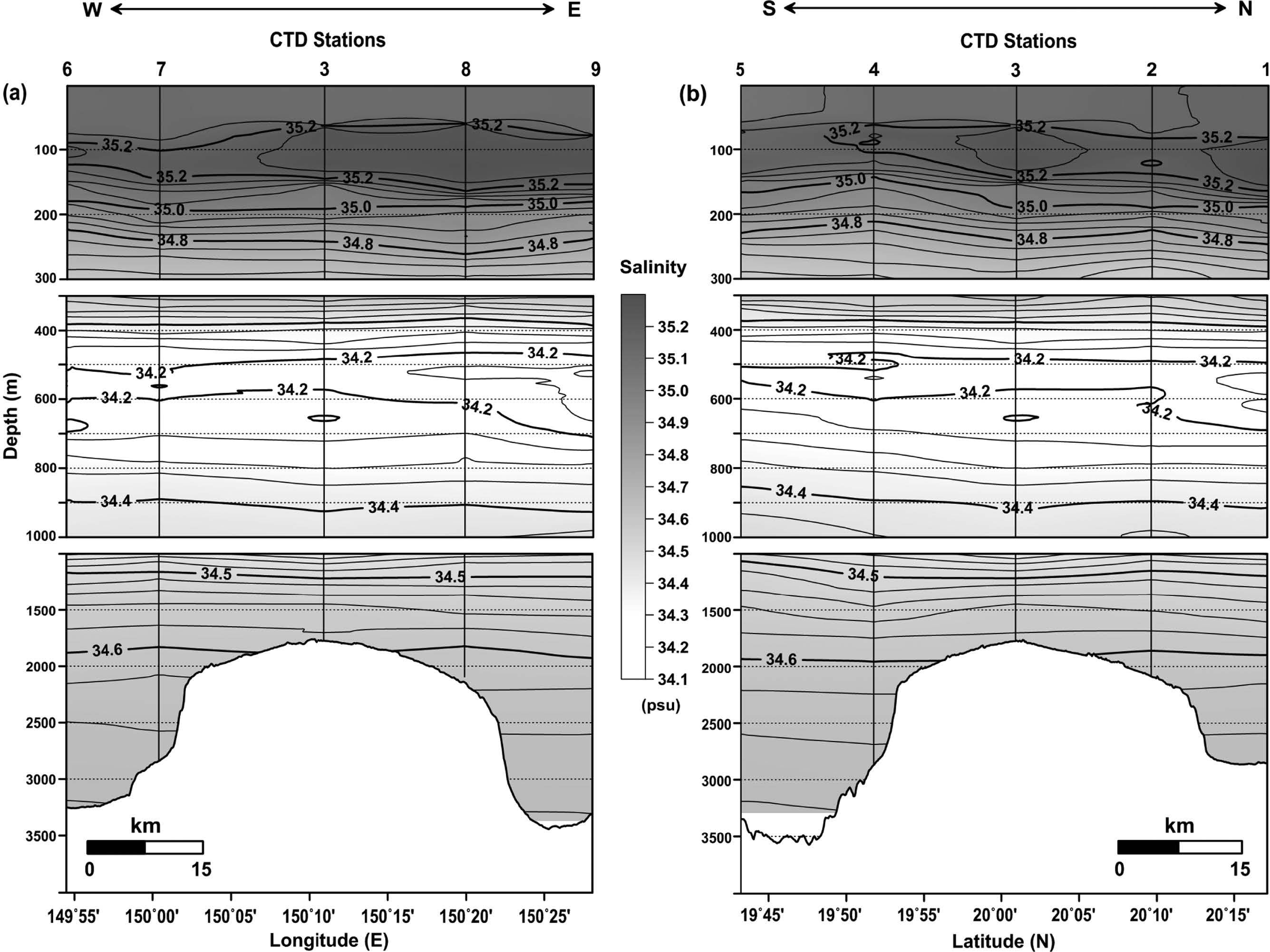
Vertical distributions of salinity in the (a) east-west line and (b) south-north line crossing the CTD sites (Contour intervals are 0.05 psu, 0.05 psu, and 0.02 psu in the upper, middle, and lower water column, respectively).
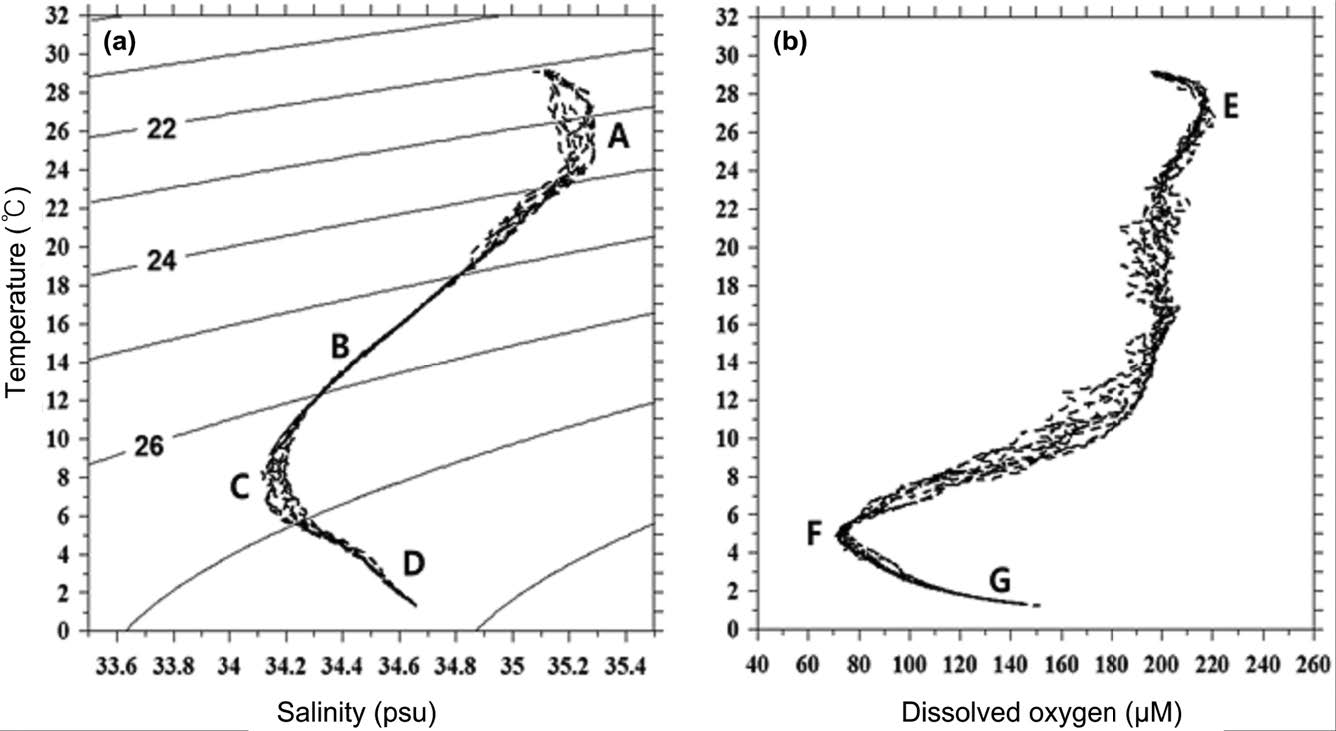
(a) Temperature-salinity diagram and (b) temperature-dissolved oxygen diagram for the seawater at the sampling sites (A: North Pacific Tropical Water, B: Thermocline Water, C: North Pacific Intermediate Water, D: North Pacific Deep Water).
한편, 북태평양 중층의 대표적인 수괴는 북태평양 중층수(North Pacific Intermediate Water)로, 기원은 오야시오 해수이며, 북서태평양에서의 염분은 약 33.8 psu이다(Talley[1991]; Yasuda[1997]). 북태평양 중층수는 기원지에서 남쪽으로 내려갈수록 다른 해수들과의 혼합에 의해 변질되는데, 본 연구해역에서는 수심 약 450~650 m 사이에서 염분 34.1~34.2 psu를 나타내었다(Fig. 3). 수온-염분 도표에서는 C 영역에 해당된다(Fig. 4a). 아울러 북태평양 중층수 아래의 수온 약 4~6 °C, 염분 34.2~34.4 psu 사이에서는 수온-용존산소 도표에서 F 영역에 해당되는 용존산소 농도 70~80 μM의 저산소층이 분포하였다(Fig. 4b). 수심 약 1,800 m 이하의 저층에서는 남극 저층수(Antarctic Bottom Water)로부터 기원된 북태평양 심층수(North Pacific Deep Water) 수괴가 존재하였고(Kawabe et al.[2003]; Chaohui et al.[2008]), 저층으로 갈수록 수온은 감소하지만 염분과 용존산소 농도는 증가하는 양상을 나타내었다(Fig. 4). 이는 남극 기원의 높은 염분과 용존산소를 함유한 수괴의 유입 영향으로 판단된다. 수온은 약 2 °C 이하, 염분은 34.6 psu 이상, 용존산소는 115 μM 이상을 나타내며, 수온-염분 도표에서는 D 영역, 수온-용존산소 도표에서는 G 영역에 해당된다(Fig. 4).
해저산 정상부에 위치한 CTD3 정점을 중심으로 동-서 방향과 남-북 방향으로 설정한 CTD 정점 라인에서 수심 1,000 m를 무류면으로 지형류를 계산하였다(Fig. 5). 표층에서의 지형류 유속은 전반적으로 10~100 cm/s의 범위로, 해저산의 동쪽(정점 CTD3과 CTD8사이) 해역에는 약 10 cm/s의 남향류가, 서쪽(정점 CTD6과 CTD3사이) 해역에는 100 cm/s의 북향류가 표층에 분포하였다(Fig. 5a). 또한, 해저산의 북쪽(정점 CTD2와 CTD3 사이) 해역에는 40 cm/s의 동향류가, 남쪽(정점 CTD3과 CTD5 사이) 해역에는 100 cm/s의 서향류가 존재해(Fig. 5b), 정점 CTD3과 CTD7 사이의 해역을 중심으로 시계 방향의 흐름을 지시했다. 한편, 정점 CTD3과 CTD8사이 수심 200 m 아래에서는 20~40 cm/s의 유속을 갖는 남향류가 나타났는데 수심 약 600 m까지 깊게 분포하는 형태를 보였다. 시계방향의 흐름과 반대로 연구해역의 북쪽과 동쪽 끝부분의 해역에서는 반시계 방향의 흐름도 분포하였다. 북쪽의 정점 CTD1과 CTD2 사이 해역에는 90~100 cm/s의 서향류가, 동쪽의 정점 CTD8과 CTD9사이에는 20~30 cm/s의 북향류가 존재하였다.
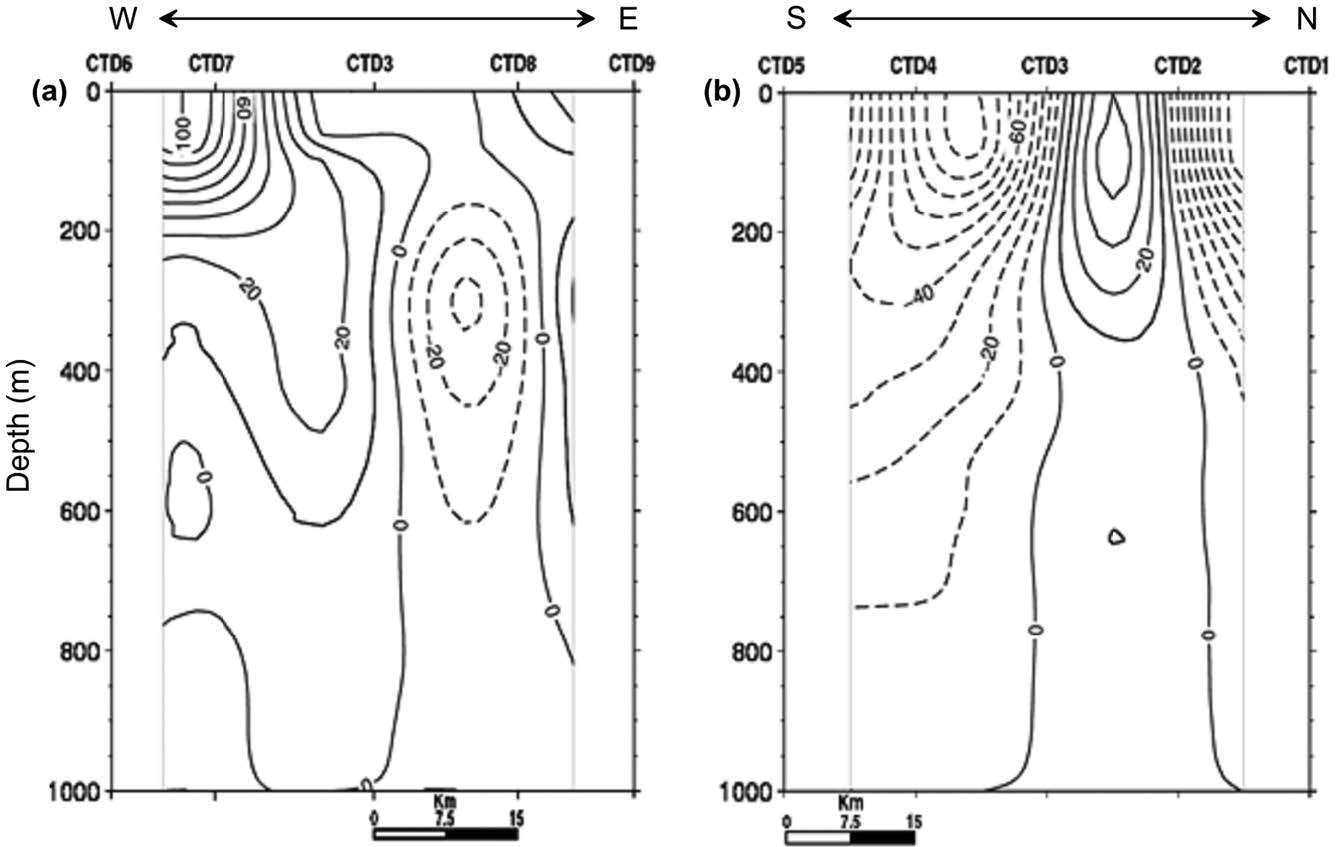
Vertical distributions of geostrophic flow in the (a) east-west line (solid line: northward, dashed line: southward) and (b) southnorth line (solid line: eastward, dashed line: westward) crossing the CTD sites from the surface to the depth of 1,000 m (unit: cm/s).
이러한 지형류 결과는 수심 1,000 m를 무류면으로 설정하여 파악한 것으로 마젤란 해저산대 수심 약 4,000~5,000 m에 밀집한 해저산 해역에서의 저층 해류를 고려하면 다소 제한이 있을 수 있다. 하지만 해저산 정상부 수심(약 1,780 m)보다 깊은 수심 2,000 m를 무류면으로 설정하여 파악한 지형류 분포에서도 유속의 차이는 있지만 방향성에는 차이가 없는 것으로 조사되었다. 또한, kim et al.[2014a]은 북서 열대 태평양 해역(125°E~160°E, 10°N~30°N)에 존재하는 아열대 반류(Subtropical Countercurrent)의 생성 기작과 변동을 밝히면서 많은 수의 중규모 소용돌이가 존재하고, 이들 소용돌이의 운동 에너지(Eddy Kinetic Energy)가 높음을 제시한 바 있다. 따라서 다소 제한적이지만 본 연구에서 획득한 지형류의 흐름으로부터 연구 해역의 표층 해류 순환을 이해하기에는 무리가 없는 것으로 여겨진다.
3.2 수층 환경 인자의 분포 특성
연구 해역에서 파악된 용존산소의 수직 분포는 표층에서 약 200 μM 전후의 농도로 비교적 일정하게 분포하다 수심 400 m부터 감소하기 시작하여 수심 800 m(평균 73.26 μM)에서 가장 낮은 농도를 보인 후 저층으로 갈수록 꾸준히 증가하는 양상을 나타내었다(Fig. 6a). 용존산소 농도 분포로부터 판단되는 용존산소 최소층 환경은 아산소 환경(suboxic, O2<20 μM)과 산화 환경(oxic, O2>90 μM) 사이에 해당하는 산소 결핍 환경(dysoxic, O2 20~90 μM)으로(Wright et al.[2012]), 90 μM 이하의 용존산소 최소층은 연구 해역의 수심 700~1,200 m 사이에 걸쳐 분포하였다. 용존산소 최소층 내에서 가장 낮은 농도를 갖는 수심(800 m)에서의 평균 농도는 연구 해역과 유사한 위도에 위치하며 용존산소 최소층이 잘 발달한 북태평양 동부열대해역(Eastern Tropical North Pacific, 0°~25°N, 75°W~180°W, OMZ core mean O2 14 μM; Paulmier and Ruiz-Pino[2009])과 비교해 약 5배 정도 높은 수준이다. 일반적으로 용존산소 최소층은 대륙의 서쪽에서 풍성 순환에 의해 용승 작용이 활발하고(표층으로 영양염 공급) 일차 생산력이 높은 곳에 존재하며, 수층에서 대기-해양간 기체 교환, 광합성 작용, 환기(ventilation) 현상 등을 통한 산소 공급량보다 빠르게 소비되는 양이 많을 때 용존산소 최소층이 유지되는 것으로 알려져 있다(Wright et al.[2012]). 지역적으로 연구 해역이 속한 서태평양은 동태평양보다 용존산소 최소층이 상대적으로 덜 발달한 해역이지만 그럼에도 불구하고 해저산을 피복하고 있는 망간각의 형성 조건 및 금속원소 조성에 용존산소 최소층 분포가 중요하게 작용하는 점은 여러 연구를 통해 제시된 바 있다(Verlaan et al.[2004]; Glasby et al.[2010]; Hein et al.[2013]; Muinos et al.[2013]).
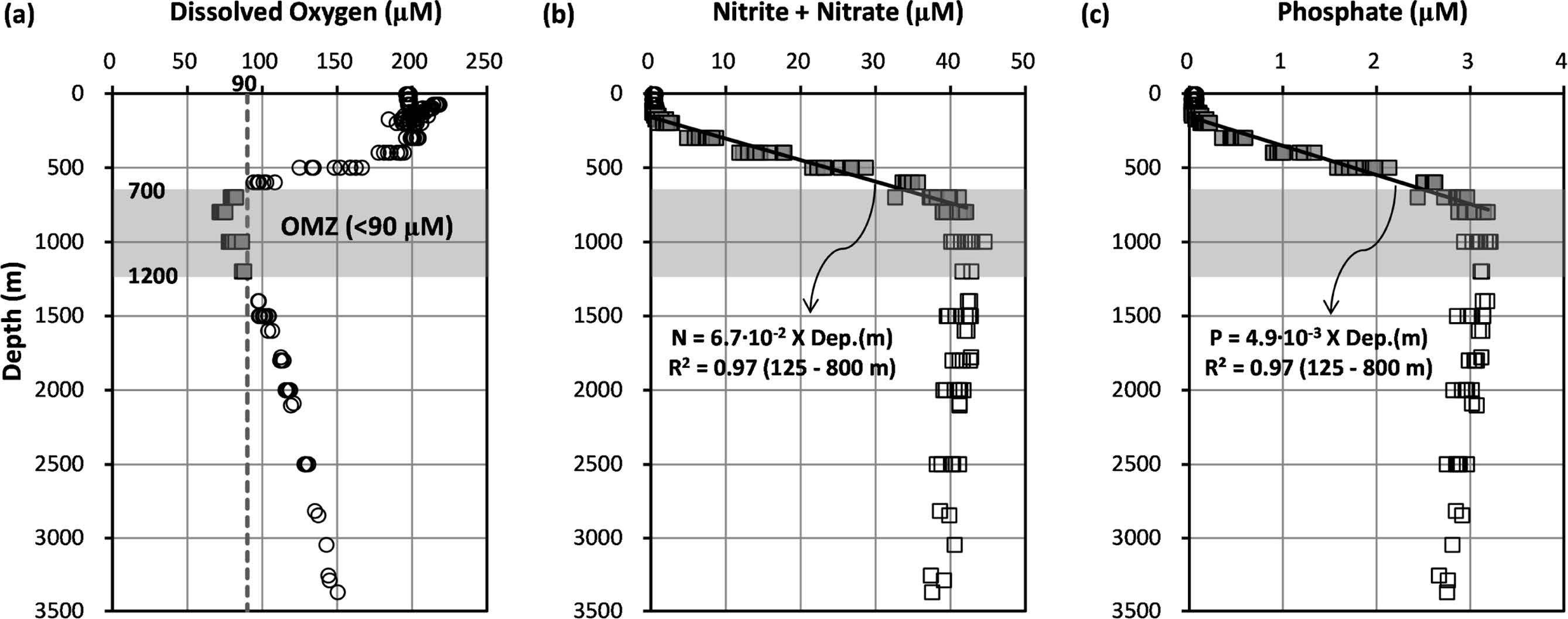
Vertical profiles of (a) dissolved oxygen, (b) nitrite + nitrate, and (c) phosphate at the sampling sites.
해양생태계에서 무기영양염은 해양 생물의 생화학적 대사과정에 긴밀히 연결되어 있는 친생물 원소로 구성되어 있고, 생물의 분포와 군집 그리고 조성 등에 영향을 주며(Millero[2006]), 아열대 또는 열대 해역에서 일차 생산력을 조절하는 제한요인으로 작용한다(Capone et al.[1997]; Falkowski[1997]). 해양에서 영양염의 분포는 주로 생물기원 유기물의 생산과 분해 그리고 입자 물질의 침강과 같은 생지화학적 과정에 의해 조절된다(Hirose and Kamiya[2003]). 연구 해역에서 파악된 영양염 중 질소계(N) 영양염인 아질산염+질산염은 0.18~44.57 μM의 범위를, 인계(P) 영양염인 인산염은 0.02~3.22 μM의 범위를 나타내었다(Figs. 6b and 6c). 이러한 결과는 영양염 농도가 가장 높게 분포하는 용존산소 최소층을 기준으로 북동태평양 해역(135°E, 10°N~50°N; WOCE Atlas, P17 line)과 유사한 수준이며, 북대서양 해역(67°W, 20°N~40°N; WOCE Atlas, A22 line) 보다는 약 2배, 인도양 해역(80°E, 20°S~5°N; WOCE Atlas, I08N line) 보다는 약 1.2배 높은 수준이다(Talley[2007]). 해역에 따른 영양염 농도 차이는 일차 생산력 차이(북태평양 중앙해역 4.7 PgC/yr, 적도 인도양해역 3.7 PgC/yr, 북대서양 중앙해역 2.4 PgC/yr; Rousseaux and Gregg[2014])와 열염순환에 의한 해수의 연령 차이(영양염 농도 축적: 대서양<인도양<태평양)에 기인된 것으로 여겨진다(Millero[2006]). 연구해역에서 수심에 따른 영양염 분포 양상은 전반적으로 표면혼합층(평균 수심 69 m) 내에서 가장 낮은 농도(빈영양 환경)를 보인 후 계절수온약층을 지나면서 급격히 증가해 용존산소 최소층에서 최대 농도를 나타냈으며, 그 이후 저층까지는 다소 감소하는 형태로 분포하였다(Figs. 6b and 6c). 표면혼합층 이하 용존산소 최소층 사이에서 수심 증가에 따라 발생하는 재무기질화(Δ농도/Δ수심) 과정은 두 항목 모두 정점 간 큰 차이를 보이지 않으며(R2=0.97) 일정한 비율로 증가하는 양상을 나타내었다.
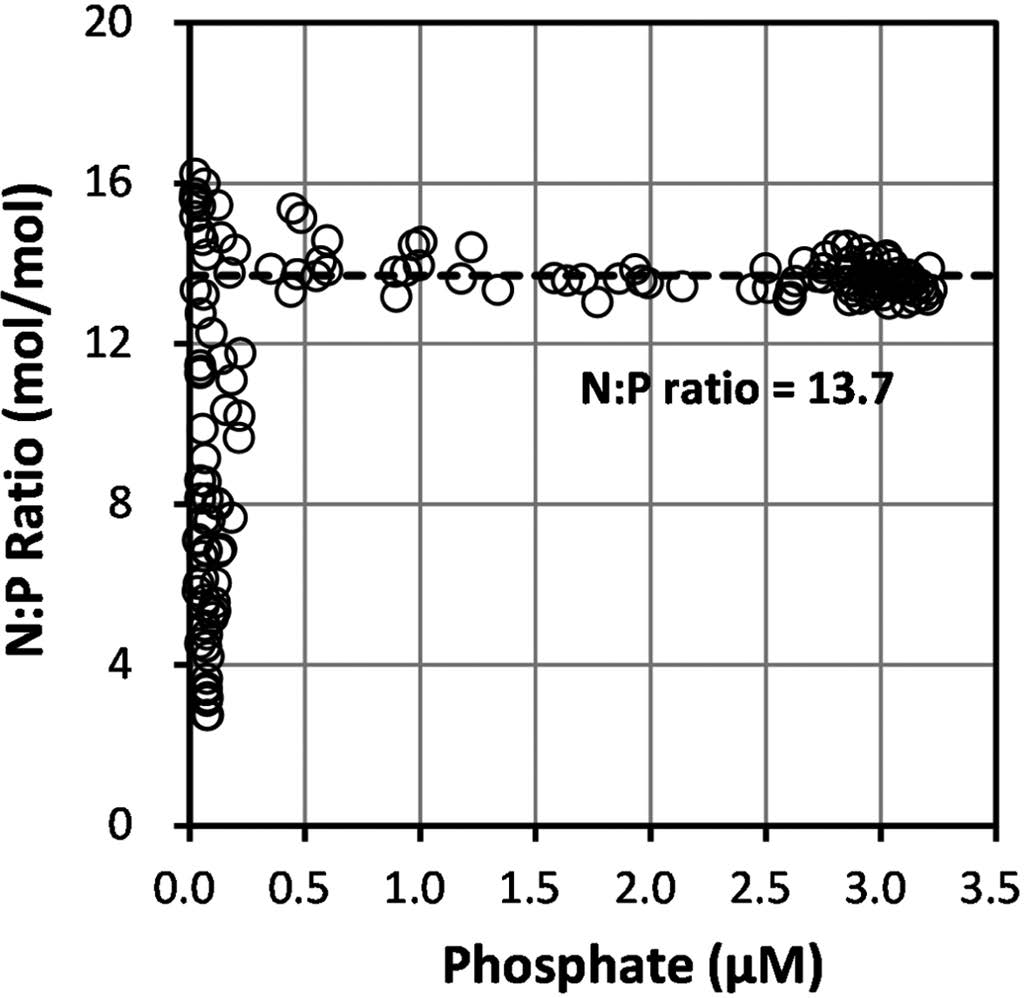
해양에서 동·식물플랑크톤의 원소 조성과 해수의 질소와 인의 농도로부터 도출된 Redfield ratio(N:P=16:1; Redfield et al.[1963])은 현재도 많은 연구자들이 유기물의 생성과 재무기질화, 일차 생산자의 성장 제한요인 및 수괴 추적 등 생태학적 연구에 중요하게 활용하고 있다(Anderson and Sarmiento[1994]; Sardans et al.[2012]). 연구 해역에서 아질산염+질산염과 인산염 농도 사이의 관계로부터 파악된 N:P ratio은 전반적으로 인산염 농도 0.2 μM(수심 200 m 이내)을 기준으로 그 이하에서는 평균 8.7±4.2, 그 이상에서 13.7±0.7로 나타나 본 연구에 고려되지 않은 암모니아 농도를 감안하더라도 인 성분에 비해 상대적으로 질소 성분이 제한된 환경임을 지시하였다(Fig. 7). 이러한 결과는 북서대서양 아열대 해역과는 상반된 결과로, 대서양에서 수행된 BATS(Bermuda Atlantic Time-series Study, 64°10'W, 31°40'N)를 통해 N:P ratio가 표층에서는 30 이상(인 성분 제한 환경), 수심 600 m까지도 16 이상의 값을 갖는 것으로 보고된 바 있다(Cavender-Bares et al.[2001]; Michaels et al.[2001]). 연구 해역에서 파악된 낮은 N:P ratio 결과는 Hirose and Kamiya[2003]가 북서태평양 해역(19°N~33°N, 137°E)에서 보고한 결과(N:P=~14)와 유사한 수준으로, 그들은 북서태평양 해역이 기존의 Redfield ratio 보다 낮은 값을 갖는 것은 질산염과 인산염 사이의 소비율 차이에 의한 결과로 해석하였고, 모델을 통해 질산염이 더 많이 소비됨을 제시하였다. 아울러, Kim and Kim[2013]은 북서태평양에 위치한 동해(East Sea)에서 단순 물질수지 박스모델을 통해 심층 순환이 원활한 해역에서 낮은 N:P ratio(~13) 결과를 생물학적 과정과 더불어 물리적 효과(표층수(N:P<10)와 저층수의 혼합)의 영향으로도 설명하였다. 한편, 연구 해역과 같이 낮은 N:P raio 환경에서는 질소 고정 박테리아의 생체량 증대에 의해 질소 고정(e.g.,N2→NH4+)이 증가하고, 결국 이들 박테리아가 죽어서 분해되거나 섭식 과정을 통해 용존 암모니아나 질산염으로 방출돼 N:P ratio를 증가시키는 순환 과정이 일어나는 것으로도 알려져 있다(Sardans et al.[2012]).
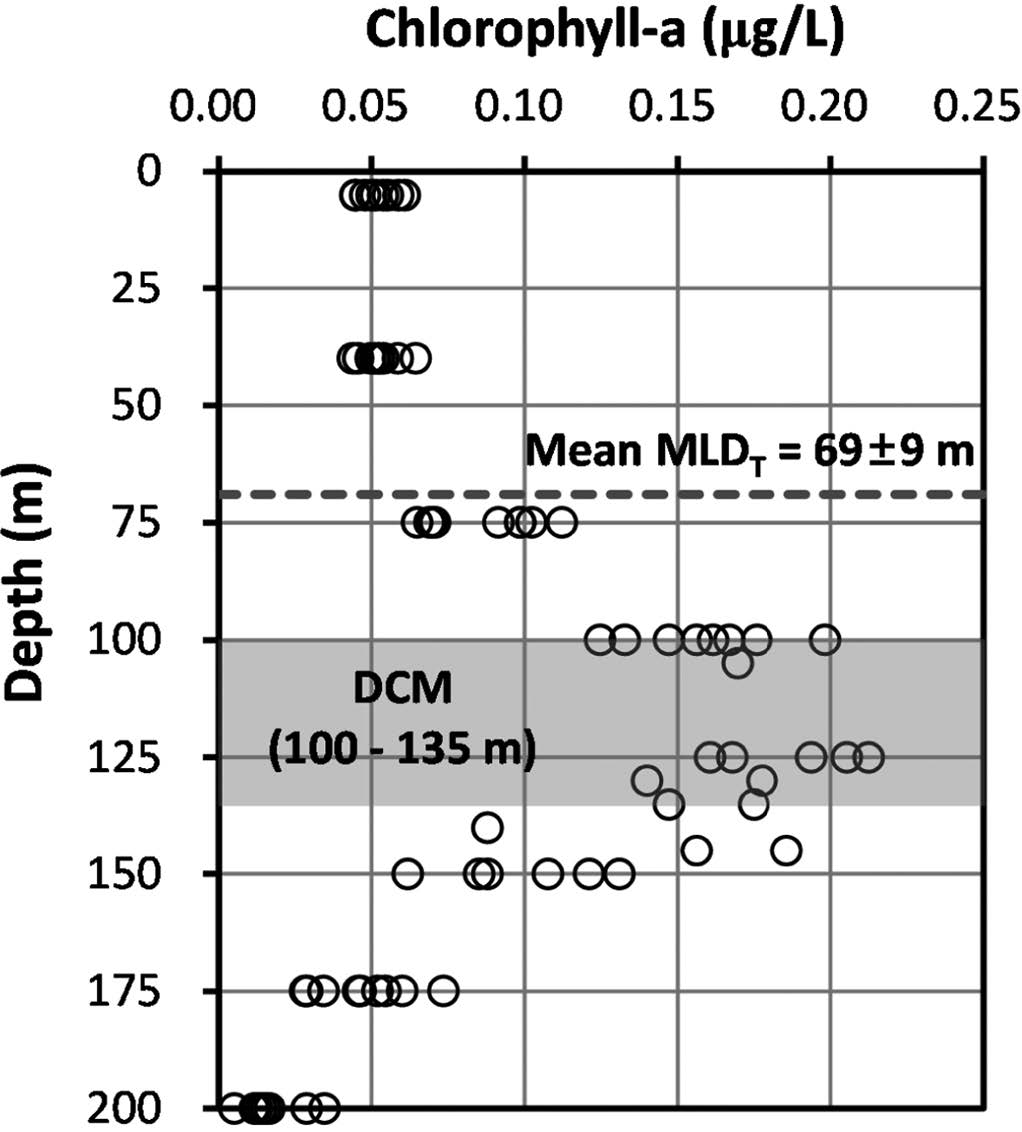
해저산 OSM14-2 주변 해역에서 일차 생산자의 양을 지시하는 엽록소-a 분포는 전반적으로 표면혼합층이 형성된 수심 69 m 이내에서 0.1 μg/L 이하의 낮은 농도로 존재하였고, 엽록소 최대층(deep chlorophyll maximum, DCM)은 수심 100~135 m 사이에서(최대 농도0.21 μg/L) 형성된 것으로 파악되었다(Fig. 8). 이러한 특성은 수심 50 m 전후에서 엽록소 최대층(subsurface chlorophyll maximum, SCM)이 형성되는 북동태평양 해역(7°N~10.5°N, 131.5°W, 최대 농도 0.36 μg/l; Son et al.[2011])과는 다른 양상으로, 저층으로부터 농도차이에 따른 확산을 통해 표층으로 유입되는 영양염 분포와 빛이 약한 수심에서 최대한의 광합성 효율을 높이기 위한 식물플랑크톤의 생리적인 광적응 현상에서 기인된 해역별 차이로 판단된다(Venrick et al.[1973]; MLTM[1998]). 또한, 북동태평양 해역에 비해 상대적으로 낮은 DCM 내 엽록소 농도는 서태평양에 존재하는 난수역(warm pool)의 시기적 영향으로 판단되며, 본 연구 해역과 인접한 해역(135°00'E, 16°30'N)에서 본 연구의 조사 시기가 속한 여름~가을철(6~11월)의 침강입자 플럭스가 겨울∼봄철(난수역이 약 15°N 이남에 위치)에 비해 상대적으로 낮다는 보고는 이를 뒷받침한다(Kim et al.[2014b]).
3.3 해저산 해역의 동적 수층 환경
해저산 OSM14-2 주변 해역의 동적 수층환경 특성을 상세히 파악하기 위하여 동-서 및 남-북 라인의 수직 단면 분포에서 CTD 관측을 통해 획득한 물리 자료(수온 및 염분 포함 밀도와 용존산소)는 수심 300 m와 1,000 m를 기준으로 3개의 층으로 구분하여 분석하였다(Figs. 2, 3, 9 and 10). 반면, 해수시료 분석을 통해 획득한 수심별 무기영양염 자료의 경우에는 수심 500 m를 기준으로 2개의 층으로 구분해 살펴보았다(Figs. 12 and 13).
동-서 및 남-북 라인의 밀도 분포에서 등밀도선은 전체적으로 수심과 평행하게 분포하는 형태를 보였는데, 수심 100 m 이내에서는 정점 별로 다소의 차이를 나타내었다(Fig. 9). 특히 동-서 라인의 CTD7 정점에서는 주변과 비교해 하강한 형태가 관측되었다(Fig. 9a). 이는 앞서 ‘3.1 물리적 환경 특성’에서 언급한 시계 방향의 와류에 의한 영향으로 판단된다. 북반구에서는 시계 방향의 와류 발생 시중심부로 유체가 모여 해수면 상승에 따른 침강 현상이 발생하며, 침강 정도는 와류 크기, 유속, 지속 시간 등과 관련되어 있는 것으로 알려져 있다(Samuelsen et al.[2012]). 이러한 영향은 용존산소분포에서도 확인되었다(Fig. 10a). 한편, 수심 300~1,000 m 사이에서 관측된 밀도 분포는 동-서 라인과 남-북 라인에서 공간적인 변화양상이 뚜렷하게 관측되지 않았지만, 용존산소 분포에서는 상대적으로 수심 500 m 내외에서 해저산 정상부를 중심으로 동쪽 해역에 비해 서쪽 해역에서 그리고 북쪽 해역에 비해 남쪽 해역에서 저층수 유입에 의한 영향(등농도선의 상승 형태)이 인지되었다(Figs. 9 and 10). 이러한 양상은 앞선 염분 분포에서도 유사하게 나타났다(Fig. 3). 반면에, 수심 1,000 m 이하에서는 상층(수심 300~1,000 m)에서 인지된 서쪽과 남쪽 해역을 통한 저층수 유입 영향이 수온과 염분 분포를 포함해 밀도 및 용존산소 분포에서, 비록 미약한 상승 형태가 해저산 기저부 수심(2,500 m 이하)에서 보였지만, 명확하게 나타나지는 않았다. 수심 500 m 지점과 비교해 그 이하의 수심에서 상대적으로 저층수 유입 영향이 관측되지 않은 점은 주변 해수와의 혼합(넓은 contour 간격)과 더불어 수심에 따른 농도 구배가 상대적으로 작은(절대값 변화가 낮음) 결과로 여겨진다. 특이하게 수심 300 m 이내의 용존산소 분포에서는 대기와 기체 교환이 원활하게 이루어지는 표면혼합층 보다 그 이하의 수심에서 고농도(O2>212μM)의 용존산소가 분포하는 양상이 관측되었다(Fig. 10). 이는 높은 용존산소를 함유한 외부 수괴의 유입 영향이기 보다는 광합성 작용에 의한 영향으로 판단되며(Fig. 11), 북태평양 아열대 해역(126°56'W, 45°10'N)에서 조사된 Anderson[1969]의 연구에서도 유사하게 엽록소 최대층이 형성된 수심 위에서 용존산소 농도가 높게 분포한 결과가 보고되었다.
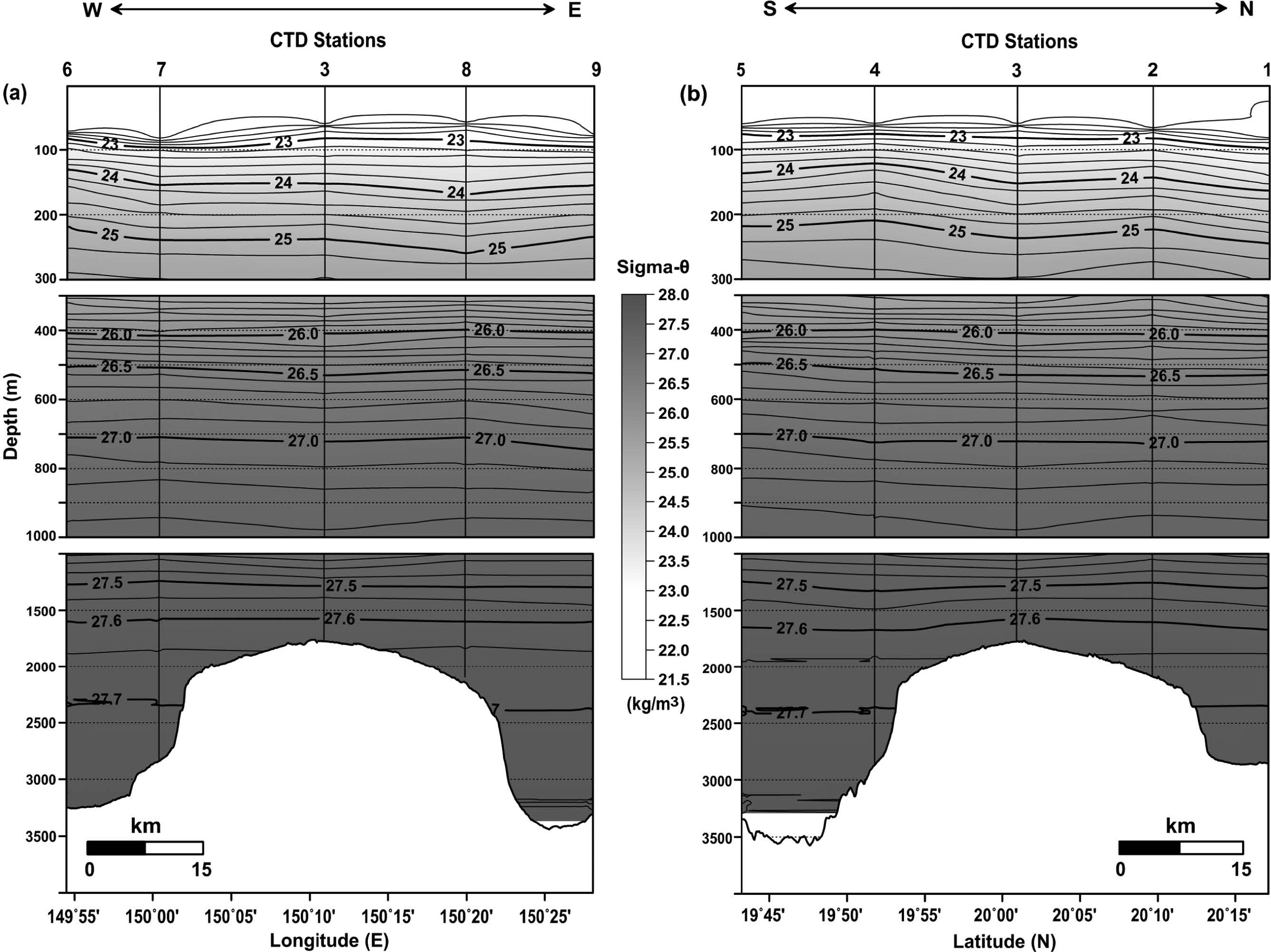
Vertical distributions of density (sigma-θ) in the (a) east-west line and (b) south-north line crossing the CTD sites (Contour intervals are 0.2 kg/m3, 0.1 kg/m3, and 0.05 kg/m3 in the upper, middle, and lower water column, respectively).
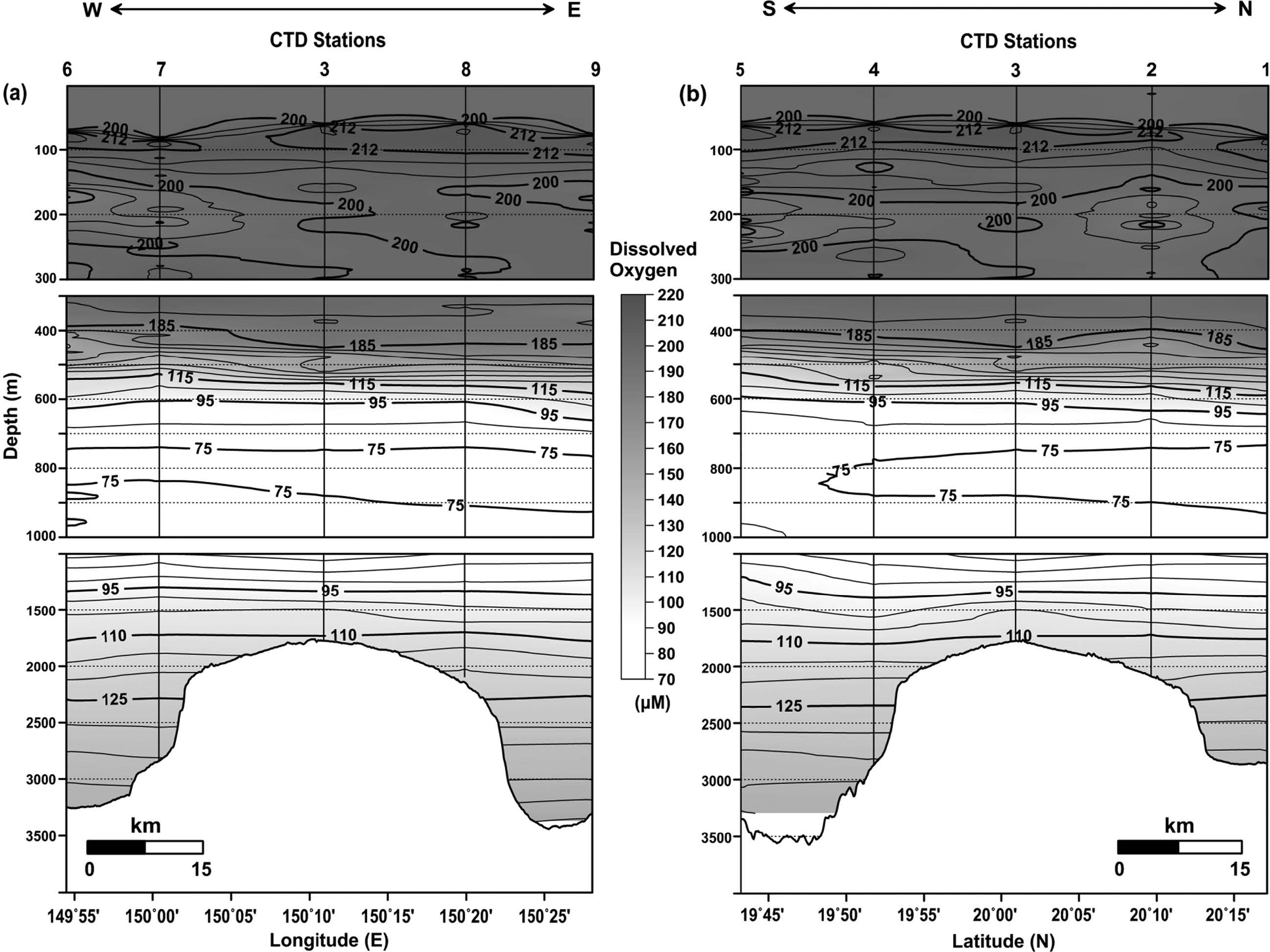
Vertical distributions of dissolved oxygen in the (a) east-west line and (b) south-north line crossing the CTD sites (Contour intervals are 4 μM, 10 μM, and 5 μM in the upper, middle, and lower water column, respectively).
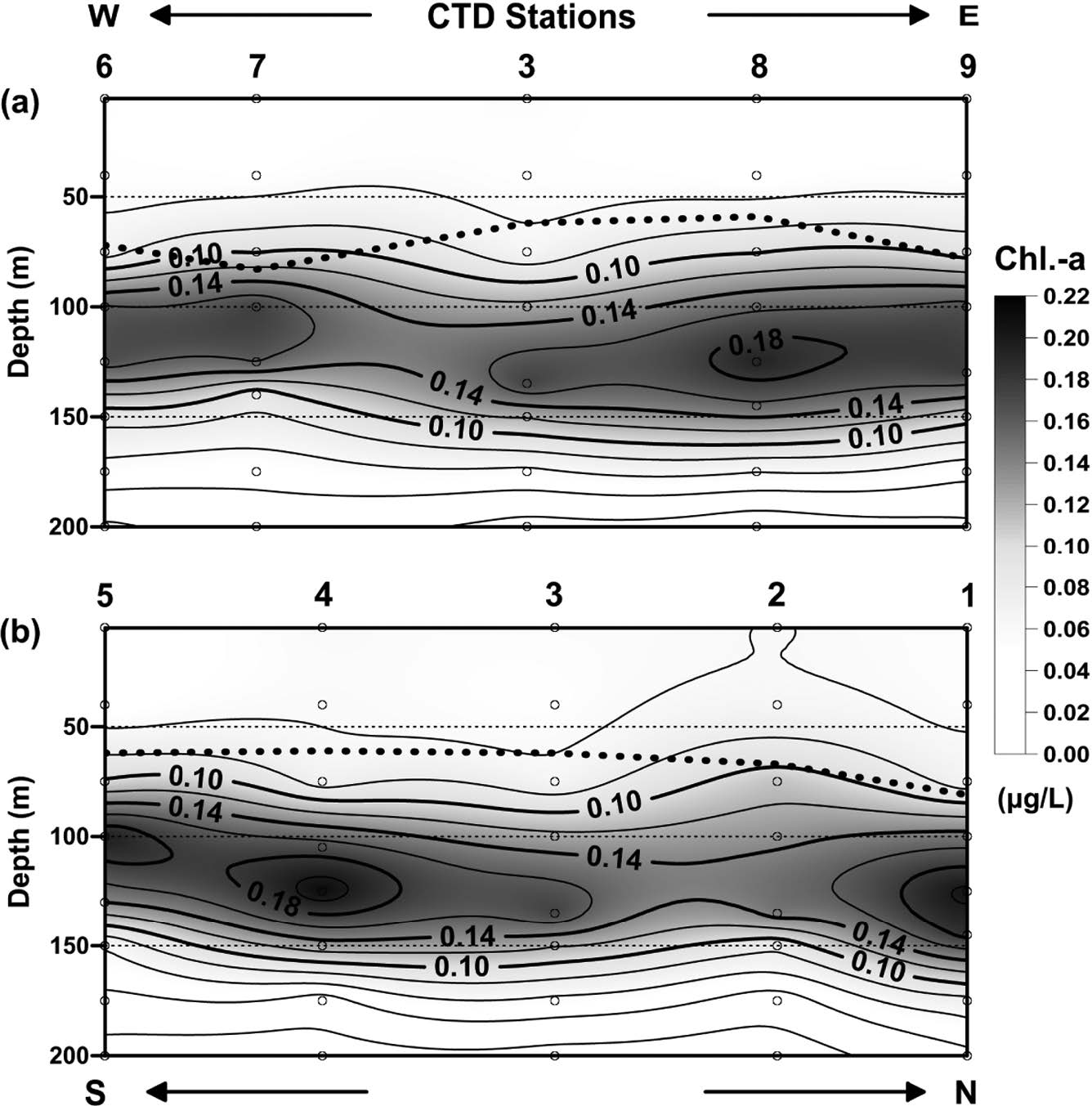
Vertical distributions of chlorophyll-a in the (a) east-west line and (b) south-north line crossing the CTD sites. Dotted line represents the mixed layer depth (Contour interval is 0.02 μg/L).
동-서 및 남-북 라인의 표층(수심 200 m 이내)에서 파악된 엽록소-a 분포는 엽록소 최대층이 뚜렷하게 표면혼합층 수심 아래에 띠형태로 분포하였다(Fig. 11). 동-서 라인에서 최대 농도는 CTD8 정점(0.19 μg/L)에서, 남-북 라인에서는 CTD4 정점(0.21 μg/L)에서 관측되었으며, 해저산 정상부에 위치한 CTD3 정점을 중심으로 서쪽 해역과 남쪽 해역에서 미약하게나마 엽록소 최대층(등농도선 0.14 μg/L)이 반대편 해역에 비해 해수면 쪽으로 상승한 형태를 보였다. 이러한 수심 차이는 용존산소 분포에서 보인 저층수 유입 양상(수심 500 m 전후)이 표층 영역에까지 그 영향을 미치는 것으로 판단된다. 해저산 해역에서 Taylor Column(코리올리 효과의 한 특성; Taylor[1923])에 의한 영양염 포집과 지역적 용승으로 유발된 표층 내 일차 생산성 증가는 여러 연구를 통해 제시된 바 있다(Dower et al.[1992]; Furuya et al.[1995]; Genin and Dower[2007]).
연구 해역의 수심 500 m 이내에서 파악된 무기영양염(질소, 인) 분포는 표면혼합층에서 빈영양 환경이 발달해 있는 양상을 잘 나타냈으며, 이후 재무기질화 과정을 거쳐 수심 약 1,000 m 지점에서 가장 높은 농도를 나타내었다(Fig. 12). 특징적인 사항으로는 앞서 용존산소 분포에서 파악된 것처럼 수심 500 m를 전후로 영양염 농도가 높은 저층수의 유입 영향이 동쪽(그리고 북쪽) 해역에 비해 상대적으로 서쪽(그리고 남쪽) 해역에서 나타나는 것으로 추정되었고, 수심 2,000 m 이하의 저층에서도 상대적으로 낮은 농도의 영양염이 해저산을 중심으로 서쪽 해역과 남쪽 해역에서 광범위하게 분포하였다. 아울러 수심 500 m 이하의 동-서 라인에서는 해저산 정상부를 중심으로, 남-북 라인에서는 해저산 정상부에서 다소 북쪽으로 치우쳐 고농도의 영양염이 분포하는 형태가 관측되었다(Fig. 12). 이는 앞서 언급된 Taylor Column에 의한 영양염 포집 현상으로 여겨진다. 해저산 정상부에서는 해저산과 충돌하는 지속적인 흐름이 Taylor Column을 발생시키고(Huppert[1975]; Owens and Hogg[1980]), 이로부터 종종 와류가 형성되는 것으로 알려져 있다(Freeland[1994]). Mohn et al.[2009]의 연구에서도 북대서양 동부 해역에 위치한 ‘Sedlo(26°40'W, 40°19'N)’로 명명된 해저산에서 음향도플러유속계 운영을 통해 해저산 정상부(수심 약 780 m) 부근에서 강한 와류 형태의 흐름이 보고된 바 있다.
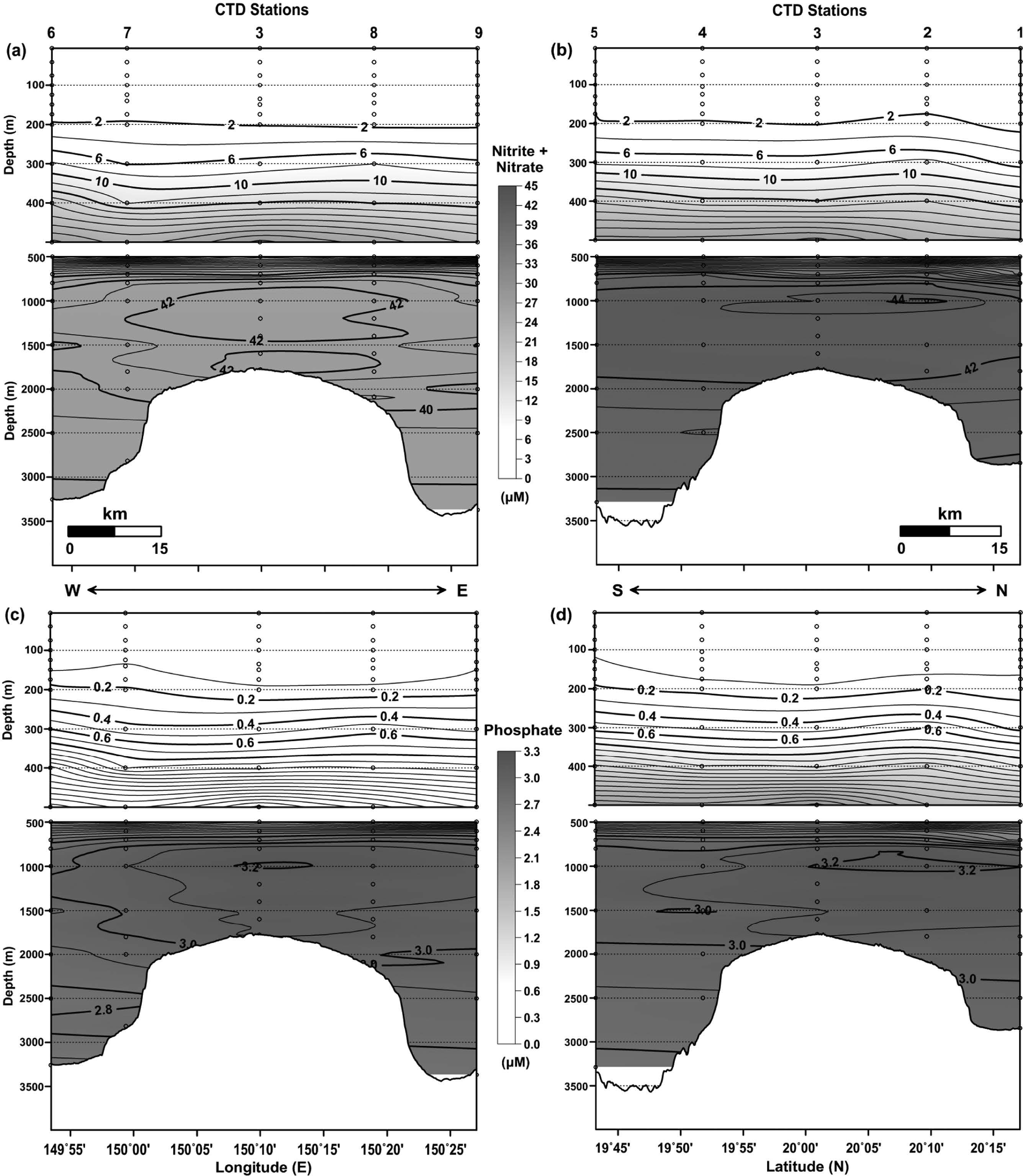
Vertical distributions of nitrite + nitrate ((a) and (b)) and phosphate ((c) and (d)) in the east-west line (Left) and south-north line (Right) crossing the CTD sites (Contour intervals of nitrite + nitrate are 2 μM and 1 μM in the upper and lower water column, respectively, and that of phosphate is 0.1 μM in the both water column).
한편, 연구 해역에서 Redfield ratio(N:P=16:1)을 이용하여 인산염(P) 농도로부터 예상되는 질산염(NN:P) 농도와 분석된 질산염(N)농도와의 차이로부터 Excess N(N*=N-NN:P; Gruber and Sarmiento[1997]) 농도를 계산한 결과 연구 해역 전반에 걸쳐 음의 값을 갖는 것으로 파악되었다(Fig. 13). 일반적으로 Excess N 농도는 탈질화 과정을 통한 제거 기작(sink process)이 우세한 해역(예, 용존산소 최소층)에서 낮은 값을 갖는 특징이 있으며, 질소 고정과 같이 공급기작(source process)이 왕성한 해역(예, 표층)에서는 높은 값을 갖는 특징이 있다(Hansell et al.[2004]; Kim et al.[2014c]).
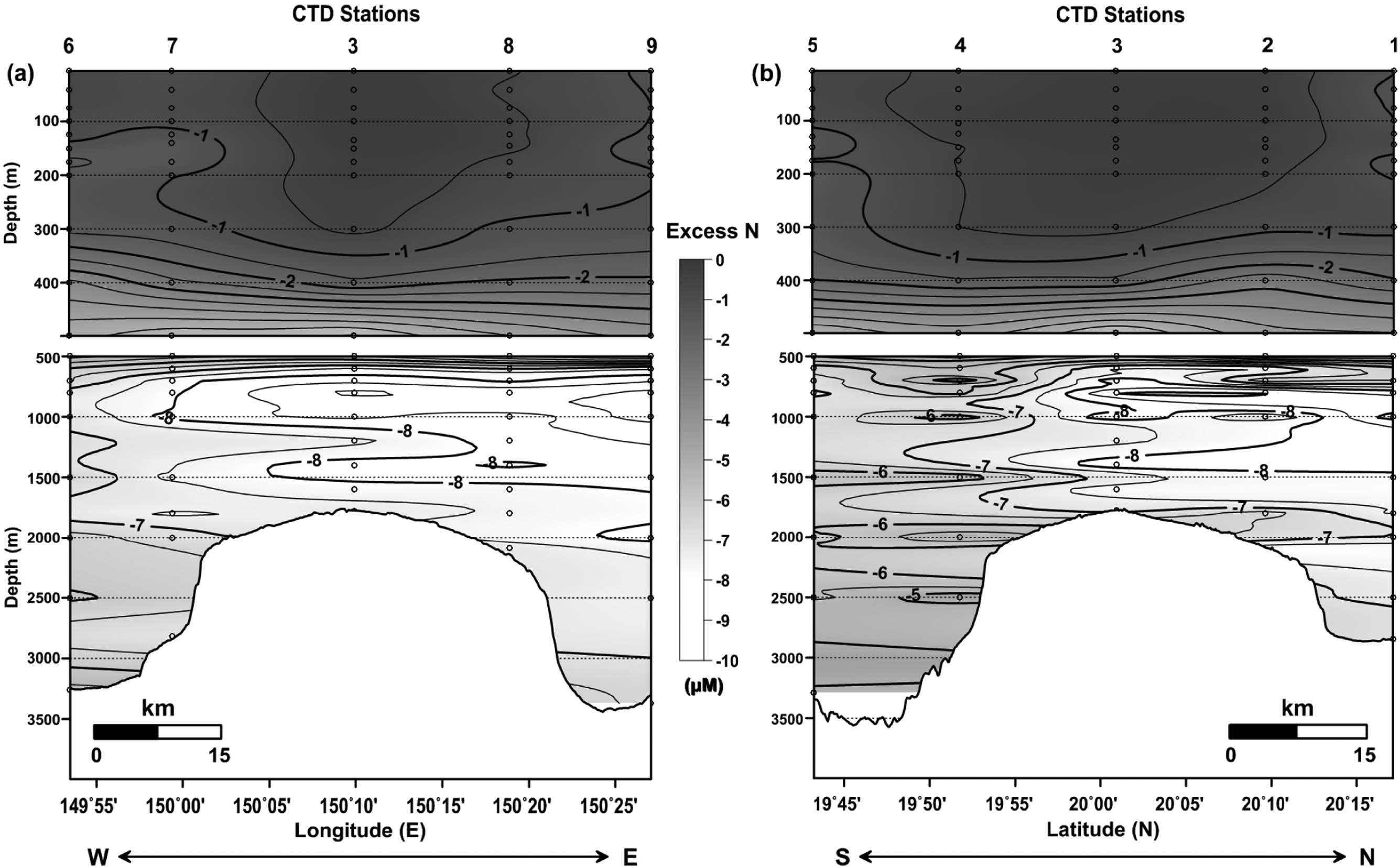
Vertical distributions of Excess N in the (a) east-west line and (b) south-north line crossing the CTD sites (Contour interval is 0.5 μM in the upper and lower water column).
연구 해역(동-서 및 남-북 라인) 수심 500 m 이내에서 파악된 Excess N 농도 분포는 해수면 쪽으로 갈수록 값이 커지는 양상이 나타났으며, Kim et al.[2014c]이 2000년대 후반 서태평양 해역(150°E, 20°N~30°N) 수심 300~400 m에서 보고한 Excess N 농도(-2~-0.5 μmol/kg)와 연구 해역에서 파악된 값은 큰 차이 없이 유사하였다. 아울러 수심 300 m 이내에서는 해저산에 위치한 정점들을 중심으로 주변에 비해 상대적으로 높은 Excess N 값이 분포하는 특징을 보였다(Fig. 13). Kiriakoulakis et al.[2009]의 연구에 의하면 북대서양 동부에 위치한 해저산(Seine, 14°21'W, 33°46'N) 해역 표층에서 여름철에 δ15N 값은 고갈된 상태로 분포하는 것이 조사되었고, 질소 고정을 통해 생성된 유기물은 낮은 δ15N 값을 갖는 것으로 알려져 있다(Somes et al.[2010]). 따라서 본 연구 해역에서도 비록 δ15N 분석이 이루어지지 않았지만 해저산이 위치한 표층을 중심으로 질소 고정에 의한 유기물 생성의 가능성이 있는 것으로 생각되며, 추가적인 연구를 통해 보다 명확하게 질소 순환 과정을 이해할 필요가 있다.
연구 해역 수심 500 m 이하에서 파악된 Excess N 농도 분포는 탈질화 과정이 우세하게 일어나는 것으로 알려진 용존산소 최소층(수심 700~1,200 m)에서 가장 낮은 값(-8 μM 이하)을 보였고, 동-서 라인에서는 동쪽 해역에 그리고 남-북 라인에서는 북쪽 해역에 다소 치우쳐 분포하였다(Fig. 13). 한편, 용존산소 최소층 이하의 수심에서는 서쪽 해역과 남쪽 해역에서 반대 해역(동쪽과 북쪽)보다 상대적으로 높은 Excess N 값을 나타냈으며, 특히 수심 2,500 m 이하에서는 서쪽 해역보다 남쪽 해역에서 비교적 높은 -5 μM 정도의 Excess N 값이 관측되었다. 연구 해역 저층에서 우세하게 존재하는 북태평양 심층수(주로 수심 2,500~4,500 m에 분포) 수괴는 17°N이남에서 북동태평양에서 서태평양으로 유입된 후 Izu-Ogasawara-Mariana Ridge를 따라 북쪽으로 흐르다가 약 25°N 지점에서 동쪽으로 빠져 나가는 것으로 알려져 있다(Wijffels et al.[1998]). 또한 Kim et al.[2014c]은 전반적인 북태평양(약 150°E~135°W, 28°N~35°N) 저층의 Excess N 값이 평균적으로 -4 μmol/kg 정도를 갖는 것으로 보고하였다. 이러한 사실로부터, 연구 해역의 동쪽과 북쪽 해역이 서쪽과 남쪽 해역에 비해 낮은 Excess N 값을 보인 결과는 이들 해역에서 질소 제거 기작이 우세하기 보다는 서쪽과 남쪽 해역으로 상대적으로 높은 Excess N 값을 갖는 수괴가 유입되어 결과적으로 희석 효과로 여겨지며, 높은 Excess N 값을 갖는 수괴는 보다 우세하게 남쪽 해역 저층을 통해 유입되는 것으로 판단된다.
4. 결 론
서태평양 공해상(150.2°E, 20°N 부근)에 위치한 해저산(OSM14-2)을 대상으로 동-서 및 남-북 방향으로 총 9개의 정점을 선정해 수층 환경 인자의 거동 변화로부터 해저산 해역의 동적인 환경 특성을 살펴보았다. 연구 해역에 분포하는 수괴는 주로 북태평양 열대수, 수온약층수, 북태평양 중층수, 북태평양 심층수로 파악되었다. 망간각 형성 과정에 중요하게 작용하는 용존산소 최소층은 연구 해역 전반에 걸쳐 수심 700~1,200 m 사이에서 발달하였으며, 중심부(수심 800 m)에서의 평균 농도는 73.26 μM로 파악되었다. 일차 생산자의 양을 지시하는 엽록소-a는 표면혼합층 내에서 낮은 농도(~0.05 μg/L)로 분포하다 수심 100~135 m 사이에서 최대층(DCM, 최대 농도 0.21 μg/L)을 형성하였으며, 엽록소 최대층 출현 수심은 동쪽 해역보다는 서쪽 해역에서 그리고 북쪽 해역보다 남쪽 해역에서 상대적으로 얕게 분포하는 경향을 보였다. 해저산을 중심으로 동-서 및 남-북 방향의 수직 단면 분포에서 수층 환경 인자의 농도 특성은 서쪽과 남쪽 해역의 수심 500 m를 전후에서 저층수 유입 영향과 해저산 사면 및 기저부에서 동-서 및 남-북 해역 별로 차이를 갖는 것으로 파악되었다. 또한, 기존의 Redfield ratio를 이용하여 구한 Excess N 값은 연구 해역 전반에 걸쳐 음의 값을 나타내 질소 성분의 공급 기작 보다는 제거 기작이 우세한 환경임을 지시했으며, 동쪽 해역과 북쪽 해역에 비해 서쪽 해역과 남쪽 해역의 저층에서 상대적으로 높은 값을 보여 외부로부터 높은 Excess N 값을 함유한 수괴의 유입 영향을 받는 것으로 여겨졌다.
이상의 결과로부터, 해저산 OMS14-2 주변 해역은 동쪽과 북쪽 해역에 비해 서쪽과 남쪽 해역의 저층에서 해류의 상승 현상으로 유발된 수층 환경 인자들의 거동 변화가 감지됐으며, 이러한 영향은 수심 500 m 전후의 중층과 수심 200 m 전후의 표층 영역에까지 미치는 것으로 파악되었다. 아울러 남쪽 해역 저층에서 상대적으로 가장 높은 Excess N 값의 분포는 보다 우세한 저층 해류의 유입을 시사하였다. 결론적으로 해저산에 의한 지형적인 특성이 저층해류 순환에 영향을 미치고 이는 환경 인자들의 해역별 거동과 그에 따른 표층 생산성이나 질소 순환과 같은 유무기 물질의 반응 과정에 중요하게 작용하는 것으로 판단된다. 향후에는 해류계(경사가 완만한 해저산 정상부나 기저부 대상)나 음향도플러유속계(경사가 급한 사면 대상) 운영을 통해 환경 인자의 거동에 직접적인 영향을 주는 해저산 주변 해역의 해류 순환을 보다 상세하게 이해하고자 하며, 해역별 환경 인자의 거동 차이와 시계열 퇴적물 포집장치를 활용한 침강입자 플럭스 연구를 통해 유무기 물질의 순환 과정을 규명하고자 한다.
Acknowledgments
본 연구는 한국해양과학기술원의 “남서태평양 및 인도양 해양광 물자원 개발(PM58540)”의 지원을 받아 수행되었습니다. 논문의 심사과정에서 세심한 검토와 발전적인 조언을 주신 익명의 심사자님들께 깊은 감사를 드립니다.
References
-
Anderson, G.C., (1969), “Subsurface chlorophyll maximum in the Northeast Pacific Ocean”, Limnol. Oceanogr, 14(3), p386-391.
[https://doi.org/10.4319/lo.1969.14.3.0386]

-
Anderson, L.A., and Sarmiento, J.L., (1994), “Redfield ratios of remineralization determined by nutrient data analysis”, Global Biogeochem. Cycles, 8, p65-80.
[https://doi.org/10.1029/93GB03318]

-
Capone, D.G., Zehr, J.P., Paerl, H.W., Bergman, B., and Carpenter,, E.J., (1997), “Trichodesmium, a globally significant marine cyanobacterium”, Science, 276, p1221-1229.
[https://doi.org/10.1126/science.276.5316.1221]

-
Cavender-Bares, K.K., Karl, D.M., and Chisholm, S.W., (2001), “Nutrient gradients in the western North Atlantic Ocean: Relationship to microbial community structure and comparison to patterns in the Pacific Ocean”, Deep-Sea Res. I, 48(11), p2373-2395.
[https://doi.org/10.1016/S0967-0637(01)00027-9]

- Chaohui, S., Jianping, X., Zenghong, L., Mingrong, T., and Bokang,, Z., (2008), “Application of argo data in the analysis of water masses in the Northwest Pacific Ocean”, Mar. Sci. Bull, 10(2), p1-13.
- Conrad, T.A., and Hein, J.R., (2013), Water depth-composition trends in ferromanganese crusts adjacent to the California margin compared to those in equatorial Pacific crusts, American Geophysical UnionFall Meeting 2013, abstract OS11D-1671.
-
Cronin, M.F., and Kessler, W.S., (2002), “Seasonal and interannual modulation of mixed layer variability at 0°, 110°W”, Deep-Sea Res. I, 49, p1-17.
[https://doi.org/10.1016/S0967-0637(01)00043-7]

-
Dower, J., Freeland, H., Juniper, K., (1992), “A strong biological response to oceanic flow past Cobb Seamount”, Deep-Sea Res, 39, p1139-1145.
[https://doi.org/10.1016/0198-0149(92)90061-W]

-
Falkowski, P.G., (1997), “Evolution of the nitrogen cycle and its influence on the biological sequestration of CO2 in the ocean”, Nature, 387, p272-275.
[https://doi.org/10.1038/387272a0]

-
Freeland, H., (1994), “Ocean circulation at Cobb seamount”, Deep-Sea Res. I, 41, p1715-1732.
[https://doi.org/10.1016/0967-0637(94)90069-8]

- Furuya, K., Odate, T., and Taguchi, K., (1995), Effects of a seamount on phytoplankton production in the western Pacific Ocean, In H. Sakai, and Y. Nozaki (eds), Biogeochemical processes and ocean flux in the western Pacific, Terra Scientific Publishing Company, p255-273.
-
Genin, A., and Dower, J.F., (2007), Seamount plankton dynamics, In T.J. Pitcher (ed), Seamount ecology: Ecology, conservation and management. Fish and Aquatic Resources Series 12, Oxford, p85-100.
[https://doi.org/10.1002/9780470691953.ch5]

-
Glasby, G.P., Mountain, B., Vineesh, T.C., Banakar, V., Rajani,, R., and Ren, X., (2010), “Role of hydrology in the formation of Co-rich Mn crust from the Equatorial N Pacific, Equatorial S Indian and the NE Atlantic Ocean”, Resource Geol, 60(2), p165-177.
[https://doi.org/10.1111/j.1751-3928.2010.00123.x]

-
Gruber, N., and Sarmiento, J.L., (1997), “Global patterns of marine nitrogen fixation and denitrification”, Global Biogeochem. Cycles, 11(2), p235-266.
[https://doi.org/10.1029/97GB00077]

-
Hansell, D.A., Bates, N.R., and Olson, D.B., (2004), “Excess nitrate and nitrogen fixation in the North Atlantic Ocean”, Mar. Chem, 84, p243-265.
[https://doi.org/10.1016/j.marchem.2003.08.004]

- Hein, J.R., and Koschinsky, A., (2014), Deep-ocean ferromanganese crusts and nodule, Treatise on Geochemistry (2nd ed), Elsevier, p273-291.
- Hein, J.R., Koschinsky, A., Bau, M., Manheim, F.T., Kang, J.K., and Roberts, L., (2000), Cobalt-rich ferromanganese crusts in the Pacific, In D.S. Cronan (ed), Handbook of marine mineral deposits, CRC Press, London, p239-279.
-
Hein, J.R., Mizell, K., Koschinsky, A., and Conrad, T.A., (2013), “Deep-ocean mineral deposits as a source of critical metals for high- and green-technology applications: Comparison with landbased resources”, Ore Geol. Rev, 51, p1-14.
[https://doi.org/10.1016/j.oregeorev.2012.12.001]

-
Hirose, K., and Kamiya, H., (2003), “Vertical nutrient distributions in the Western North Pacific Ocean: Simple model for estimating nutrient upwelling, export flux and consumption rates”, J. Oceangr, 59, p149-161.
[https://doi.org/10.1023/A:1025535003841]

-
Huppert, H.E., (1975.), “Some remarks on the initiation of internal Taylor Columns”, J. Fluid Mech, 67, p397-412.
[https://doi.org/10.1017/S0022112075000377]

-
Kawabe, M., Fujio, S., and Yanagimoto, D., (2003), “Deep-water circulation at low latitude in the western North Pacific”, Deep-Sea Res. I, 50, p631-656.
[https://doi.org/10.1016/S0967-0637(03)00040-2]

-
Kim, E., Jeon, D., Shin, C.W., and Kim, D.G., (2014a), “Variation of the southern subtropical countercurrent related to sea surface height and eddies in the Northwest Tropical Pacific”, Ocean Sci. J, 49(1), p35-46.
[https://doi.org/10.1007/s12601-014-0005-x]

- Kim, H.J., Hyeong, K., Park, J.Y., Jeong, J.H., Jeon, D., Kim, E., and Kim, D., (2014b), “Influence of Asian monsoon and ENSO events on particle fluxes in the western suntropical Pacific”, Dee-Sea Res. I, 90, p139-151.
-
Kim, I.N., Lee, K., Gruber, N., Karl, D.M., Bullister, J.L., Yang,, S., and Kim,, T.W., (2014c), “Increasing anthropogenic nitrogen in the North Pacific Ocean”, Science, 346(6213), p1102-1106.
[https://doi.org/10.1126/science.1258396]

-
Kim, J., Ko, Y.T., Hyeong, K., and Moon, J.W., (2013), “Geophysical and geological exploration of cobalt-rich ferromanganese crists on a seamount in the Western Pacific”, Econ. Environ. Geol, 46(6), p569-580, (in Korean).
[https://doi.org/10.9719/EEG.2013.46.6.569]

-
Kim, T.H., and Kim, G., (2013), “Changes in seawater N:P ratios in the northwestern Pacific Ocean in response to increasing atmospheric N deposition: Results from the East (Japan) Sea”, Limnol. Oceanogr, 56(6), p1907-1914.
[https://doi.org/10.4319/lo.2013.58.6.1907]

-
Kiriakoulakis, K., Vilas, J.C., Blackbird, S.J., Aristegui, J., and Wolff, G.A., (2009), “Seamounts and organic matter-Is there an effect? The case of Sedlo and Seine seamounts, Part 2. Composition of suspended particulate organic matter”, Deep-Sea Res. II, 56, p2631-2645.
[https://doi.org/10.1016/j.dsr2.2008.12.024]

-
Klinkhammer, G.P., and Bender, M.L., (1980), “The distribution of manganese in the Pacific Ocean”, Ear. Plan. Sci. Lett, 46, p361-384.
[https://doi.org/10.1016/0012-821X(80)90051-5]

-
Lee, T.G., Hein, J.R., Lee, K., Moon, J.W., and Ko, Y.T., (2005), “Sub-seafloor acoustic characterization of seamounts near the Ogasawara Fracture Zone in the western Pacific using chirp (3-7 kHz) subbottom profiles”, Deep-Sea Res. I, 52, p1932-1956.
[https://doi.org/10.1016/j.dsr.2005.04.009]

-
Machin, F., Pelegri, J.L., Emelianov, M., Isern-Fontanet, J., White,, M., Bashmachnikov, I., and Mohn, C., (2009), “Mass and nutrient fluxes around Sedlo seamount”, Deep-Sea Res. II, 56, p2606-2617.
[https://doi.org/10.1016/j.dsr2.2008.12.038]

-
Michaels, A.F., Karl, D.M., and Capone, D.G., (2001), “Elemental stoichiometry, new production, and nitrogen fixation”, Oceangr, 14(4), p68-77.
[https://doi.org/10.5670/oceanog.2001.08]

- Millero, F.J., (2006), Chemical oceanography (3rd ed), CRC Press, p266-277.
- MLTM (Ministry of Land, Transportation and Marine Affairs), (1998), The report of dee sea mineral resources development, Korea Ocean Research and Development Institute, Ansan, p917, (in Korean).
-
Mohn, C., White, M., Bashmachnikov, I., Jose, F., and Pelegri,, J.L., (2009), “Dynamics at an elongated, intermediate depth seamount in the North Atlantic (Sedlo Seamount, 40°20'N, 26°40'W)”, Deep-Sea Res. II, 56, p2582-2592.
[https://doi.org/10.1016/j.dsr2.2008.12.037]

-
Muinos, S.B., Hein, J.R., Frank, M., Monteiro, J.H., Gaspar, L., Conrad, T., Pereira, H.G., and Abrantes, F., (2013), “Deep-sea Fe-Mn crusts from the Northeast Atlantic Ocean: Composition and resource considerations”, Mar. Geores. Geotech, 31(1), p40-70.
[https://doi.org/10.1080/1064119X.2012.661215]

-
Owens, W.B., and Hogg, N.G., (1980), “Oceanic observations of stratified Taylor columns near a bump”, Dee-Sea Res, 27, p1029-1045.
[https://doi.org/10.1016/0198-0149(80)90063-1]

- Parsons, T.R., Maita, Y., and Lalli, C.M., (1984), A manual of chemical and biological methods for seawater analysis, Pergamon Press, p173.
-
Paulmier, A., and Ruiz-Pino, D., (2009), “Oxygen minimum zones (OMZs) in the modern ocean”, Prog. Oceanogr, 80, p113-128.
[https://doi.org/10.1016/j.pocean.2008.08.001]

- Qui, B., (2001), Kuroshio and Oyashio currents, In J.H. Steele (ed), Encyclopedia of ocean sciences, Academic Press, New York, p1413-1425.
- Redfield, A.C., Ketchum, B.H., and Richards, F.A., (1963), The influence of organisms on the composition of sea-water, M.N. Hill (ed), The Sea, 2, Wiley, New York, p26-77.
-
Rousseaux, C.S., and Gregg, W.W., (2014), “Interannual variation in phytoplankton primary production at a global scale”, Remote Sens, 6, p1-19.
[https://doi.org/10.3390/rs6010001]

-
Samuelsen, A., Hjollo, S.S., Johannessen, J.A., and Patel, R., (2012), “Particle aggregation at the edges of anticyclonic eddies and implications for distribution of biomass”, Ocean Sci, 8, p389-400.
[https://doi.org/10.5194/os-8-389-2012]

-
Sardans, J., Rivas-Ubach, A., and Penuelas, J., (2012), “The elemental stoichiometry of aquatic and terrestrial ecosystems and its relationships with organismic lifestyle and ecosystem structure and function: a review and perspectives”, Biogeochemistry, 111, p1-39.
[https://doi.org/10.1007/s10533-011-9640-9]

-
Siedler, G., Holfort, J., Zenk, W., Muller, T.J., and Csernok, T., (2004.), “Deep-water flow in the Mariana and Caroline basins”, J. Physic. Oceanogr, 34, p566-581.
[https://doi.org/10.1175/2511.1]

-
Somes, C.J., Schmittner, A., Galbraith, E.D., Lehmann, M.F., Altabet, M.A., Montoya, J.P., etelier, R.M., Mix, A.C., Bourbonnais, A., and Eby, M., (2010), “Simulating the global distribution of nitrogen isotopes in the ocean”, Global Biogeochem. Cycles, 24(G4019), p1-16.
[https://doi.org/10.1029/2009gb003767]

-
Son, J.W., Kim, K.H., Kim, M.J., Son, S.K., and Chi, S.B., (2011), “Distribution and inter-annual variation of nutrients (N, P, Si) and organic carbon (DOC, POC) in the Equatorial thermocline ridge, Northeast Pacific”, Ocean and Polar Res, 33(1), p55-68, (in Korean).
[https://doi.org/10.4217/OPR.2011.33.1.055]

- SPC (Secretariat of the Pacific Community), (2013), Deep sea minerals: Cobalt-rich ferromanganese crusts, a physical, biological environmental, and technical review, In E. Baker, and Y. Beaudoin (eds), 1C.
- Stommel, H., and Yoshida, K., (1972), Kuroshio, University of Tokyo Press, p95-127.
-
Talley, L.D., (1991), “An Okhotsk Sea-water anomaly-implications for ventilation in the North Pacific”, Deep-Sea Res. I, 38, p171-190.
[https://doi.org/10.1016/S0198-0149(12)80009-4]

- Talley, L.D., (2007), Hydrographic atlas of the world ocean circulation experiment (WOCE), 2, Pacific Ocean, International WOCE Project Office, Southampton, UK, ISBN 0-904175-54-5.
-
Taylor, G.I., (1923), Experiments on the motion of solid bodies in rotating fluids, Proceedings of the Royal Society, London A, 104, p213-218.
[https://doi.org/10.1098/rspa.1923.0103]

- Venrick, E.L., McGowan, J.A., and Mantyla, A.W., (1973), “Deep chlorophyll maxima in the oceanic Pacific”, Fish Bull, 71, p41-52.
-
Verlaan, P.A., Cronan, D.S., and Morgan, C.L., (2004), “A comparative analysis of compositional variations in and between marine ferromanganese nodules and crusts in the South Pacific and their environmental controls”, Prog. Oceanogr, 63, p125-158.
[https://doi.org/10.1016/j.pocean.2004.11.001]

-
Vilas, J.C., Aristegui, J., Kiriakoulakis, K., Wolff, G.A., Espino, M., Polo, I., Montero, M.F., and Mendonca, A., (2009), “Seamounts and organic matter-Is there an effect? THe case of Sedlo and Seine seamounts: Part 1. Distribution of dissolved and particulate organic matter”, Deep-Sea Res. II, 56, p2618-2630.
[https://doi.org/10.1016/j.dsr2.2008.12.023]

-
Wijffels, S.E., Hall, M.M., Joyce, T., Torres, D., Hacker, P., and Firing, E., (1998), “Multiple deep gyres of the western North Pacific: A WOCE section along 149E”, J. Geophy. Res, 103(C6), p12985-13009.
[https://doi.org/10.1029/98JC01016]

-
Wright, J.J., Konwar, K.M., and Hallam, S.J., (2012), “Microbial ecology of expanding oxygen minimum zones”, Nature Rev, 10, p381-394.
[https://doi.org/10.1038/nrmicro2778]

-
Yasuda, I., (1997), “The origin of the North Pacific Intermediate Water”, J. Geophys. Res, 102(C1), p893-909.
[https://doi.org/10.1029/96JC02938]