해수와 제지슬러지소각재의 광물탄산화 반응을 이용한 이산화탄소 저장 연구
초록
광물탄산화는 이산화탄소를 칼슘, 마그네슘 등을 함유한 금속산화물과 반응시켜 영구적으로 저장하는 기술이다. 본 연구에서는 직접탄산화 방법으로 이산화탄소를 저장하기 위해 해수와 알칼리성 산업부산물인 제지슬러지소각재(PSA)를 사용하였다. 다양한 실험을 통해 해수와 PSA를 이용한 직접탄산화 반응의 최적 용매의 양(해수와 PSA의 혼합비)과 반응시간을 찾았고, PSA를 이용한 직접탄산화 반응에 해수와 초순수를 각각 용매로 사용했을 때의 이산화탄소 저장량을 비교하였다. 이산화탄소 저장량은 탄산화반응 후 고체증가량과 열중량분석 결과를 이용해서 계산하였다. 실험에 사용한 PSA는 미세하고 67.2%의 칼슘을 포함하였다. 25 °C, 1기압에서 해수를 PSA와 혼합하여 이산화탄소를 0.05 L/min 유량으로 주입하는 탄산화반응의 최적 용매의 양과 반응시간은 각각 5 mL/g, 2시간이었다. 해수와 초순수를 용매로 사용해서 PSA와 각각 혼합한 다음 탄산화했을 때, 이산화탄소 저장량은 각각 113, 101 kg CO2/(ton PSA)이었다. 해수를 사용하여 탄산화한 고체는 대부분 calcite 형태의 탄산칼슘과 소량의 탄산마그네슘으로 구성되어있었고, 초순수를 사용했을 때의 고체도 calcite 형태의 탄산염임을 확인하였다.
Abstract
Mineral carbonation is a technology for permanently storing carbon dioxide by reacting with metal oxides containing calcium and magnesium. In this study, we used sea water and alkaline industrial by-product such as paper sludge ash (PSA) for the storage of carbon dioxide through direct carbonation. We found the optimum conditions of both sea water content (mixing ratio of sea water and PSA) and reaction time required in the direct carbonation through various experiments using sea water and PSA. In addition, we compared the amounts of carbon dioxide storage with the cases when sea water and ultra-pure water were separately used as solvents in the direct carbonation with PSA. The amount of carbon dioxide storage was calculated by using both solid weight increase through the carbonation reaction and the contents of carbonate salts from thermal gravimetric analysis. PSA particle used in this study contained 67.2% of calcium. The optimum sea water content and reaction time in the carbonation reaction using sea water and PSA were 5 mL/g and 2 hours, respectively, under the conditions of 0.05 L/min flow rate of carbon dioxide injected at 25 °C and 1 atm. The amounts of carbon dioxide stored when sea water and ultra-pure water were separately used as solvents in the direct carbonation with PSA were 113 and 101 kg CO2/(ton PSA), respectively. The solid obtained through the carbonation reaction using sea water and PSA was composed of mainly calcium carbonate in the form of calcite and a small amount of magnesium carbonate. The solid obtained by using ultra-pure water, also, was found to be carbonate salt in the form of calcite.
Keywords:
Sea water, Paper Sludge Ash, Carbon Dioxide, Storage, Mineral Carbonation키워드:
해수, 제지슬러지소각재, 이산화탄소, 저장, 광물탄산화1. 서 론
지구온난화는 현재 전 세계적인 환경문제이다. 지구온난화의 원인물질은 아산화질소(N2O), 메탄(CH4), 육불화황(SF6), 수소불화탄소(HFCs), 과불화탄소(PFCs) 이산화탄소(CO2) 등의 온실가스로 밝혀졌으며, 이산화탄소는 다른 온실가스에 비해 지구온난화지수는 낮지만 전체 온실가스 배출량의 77%를 차지하기 때문에 세계기상기구(WMO)와 국제연합환경계획(UNEP)은 이산화탄소가 온난화의 주범이라고 공식적으로 선언하였다(IPCC[2007]). 세계 각국은 기후변화협약, 교토의정서, 탄소배출권거래제 등 다양한 정책으로 대기 중 이산화탄소 농도를 제어하기 위한 노력을 기울이고 있으며, 이산화탄소 포집 및 저장(Carbon Capture and Storage, CCS)에 관한 연구도 활발하게 진행되고 있다.
광물탄산화는 이산화탄소를 저장하는 기술 중의 하나로 이산화탄소를 칼슘이나 마그네슘 등을 함유한 금속산화물과 반응시켜 불용성의 탄산염광물로 안정하게 저장하는 기술이며, 그 원리는 다음 식과 같다(Kim and Kim[2015]).
| (1) |
| (2) |
| (3) |
위 반응식에 따라 원료로부터 용출되는 칼슘 및 마그네슘의 농도와 슬러리의 pH가 높을수록 더 많은 양의 이산화탄소를 저장할 수 있다. 그러므로 광물탄산화에서는 이산화탄소와 반응할 금속산화물의 양이 많은 원료를 사용하고, 이산화탄소와 금속산화물이 충분히 반응할 수 있는 여건을 조성하는 것이 중요하다. 광물탄산화의 원료물질로 칼슘이나 마그네슘을 다량 함유한 천연광물 또는 알칼리 산업부산물을 사용할 수 있다. 사문석, 규회석, 감람석 등의 천연광물이 광물탄산화 원료로 사용되어왔고, 최근에는 환경적으로 그리고 동시에 경제적으로 이점이 많은 알칼리성 산업부산물(슬래그, 시멘트 부산물, 소각재 등)을 많이 사용하고 있는 추세이다(Kim and Kim[2015]).
제지슬러지소각재(Paper Sludge Ash, PSA)는 제지공정(Paper making process)에서 발생하는 슬러지를 소각시킨 산업부산물로 다량의 칼슘을 함유하고 있다(Gunning et al.[2010]). 또한 PSA는 물과 반응하여 pH 12 이상의 높은 알칼리성을 나타내고, 입자가 미세하여 표면적이 넓기 때문에 광물탄산화에 매우 유리한 조건을 갖추고 있다. 지금까지 전 세계적으로 PSA를 광물탄산화의 원료로 사용하여 이산화탄소를 저장하는 연구가 몇 번 진행되었다. Gunning et al.[2010]은 6가지 종류의 PSA를 이용하여 탄산화 실험을 진행하였다. 이들은 PSA와 물을 혼합하여 부드러운 반죽을 만든 다음, 이산화탄소 압력이 2 bar로 유지되는 반응용기 내에서 72시간 동안 탄산화하여 최대 26%의 탄산화효율을 얻었다. 연구결과를 바탕으로 이들은 칼슘의 함량보다는 칼슘의 결합형태가 탄산화효율을 결정하는 중요한 인자라고 결론지었다. 즉 산업부산물 내에서 칼슘이 산화칼슘 또는 수산화칼슘 형태로 존재할 때 탄산화반응이 잘 일어난다. 한편 Perez-Lopez et al.[2008]은 PSA와 유사한 제지공정에서 발생하는 분쇄 폐기물을 30 bar, 30 °C에서 48시간 동안 탄산화하여 218 kg CO2/(ton waste)를 저장하였다. 이것은 산업부산물을 이용한 다른 광물탄산화 연구결과에 비해 많은 이산화탄소 저장량이지만, 실험 조건이 고압이라 에너지 사용량이 많고 반응시간 또한 매우 길어 실제 현장에 적용하는데 어려움이 있다.
해수는 탄산화반응에 참여할 수 있는 칼슘과 마그네슘을 포함하고 있으며, 그 평균 농도는 각각 411 mg/L, 1290 mg/L이다(Leggett and Rao[2015]). 또한 해수는 나트륨, 칼륨 등의 양이온과 중탄산, 탄산 등의 음이온을 다량 함유하고 있어 완충작용이 가능하기 때문에 pH가 급격하게 변하지 않는다. 해수에 포함된 성분의 농도를 Table 1에 나타내었다.
해수를 이용하여 이산화탄소를 저장하는 연구는 많이 진행되지 않았고, 대부분의 연구는 일반 해수가 아닌 염수(brine)를 가지고 진행되었다. Soong et al.[2004]은 칼슘, 칼륨, 나트륨, 마그네슘 등이 고농도로 존재하는 염수의 pH를 수산화칼륨으로 조절한 후, 이산화탄소를 주입하여 탄산화하는 실험을 다양한 pH, 이산화탄소 압력, 온도 조건에서 실시하였다. 이들이 pH를 11까지 높였을 때 11.5 g/L의 고체를 회수하였고, 이 고체는 95%의 CaCO3와 5%의 Fe2O3가 혼합되어 있었다. 이들은 이산화탄소 저장량에 가장 큰 영향을 미치는 것은 pH이고, 이산화탄소 압력이나 온도 조건이 달라져도 이산화탄소 저장량은 크게 달라지지 않았다고 보고했다. 또한 Druckenmiller et al.[2005]은 세 가지 종류의 염수를 가지고 다양한 온도, 이산화탄소 압력, pH 조건에서 각각 탄산화 실험을 진행하였는데, 이들 역시 탄산화반응에 가장 큰 영향을 미치는 것은 pH라고 보고했다. 한편 Soong et al.[2006]은 칼슘과 마그네슘의 농도가 높은 염수에 pH 조절물질로 석탄회를 혼합하여 탄산화반응을 진행하였다. 탄산화 후 고체의 무게가 21.9 g/L 증가하였고, 약 30%가 탄산칼슘으로 이루어져있는 것을 확인하였다. 이들은 탄산화반응 이후에 증가한 고체질량이 이산화탄소 저장에 의한 것이라고 판단하여 탄산화효율을 계산하였다. 앞에 설명한 해수를 이용한 세 가지 연구결과에 의하면, 칼슘 및 마그네슘의 농도와 pH는 탄산화효율에 영향을 미치는 가장 중요한 인자이다(Kim and Kim[2015]).
본 연구에서는 PSA와 해수를 이용하여 직접탄산화 방법으로 이산화탄소를 저장하는 최적조건을 찾기 위해 다양한 용매의 양과 반응시간 조건에서 실험을 수행하였다. 그리고 초순수와 해수를 용매로 사용하여 PSA와 각각 혼합한 다음, 앞서 도출한 최적조건에서 탄산화반응을 진행하여 용매에 따른 이산화탄소 저장량을 비교하였다. 해수는 탄산화반응에 기여하는 물질인 칼슘과 마그네슘이 용해되어있고, 중탄산이온을 비롯한 다양한 이온이 포함되어있기 때문에 완충능이 크다. 이와 같은 이유 때문에 해수를 이용하여 이산화탄소를 저장하면 유리할 것이라고 예상했다. 뿐만 아니라 해수의 pH를 12 이상으로 높이고, 칼슘과 마그네슘을 공급하기 위해 알칼리 산업부산물인 PSA와 혼합하여 이산화탄소를 저장하였다.
2. 실험 재료 및 방법
2.1 해수 및 PSA 분석
본 연구에 사용한 PSA는 국내 H 제지회사에서 공급받았고, 건조한 다음 균일하게 섞어서 데시케이터에 보관하였다. 해수는 부산 연안에서 채취하여 1 μm 유리섬유여과지로 여과하였다. 해수의 칼슘과 마그네슘 농도는 AAS(AA200, Perkin Elmer)를 이용하여 측정하였고, 해수와 탄산화과정 중 슬러리의 pH는 pH meter(Orion star 211, Thermo)를 이용하여 측정하였다. PSA에 함유된 성분의 함량 및 화합물 형태를 알기 위해 X선 형광분석(XRF-1700 X-ray Fluorescence, Shimadzu) 및 X선 회절분석(XRD, X'Pert-MPD System X-ray diffractiometry, Philips)을 실시하였다.
PSA에 함유된 칼슘과 마그네슘은 이산화탄소와 반응하여 최종적으로 탄산염 형태로 저장된다. 그런데 탄산화반응 이전에 PSA에 이미 존재하는 탄산염이 있을 수 있으므로 PSA의 열중량분석(TGA-7 Thermo Gravimetric Analysis, Perkin Elmer)을 실시하여 탄산화전 PSA에 포함된 탄산칼슘, 탄산마그네슘의 함량을 계산하였다.
2.2 탄산화반응
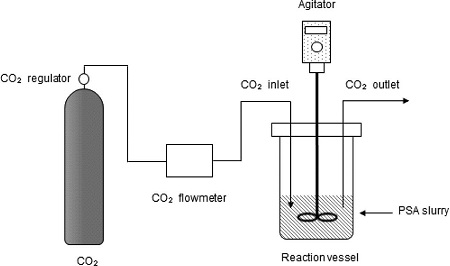
해수와 PSA를 이용한 탄산화반응 실험은 연속흐름 방식으로 이루어졌으며, 이산화탄소 저장을 위한 실험의 전체 개략도는 Fig. 1과 같다. 실험을 위해 탄산화 반응조를 직접 제작하였다. Pyrex 재질로 제작된 반응조는 1 L 용량이고, 상단에 이산화탄소 유입부 및 유출부, 교반부를 각각 설치하였다. 그리고 탄산화반응에는 99% 이산화탄소를 사용하였고, 이산화탄소 유량을 조절하기 위해 유량조절기 및 유량계를 설치하였다.
다양한 용매의 양과 반응시간 조건에서 탄산화반응을 진행하여 해수와 PSA를 이용한 직접탄산화의 최적조건을 결정하였고, 해수를 이용한 탄산화효율을 초순수를 이용했을 때의 효율과 비교하는 실험을 실시하였다.
다양한 용매의 양 조건을 만들기 위해 PSA의 양을 고정한 상태에서 혼합하는 해수의 부피를 달리하였다. 반응조에 PSA 20 g과 일정 부피(40, 100, 200, 500, 1000 mL)의 해수를 각각 넣어 슬러리 상태로 만든 다음, 25 °C에서 250 rpm으로 5분 동안 교반하였다. 슬러리를 교반하면서 이산화탄소를 0.05 L/min 유량으로 2시간 동안 주입하여 탄산화하였다. 슬러리를 0.45 μm 멤브레인 필터로 여과한 후 여과액의 pH를 측정하였다. 고체를 초순수로 충분히 씻은 다음, 105 °C에서 12시간 동안 건조하여 무게를 측정하였다.
최적의 탄산화반응 시간을 도출하기 위해 10-300분 동안 반응시간을 달리하여 실험하였다. 반응조에 PSA 20 g과 해수 100 mL를 넣어 슬러리 상태로 만든 다음, 25 °C에서 250 rpm으로 5분 동안 교반하였다. 슬러리를 교반하면서 이산화탄소를 0.05 L/min 유량으로 일정 시간(10, 20, 30, 60, 120, 300분) 동안 주입하여 탄산화하였다. 이후 실험은 “2.2.1 PSA 단위 질량당 용매의 양 결정”에서와 동일한 방법으로 진행하였다.
해수가 탄산화반응에 미치는 영향을 알기 위해 초순수(Milli-Q Academic A10, Millipore)를 대조군으로 사용하여 실험을 수행하였다. 두 가지 용매(해수와 초순수)를 가지고 다음 실험을 각각 동일하게 진행하였다. 반응조에 PSA 20 g과 용매 100 mL를 넣어 슬러리 상태로 만든 다음, 25 °C에서 250 rpm으로 5분 동안 교반하였다. 슬러리를 교반하면서 이산화탄소를 0.05 L/min 유량으로 2시간 동안 주입하여 탄산화하였다. 이후 실험은 “2.2.1 PSA 단위 질량당 용매의 양 결정”에서와 동일한 방법으로 진행하였다. 고체를 TGA 분석하여 탄산화반응에 의해 생성된 탄산염(탄산칼슘, 탄산마그네슘)을 정량하였고, 이 결과를 기준으로 해수와 초순수를 이용한 이산화탄소 저장량을 각각 계산하였다. 또한 고체를 XRD 분석하였다.
3. 실험 결과 및 고찰
3.1 해수 및 PSA 분석
실험에 사용한 해수의 pH는 8.3으로 약알칼리성을 띠었고, 칼슘과 마그네슘 농도는 각각 474 mg/L, 1322 mg/L이었다. 이것은 문헌의 평균값과 비슷한 값이다. 일반적으로 표층해수의 pH는 염의 성분 및 농도에 따라 달라지지만 평균 8.3이고(Waters and Millero[2013]), 칼슘과 마그네슘의 평균농도는 각각 411 mg/L, 1290 mg/L이다(Leggett and Rao[2015]).
PSA는 미세하여 파쇄할 필요가 없을 뿐만 아니라 칼슘 함량이 높기 때문에 전처리없이 직접탄산화에 사용하기에 적합한 원료이다. XRF 분석결과에 의하면 PSA에 함유된 칼슘 함량은 67.2%로 매우 높았다(Table 2). 이것은 탄산칼슘이 종이의 품질을 향상시키기 위한 도공용 안료 및 충전제로 다량 사용되기 때문이다. 그러나 마그네슘 함량은 4.37%로 칼슘에 비해 매우 낮았다.
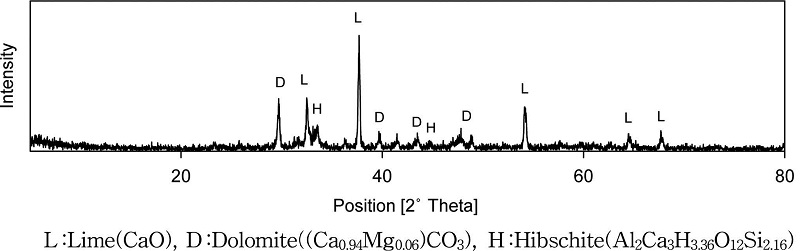
Fig. 2는 PSA의 XRD 분석결과이다. PSA의 칼슘은 주로 lime(CaO)과 dolomite[(Ca0.94Mg0.06)CO3]로 구성되어 있고, 그 외 칼슘, 알루미늄 및 규소가 결합된 hibschite (Al2Ca3H3.36O12Si2.16)가 일부 포함되어있었다(Fig. 2). 그 중 dolomite는 제지공정에 사용된 탄산칼슘 중 일부가 소각로에서 분해되지 않고 마그네슘과 결합된 형태로 PSA에 포함된 것으로 생각된다.
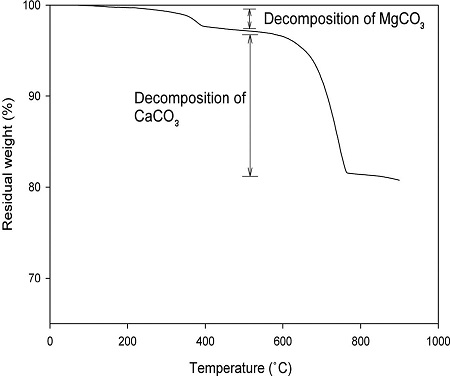
탄산화반응 전 PSA에 포함된 탄산칼슘과 탄산마그네슘의 함량을 분석하기 위해 실시한 TGA 분석결과를 Fig. 3에 나타내었다. TGA 분석에서 중량손실이 나타나는 원인은 25~105 °C에서는 수분 증발, 105~500 °C에서는 유기물, 원소 탄소, 탄산마그네슘 등의 분해, 500~780 °C에서는 탄산칼슘의 분해를 들 수 있다(Chang et al. [2011]). 본 실험에 사용한 PSA는 수분이 0.069%, 유기물, 원소 탄소, 탄산마그네슘 등이 2.722%, 탄산칼슘이 15.664% 포함되어 있다(Fig. 3).
3.2 탄산화반응
지금까지 연구자들은 산업부산물을 이용한 직접탄산화 효율을 높이기 위해 용매의 양, 반응시간, 반응온도, 이산화탄소의 압력 등의 조건을 달리하여 많은 실험을 수행하였다(Kim and Kim[2015]). 본 연구에서는 경제적인 방법으로 이산화탄소를 저장하기 위해 상온, 대기압 하에서 이산화탄소의 연속흐름 방식으로 탄산화실험을 실시했고, 직접탄산화 효율에 가장 영향이 큰 인자인 용매의 양과 반응시간의 최적조건을 찾고자하였다.
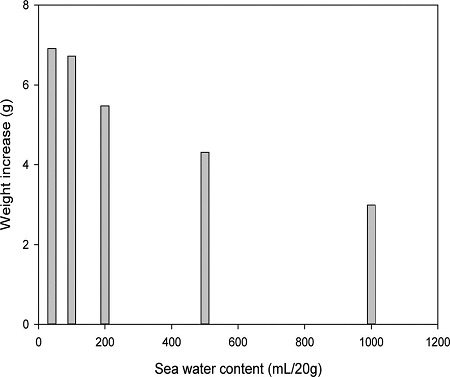
PSA의 양을 20 g으로 고정한 상태에서 해수의 함량을 40~1000 mL로 조절하여 직접탄산화했을 때 고체의 무게증가량을 Fig. 4에 나타내었다. 해수의 부피가 증가할수록, 즉 용매의 양이 증가할수록 최종 고체의 무게는 감소하였다. 예를 들면, 해수의 부피가 40 mL, 1000 mL일 때 최종 고체의 무게는 각각 26.9 g, 23.0 g이었다. 이것은 용매의 양이 적을수록 탄산화반응이 더 촉진되어 탄산칼슘과 탄산마그네슘이 더 많이 생성되는 것을 의미한다. 한편 해수의 부피가 40 mL, 100 mL일 때의 고체 무게증가량은 각각 6.9 g, 6.7 g으로 차이가 거의 없었다.
용매의 양의 영향을 살펴본 Chang et al.[2011]의 연구결과에 의하면 수분이 전혀 없는 상태에서는 슬래그의 탄산화효율이 매우 낮지만 액체/고체 비율이 10 mL/g 이 되면 탄산화효율이 57.5%에 이를 정도로 증가했다. 그러나 용매의 양이 더 증가해도 효율의 변화는 거의 없었다. 수분은 산업부산물로부터 칼슘이 용출되고 이산화탄소가 용해되어 탄산화반응이 일어나기위해 절대적으로 필요하다. 그러나 과량의 물이 있으면 물질전달 장벽이 생기고, 이온강도가 낮아져 칼슘이온의 용해속도가 느려지기 때문에 결국 탄산화반응이 방해받을 수 있다(Kim and Kim[2015]; Chang et al.[2011]). Ukwattage et al.[2013]는 석탄회를 이용한 직접탄산화 실험에서 액체/고체 비율이 0.2일 때 가장 높은 탄산화효율을 얻었고, 액체의 비율이 증가할수록 탄산화효율이 감소하였다. 그들은 물이 원료물질로부터 칼슘을 용해시키고 수산화칼슘을 생성하는 역할을 하지만, 과량의 물이 첨가되면 고체의 공극이 막혀 이산화탄소가 고체표면에 확산되기 어렵기 때문에 탄산화반응이 잘 일어나지 않으므로 적정 액체/고체 비율을 결정하는 것이 중요하다고 설명했다.
본 연구에서 용매의 양이 적을수록 탄산화효율이 증가하지만, PSA와 해수가 균일하게 혼합하여 슬러리 상태가 될 수 있을 정도의 해수는 필요하다. 연구결과 PSA 20 g과 혼합하는 해수의 부피가 40 mL, 100 mL 일 때 각각의 탄산화효율에 차이가 거의 없고, 해수의 부피가 100 mL 이하일 때는 교반이 어려웠다. 그래서 최적의 용매의 양 조건을 20 g/100 mL로 결정하였고, 다음 실험을 이 조건에서 수행하였다.
이산화탄소가 금속산화물과 반응하여 탄산염을 생성하기 위해서는 충분한 시간이 필요하다. 그러나 너무 긴 시간 동안 이산화탄소를 주입하면 생성된 탄산염이 재 용해될 우려가 있기 때문에 적절한 반응시간을 결정하는 것이 필요하다.
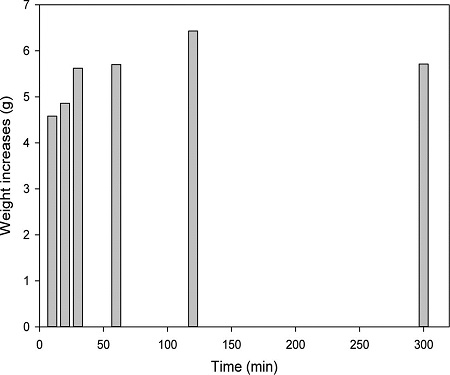
탄산화반응 시간을 10-300분으로 조절하여 실험했을 때 증가한 고체무게를 Fig. 5에 나타내었다. 탄산화반응 시간이 길어질수록 최종 고체증가량이 늘어나다가 120분 이후에는 감소하였다. 예를 들면 10분 동안 탄산화했을 때 고체의 무게증가량은 4.6 g으로 가장 적었고, 120분에는 그 값이 6.43 g까지 많아졌다. 그러나 탄산화반응시간이 300분이 되면 고체의 무게증가량은 5.7 g으로 적어졌고, 이 값은 60분 동안 탄산화했을 때와 비슷하였다. 반응시간이 120분보다 길어지면 생성된 탄산염이 재용해되기 때문에 고체의 질량이 감소했다고 사료된다.
선행연구에서 높은 탄산화효율을 얻기 위한 최적 반응시간은 산업부산물의 종류, 실험 조건에 따라 매우 다양했다. 예를 들면, Huntzinger et al.[2009]은 상온, 대기압에서 Cement Kiln Dust(CKD)를 이용하여 칼럼방식으로 탄산화했을 때 70% 이상의 높은 탄산화효율을 얻었으나, 반응시간이 2-12일로 매우 길었다. 한편, Teramura et al.[2000]은 폐콘크리트를 용매의 양 50%, 이산화탄소 압력 0.4 MPa 조건에서 직접탄산화 했을 때 탄산화반응이 1시간 이내에 완료되었고 탄산화효율은 약 96% 였다. 최적 탄산화반응 시간은 산업부산물의 종류, 용매의 양, 이산화탄소 압력 등에 따라 크게 달라지므로 일반화하기가 어렵다. 그러나 탄산화 시간이 너무 길면 기술을 현장에서 활용하는데 문제가 될 수 있고, 에너지 소모가 크기 때문에 적당한 반응시간을 찾는 것이 중요하다. 본 실험 결과에서는 120분 이상으로 이산화탄소를 주입했을 때 생성되었던 탄산칼슘이 일부 용해되어 탄산화효율이 낮아졌다. 따라서 본 연구조건에서 최적의 탄산화반응 시간을 120분으로 결정하였다.
해수와 초순수를 용매로 사용하여 PSA와 각각 5분 동안 반응시킨 슬러리의 pH는 두 가지 경우 모두 12.7 이상으로 높았다. 그러나 이산화탄소가 주입되고 탄산화반응이 진행되면서 pH는 지속적으로 낮아졌다. 특히 초순수를 용매로 사용한 경우에 pH 변화가 더 급격하게 나타났다. 예를 들면, 탄산화반응이 시작되고 4분 후에 해수와 초순수를 사용한 경우의 pH는 각각 11.3, 9.8이었다. 탄산화 반응 시간이 20분이 될 때까지는 해수를 사용한 경우의 pH가 초순수를 사용했을 때보다 최소 1 정도 더 높다가 그 이후에는 동일해졌다. 해수의 완충능이 초순수보다 크기 때문에 탄산화반응이 진행되는 동안 pH가 높게 유지되는 시간이 더 길어지고, 탄산화효율이 더 높게 나타났다고 사료된다. 높은 pH에서 이산화탄소는 CO32- 형태로 존재하기 때문에 금속산화물과 반응하여 불용성의 탄산염을 생성한다. 그러므로 높은 pH가 길게 유지될수록 더 많은 양의 이산화탄소를 저장할 수 있다.
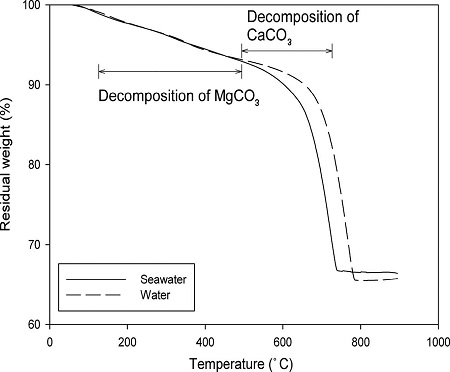
해수와 대조군인 초순수를 용매로 사용하여 동일한 조건에서 탄산화반응을 진행했을 때, 회수한 고체의 무게는 각각 26.43 g, 24.63 g이었다. 해수를 사용했을 때의 고체증가량이 더 크다는 것은 더 많은 양의 이산화탄소를 저장하였음을 의미한다. 탄산화반응에 의해 생성된 탄산염의 양을 정확하게 알기 위해 열중량분석을 실시하였고, 그 결과를 Fig. 6에 나타내었다.
Fig. 6에서 보는 바와 같이, 해수와 초순수를 사용한 경우에 105-500 °C에서 중량손실은 각각 6.49%, 6.35%이고, 이것은 탄산화반응 후 고체에 포함된 탄산마그네슘의 함량을 의미한다. 또한, 해수와 초순수를 사용한 경우에 500-780 °C에서 중량손실은 각각 25.92%, 26.38%이고, 이것은 탄산칼슘의 함량을 의미한다.
다음 식을 이용해서 탄산화반응에 의해 저장된 이산화탄소의 양을 계산하였다.
| (4) |
Wf : solid weight after carbonation (g)
Cf : CaCO3 or MgCO3 content after carbonation (%)
Wi : solid weight before carbonation (g)
Ci : CaCO3 or MgCO3 content before carbonation (%)
MWCO2 : molecular weight of CO2 (g/mol)
MWC : molecular weight of CaCO3 or MgCO3 (g/mol)
식 (4)는 탄산화반응 후 최종고체의 무게, 열중량분석의 온도별 중량손실 결과, 그리고 탄산화반응 전 PSA에 이미 함유되어있던 탄산염을 고려하여 만들어졌다. 먼저 생성된 탄산염이 탄산칼슘과 탄산마그네슘인 경우에 대해 각각 이산화탄소 저장량을 계산했고, 두 값을 더해서 총 이산화탄소 저장량을 얻었다. 해수와 초순수를 용매로 사용해서 PSA를 직접탄산화했을 때 이산화탄소 저장량은 각각 113 kg/(ton PSA), 101 kg/(ton PSA) 이었고, 해수를 사용했을 때의 이산화탄소 저장량이 초순수를 사용했을 때보다 10% 이상 많았다. 이것은 해수의 완충능으로 인해 탄산화반응이 진행되는 동안 슬러리의 pH가 초순수를 사용했을 때보다 서서히 낮아지므로 탄산화효율이 더 높았고, 초순수와는 달리 해수에는 칼슘과 마그네슘이 용존되어 있으므로 이산화탄소 저장량이 더 많았다고 사료된다.
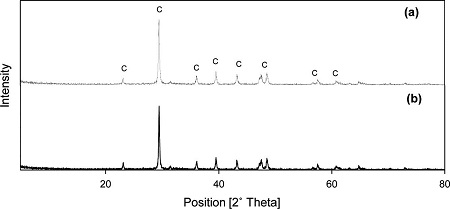
해수와 PSA를 혼합하여 탄산화한 후 회수한 고체를 XRD 분석했을 때, calcite(CaCO3) 형태의 탄산칼슘 피크만 나타났고 비정질 형태의 물질은 분석되지 않았다(Fig. 7). 탄산화 이전에 PSA의 칼슘은 Lime(CaO), Dolomite ((Ca0.94,Mg0.06)CO3), Hibschite (Al2Ca3H3.36O12Si2.16) 형태로 존재했는데, 이들이 탄산화과정에서 calcite로 전환된 것이다. 한편 초순수를 이용하여 탄산화한 후 회수한 고체는 역시 Lime, Hibschite는 검출되지 않았지만 Calcite는 발견되었다.
4. 결 론
본 연구에서는 해수와 PSA를 이용한 직접탄산화 반응의 최적 용매의 양과 반응시간을 찾았고, 해수와 초순수를 PSA와 각각 혼합한 다음 직접탄산화했을 때의 이산화탄소 저장량을 비교하였다. 연구결과는 다음과 같다.
(1) 25 °C, 대기압에서 해수를 PSA와 혼합한 다음, 이산화탄소를 0.05 L/min 유량으로 2시간 동안 주입하여 직접탄산화하는 반응의 최적 PSA 단위 질량당 용매의 양은 5 mL/g 이었다. 또한 해수를 PSA와 5 mL/g 비율로 혼합한 다음, 동일한 조건에서 직접탄산화하는 반응의 최적 반응시간은 2시간이었다. 각 경우에 탄산화반응 이후 고체의 증가량이 가장 큰 조건을 최적조건으로 결정했다.
(2) 해수와 초순수를 각각 용매로 사용하여 PSA와 5 mL/g 비율로 혼합한 다음, 이산화탄소를 0.05 L/min 유량으로 2시간 동안 주입하였을 때 이산화탄소 저장량은 각각 113, 101 kg CO2/(ton PSA)이었다.
(3) 해수를 이용하여 탄산화한 후 회수한 고체는 대부분이 calcite 형태의 탄산칼슘으로 이루어져있었고, 초순수를 이용하여 탄산화했을 때의 고체 역시 calcite 형태의 탄산염이었다.
본 연구에서는 상온, 대기압에서 해수와 PSA를 이용하여 이산화탄소를 저장하였고, 그 저장량도 기존 연구에 비해 적은 편이 아니다. 또한 원료와 탄산화하는 과정이 친환경적이고 경제적이다. 즉, 온도나 압력을 높이기 위해 에너지를 사용하지 않았고, 해안에서 쉽게 구할 수 있는 해수와 산업부산물인 PSA를 이용하여 효과적으로 이산화탄소를 저장하였기에 실용화 측면에서 그 의의가 크다. 향후 해수와 PSA를 이용한 탄산화 연구가 좀 더 큰 규모로 진행되고, 탄산화 이후 고체를 해양구조물의 재료 등으로 활용하는 연구가 진행되기를 기대한다.
Acknowledgments
이 논문은 2013년도 정부(교육과학기술부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업 임(NRF-2013R1A1A2012279).
References
-
Chang, E.E., Chen, C.H., Chen, Y.H., Pan, S.Y., and Chiang, P. C., (2011), “Performance evaluation for carbonation of steel-making slags in a slurry reactor”, J. Hazard. Mater, 186, p558-564.
[https://doi.org/10.1016/j.jhazmat.2010.11.038]

-
Druckenmiller, M.L., and Maroto-Valer, M.M., (2005), “Carbon sequestration using brine of adjusted pH to form mineral carbonates”, Fuel Process. Technol, 86, p1599-1614.
[https://doi.org/10.1016/j.fuproc.2005.01.007]

-
Gunning, P.J., Hills, C.D., and Carey, P.J., (2010), “Accelerated carbonation treatment of industrial wastes”, Waste Manage, 30, p1081-1090.
[https://doi.org/10.1016/j.wasman.2010.01.005]

-
Han, K.W., Rhee, C.H., and Chun, H.D., (2011), “Feasibility of mineral carbonation technology as a CO2 storage measure considering domestic industrial environment”, Korean Chem. Eng. Res, 49(2), p137-150.
[https://doi.org/10.9713/kcer.2011.49.2.137]

-
Huntzinger, D.N., Gierke, J.S., Sutter, L.L., Kawatra, S.K., and Eisele, T.C., (2009), “Mineral carbonation for carbon sequestration in cement kiln dust from waste piles”, J. Hazard. Mater, 168, p31-37.
[https://doi.org/10.1016/j.jhazmat.2009.01.122]

- IPCC, (2007), “Climate change 2007 mitigation of climate change, contribution of working group III to the fourth assessment report of the intergovernmental panel on climate change”, in Metz, B., Davidson, O., Bosch, P., Dave, R., Meyer, L. (Eds.), Cambridge University Press, Cambridge, United Kingdom and New York(NY), USA.
-
Kim, D.M., and Kim, M.J., (2015), “Mineral carbonation using industrial waste: review”, J. of Korea Society of Waste Management, 32(4), p317-328.
[https://doi.org/10.9786/kswm.2015.32.4.317]

- Kim, J.M., (2009), “Status and prospect of carbon dioxide storage technologies”, KIC news, 12(2), p31-41.
-
Leggett, C.J., and Ra, O.L., (2015), “Complexation of calcium and magnesium with glutarimidedioxime: Implications for the extraction of uranium from seawater”, Polyhedron, 95, p54-59.
[https://doi.org/10.1016/j.poly.2015.04.004]

-
Perez-Lopez, R., Montes-Hernandez, G., Nieto, J.M., Renard, F., and Charlet, L., (2008), “Carbonation of alkaline paper mill waste to reduce CO2 greenhouse gas emission into the atmosphere”, Appl. Geochem, 23, p2292-2300.
[https://doi.org/10.1016/j.apgeochem.2008.04.016]

-
Soong, Y., Goodman, A.L., McCarthy-Jones, J.R., and Baltrus, J.P., (2004), “Experimental and simulation studies on mineral trapping of CO2 with brine”, Energ. Convers. Manage, 45, p1845-1859.
[https://doi.org/10.1016/j.enconman.2003.09.029]

-
Soong, Y., Fauth, D.L., Howard, B.H., Jones, J.R., Harrison, D.K., Goodman, A.L., Gray, M.L., and Frommell, E.A., (2006), “CO2 sequestration with brine solution and fly ashes”, Energ. Convers. Manage, 47, p1676-1685.
[https://doi.org/10.1016/j.enconman.2005.10.021]

-
Teramura, S., Isu, N., and Inagaki, K., (2000), “New building material from waste concrete by carbonation”, J. Mater. Civil Eng, 12, p288-293.
[https://doi.org/10.1061/(ASCE)0899-1561(2000)12:4(288)]

-
Ukwattage, N.L., Ranjith, P.G., and Wang, S.H., (2013), “Investigation of the potential of coal combustion fly ash for mineral sequestration of CO2 by accelerated carbonation”, Energy, 52, p230-236.
[https://doi.org/10.1016/j.energy.2012.12.048]

-
Waters, J.F., and Millero, F.J., (2013), “The free proton concentration scal for seawater pH”, Mar. chem, 149, p8-22.
[https://doi.org/10.1016/j.marchem.2012.11.003]