가막만 양식장과 자연 서식지에서의 대형저서다모류 군집구조 차이
초록
본 연구는 가막만에 위치하는 양식장과 자연 서식지(비양식장해역)에서의 저서환경과 저서다모류군집의 차이를 비교하기 위하여 실시하였다. 자연 서식지에서의 조사 정점은 가막만 전 해역에 고르게 분포시켰으며, 양식장 해역은 가막만의 대표적인 양식장인 담치양식장, 굴양식장, 피조개양식장을 대상으로 선정하였다. 자연 서식지 해역과 양식장해역의 퇴적상은 대부분 니질 퇴적상을 보였으며, 평균 유기물함량은 자연 서식지에 비해 양식장해역에서 높게 나타났다. 그리고 양식장해역보다 자연 서식지 해역에서 저서다모류군집의 출현종수와 평균서식밀도가 상대적으로 높게 나타났다. 최우점종은 양식장과 자연 서식지 모두 잠재적 유기물오염지표종인 Lumbrineris longifolia로 나타났으나, 나머지 주요 우점종은 지역간에 약간의 차이를 보였다. 집괴분석 및 nMDS를 이용한 군집구조 분석 결과 지연 서식지 해역은 지역적으로 그룹이 나뉘었으나, 양식장해역의 경우 북서 내만역의 무생물정점을 제외하고 대부분의 정점이 한 그룹으로 묶였다. 또한 상관분석 및 PCA 분석 결과, 자연서식지의 경우 퇴적환경과 저서다모류군집간에 비교적 높은 상관관계를 보였으나, 양식장의 경우에는 낮은 상관관계를 보였다. 즉 가막만 양식장해역에 형성되어 있는 저서다모류군집은 다량의 유기물 유입과 같은 비정상적인 조건 하에 놓여 있음을 의미한다. 따라서 가막만은 생물상이 극히 빈약한 북서 내만역과 함께 양식장해역 역시 지속적인 모니터링을 통한 환경 개선 노력이 필요하다고 생각된다.
Abstract
This study was carried out to investigate the differences in sedimentary environments and benthic polychaete communities between farming grounds and natural habitats (non-farming ground) in Gamak Bay. Sampling stations of natural habitats were evenly distributed in the entire bay. And mussel farm, oyster farm and ark-shell farm were selected as farming grounds. Dominant sedimentary facies was mud in most sampling stations of farming grounds and natural habitats. However organic contents were higher in the farming grounds than natural habitats of the bay. The species number and mean density of polychaetous community in the natural habitats were greater than those from the farming grounds. Lumbrineris longifolia, known as potential organic enrichment indicator species, was first dominant species both in farming grounds and natural habitats of the bay. However, the next dominant species consisted of different species between two benthic habitats. As a result of community analysis using cluster analysis and nMDS, the natural habitats were divided into several station groups, but most of stations in farming grounds were clustered into one group. Pearson' correlation analysis and PCA showed high relationships between sedimentary environmental factors and benthic polychaetous community in natural habitats, but low or no relationships in farming grounds. That means benthic polychaetous community established in farming ground was under unusual condition such as high input of organic matter. Thus it is necessary to improve the benthic environmental quality of the farming grounds as well as the north-western inner part in Gamak Bay through long-term monitoring efforts.
Keywords:
Gamak Bay, Benthic Polychaetous Community, Farming Ground, Natural Habitat키워드:
가막만, 저서다모류군집, 양식장, 자연서식지1. 서 론
저서동물은 이동성이 적고 플랑크톤에 비해 상대적으로 긴 생활사를 가지고 있어서 장기간에 걸친 서식지의 환경의 변동이 군집 종조성 등에 잘 반영되고 있다. 즉 저서동물은 저서환경의 작은 변화에도 민감하게 반응하기 때문에 저서군집의 생태학적 지수를 이용하여 서식지의 환경에 대한 정량적인 정보를 제공하므로 환경평가에 효율적으로 이용할 수 있다(Warwick[1986]; Bilyard[1987]; Engle et al.[1994]; Baldo et al.[1999]; Frouin, [2000]).
특히 연안역을 포함한 해양에서의 대형저서동물 분포 및 군집 종조성은 다양한 환경요인에 의해 영향을 받지만 그 중 퇴적물의 입도조성이나, 퇴적상, 그리고 퇴적물 내 유기물 함량 등이 큰 영향을 미치는 것으로 보고되고 있다(Sanders[1958],[1960]; Rhoads and Young[1970]; Gray[1974]; Pearson and Rosenberg[1978]; Grebmeier et al.[1988]; Hong and Yoo[1996]; MacFarlane and Booth[2001]). 저서동물은 해역에 따라서는 퇴적물의 분급이 불량할수록 출현 종수나 밀도가 낮고 다소 조립한 퇴적환경에서는 종 다양성과 밀도가 높게 나타나기도 하였다(Lim and Choi[2001]). 최근 연안역의 과다한 유기물 공급 및 집적으로 인하여 해양환경의 변화 및 저서동물 군집상의 변동이 초래되고 있다. 유기오염의 초기단계에서는 저서군집의 종 풍부도, 생물량 등이 증가하는 양상을 볼 수 있으나 지나치게 많은 양의 유기물이 유입될 경우 종 다양성과 생물량은 급감하게 되며, 유기오염의 정도에 따라 그 우점종도 매우 달라진다(Pearson and Rosenberg[1978]).
연연역으로의 유기물 공급은 생활하수, 공업 폐수, 농축산 폐수 등 다양한 경로를 통하여 이루어지고 있다. 그런데 본 조사지역인 가막만을 포함한 한국 연안역은 어패류를 비롯한 다양한 수산생물의 양식장이 밀집되어 있다. 인간에게 양식활동은 고품질의 단백질 공급원 및 수산자원으로써 매우 중요한 부분임에는 분명하나, 이러한 활동에 의해 저서환경에 문제점들이 발생하고 있다. 수하식양식장의 양식생물과 부착생물로부터 유래되는 유기물은 저서 환경에 큰 영향을 미치며, 이에 따라 저서동물 군집에 변동을 일으킨다(Lim et al.[1992]). 또한, 계속된 유기물 유입으로 인한 유기물 과잉은 퇴적물의 환원 상태 및 저층수의 산소고갈을 초래해 저서환경에 악영향을 미친다(Hargrave[1994]; Tsutsumi[1995]). 실제로 양식장의 저서환경 변화로 인해 유기오염지시종이 우점하는 사례에 대한 연구는 많이 진행되었다(Pohle et al.[2001]; Yokoyama[2002]).
가막만은 남북으로 약 15 km, 동서로 약 9 km의 타원형 내만으로 수심은 대부분 10 m 이내의 천해이며 양식업이 활발하게 이루어지고 있다. 가막만은 현재 득량만, 완도-도암만, 함평만과 함께 환경보전해역으로 지정되어있으며, 국내 내만 환경 중 비교적 보호가 잘된 곳이었다. 그러나 여수시의 인구증가에 따른 생활하수의 유입량 증가와 함께 집약적인 양식 활동에 따른 유기물 증가 등으로 2007년부터 꾸준히 폐수 발생량과 방수량이 증가하고 있고, 유기물 방류량의 경우도 2008년부터 다소 증가하는 추세이다(KOEM[ 2013]). 가막만은 특히 북서 내만역에서 과도한 양식활동에 따른 유기물 공급, 분지형태의 지형적 특성에 의한 물질의 장기체류로 유기오염이 매우 심각하게 나타난다고 보고되었다(Noh et al.[2006]). 여기에 여수 연안에서 연안간척·매립사업에 따른 갯벌을 포함한 해안 훼손으로 연안해역의 자정능력이 상실되어 감에 따라 어장 환경과 가장 밀접한 패류의 생산성이 계속 감소하고 있다. 이에 따라 여수 연안해역 관리의 중요성이 대두되고 있는 실정이다. 가막만에서 저서다모류를 포함한 저서동물군집에 관한 연구는 수회 진행된 바 있다(Shin[1995]; Yoon et al.[2007], [2008]; Koo et al.[2004]; KORDI[2012]). 그러나 이러한 연구는 가막만 전체를 대상으로 조사하되 양식장 해역을 벗어난 자연서식지(비양식장) 해역을 대상을 조사가 이루어졌다.
본 연구에서는 가막만의 대표적인 굴수하식양식장, 홍합(담치)수하식양식장, 피조개 양식장을 대상으로 이 들 양식장 저층의 저서환경 및 저서다모류군집을 파악하고, 양식장이 설치되어 있지 않은 자연서식지 해역과의 차이점을 파악하고자 한다.
2. 재료 및 방법
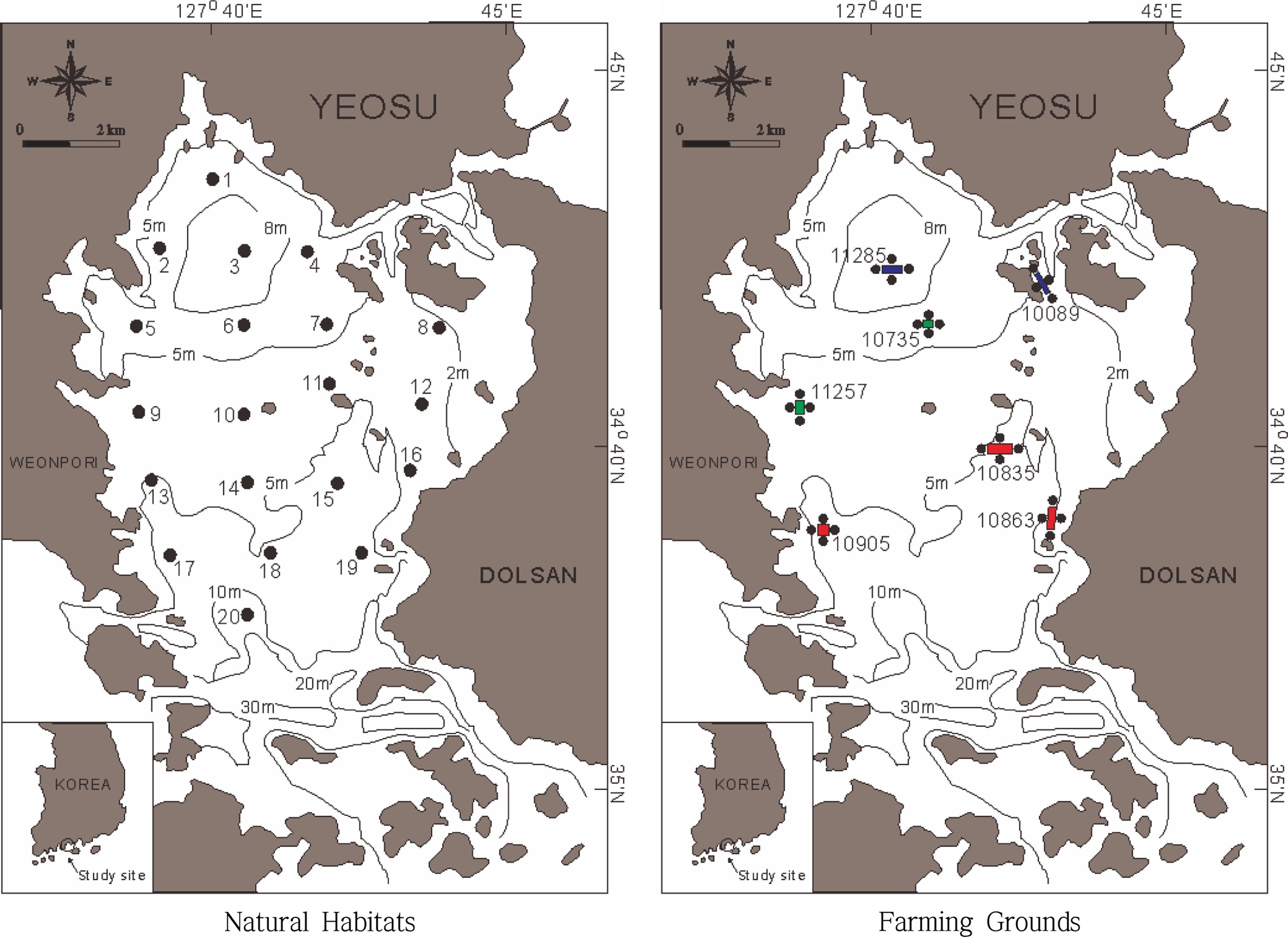
가막만내 양식장 해역과 자연서식지(비양식장) 해역간 대형저서다모류 군집구조의 차이를 비교하기 위하여 2015년 6월과 10월에 걸쳐 7개 양식장과 자연서식지 해역을 대상으로 현장조사를 실시하였다(Fig. 1). 자연서식지 해역으로는 전 가막만을 대상으로 양식장이 설치되어 있지 않은 해역에 총 20개의 조사 정점을 설정하였다. 양식장은 담치 수하식양식장 2곳(10089호, 11285호), 굴 수하식 양식장 3곳(10835호, 10863호, 10905호), 피조개 양식장 2곳(10735호, 11257호) 등 총 7개 양식장을 조사대상 양식장으로 선정하였다. 각 양식장에서는 중앙과 4개 가장자리에서 하나의 정점을 선정하여 5개 정점을 선정하였다. 양식장 해역에서는 총 35개의 조사정점을 설정하였다.
자연서식지 해역의 조사 정점은 입구면적 0.1 m2의 개량형 van Veen Grab을 사용하여 정점당 2회씩 채집하였고, 양식장 정점은 입구면적 0.05 m2의 소형 van Veen Grab을 사용하여 역시 정점당 2회씩 채집하였다. 저서환경요인을 분석하기 위하여 깊이 1 cm 정도의 표층 퇴적물을 사용하였고, 나머지 퇴적물은 저서다모류를 분석하기 위하여 망목크기 1 mm의 체를 사용하여 물체질하였다.
표층퇴적물 입도분석은 시료에 약 15%의 과산화수소(H2O2)와 약 10%의 염산을 이용하여 유기물과 탄산염을 제거하였다. 이 과정에서 잔류하는 과산화수소수와 염산을 제거하기 위해 증류수를 이용하여 반복적으로 세척한수 63 μm 체로 습식체질(wet sieving)하여 조립질 시료와 세립질 시료로 분리하였다.
조립질 시료는 110 oC에서 24시간동안 건조시킨 후 표준체를 이용한 건식체질(dry sieving)하여 입도별 무게를 구하였고, 세립질 시료는 X-선 자동 입도 분석기인 sedigraph 5100으로 분석하여 입도의 백분율을 산출하였다. 분석 후 얻어진 자료는 Folk and Ward[1957]의 공식을 사용하여 평균입도와 분급도 등을 계산하였다.
표층퇴적물의 유기물함량은 강열감량법(Loss on Ignition; %)을 이용하여 분석하였다. 110 oC에서 6시간 이상 건조시킨 퇴적물 시료는 고온전기로를 이용하여 550 oC에서 4시간 동안 강열하여 유기물을 희화시켰다. 희화된 시료는 회분 제거 건중량(ash free dry weight; g AFDW)을 측정한 후, 이 과정에서 얻어진 무게 손실량을 원래 무게인 건중량에 대한 백분율로 계산하여 퇴적물 내 유기물 함량(%)을 산출하였다.
각 정점에서 grab으로 채취된 퇴적물은 망목크기 1.0 mm인 체에 넣고 해수를 사용하여 퇴적물을 씻어내었다. 체에 걸린 생물은 10% 중성 포르말린으로 고정하여 실험실로 운반하였다. 채집된 저서동물은 실체현미경(Carl Zeiss Stermi 2000-C) 광학현미경(Nikon Eclipse 50i)을 이용하여 동물군별로 구분하고, 저서다모류는 가능한 종 수준까지 동정한 후 계수하였다.
저서다모류군집의 특성을 설명하는 생태지수인 종다양도지수(H')(Shannon and Weaver, 1963), 종풍부도지수(R) (Margalef, 1958), 종균등도지수(J) (Pielou, 1966), 우점도지수(D) (McNaughton, 1968)를 정점별로 계산하였다.
양식장 해역 및 자선 서식지의 두 해역간 환경의 차이 비교 검증하기 위하여 일원배치 분산분석(one-way ANOVA)을 실시하였다.
조사해역을 정점별로 구분하기 위해 PRIMER 6.0을 이용하여 종조성의 유사도를 기초로 집괴분석(Cluster analysis) 및 비계량 다차원척도법(non-metric multidimensional scaling; nMDS)을 병행하여 분석하였다. 저서다모류 전 출현종을 대상으로 분석을 실시하였으며, 자료의 편중을 피하기 위해 대수변환(log(x+1))을 하였다. 유사도지수는 Bray-Curtis similarity(Bray and Curtis, 1957)로 계산하였다. 정점 간 결합법은 Group average mode를 사용하여 정점군을 구분하였다.
그리고 환경(저서퇴적환경, 유기물함량, 수심)과 저서다모류군집 간의 상관관계를 알아보기 위해 피어슨의 상관계수(Pearson’s correlation coefficient)를 구하였으며, 저서다모류 군집과 밀접한 관련이 있는 저서환경요인을 파악하기 위하여 주성분분석(Principal Component Analysis; PCA)을 수행하였다.
3. 결과 및 토의
3.1 저서퇴적환경
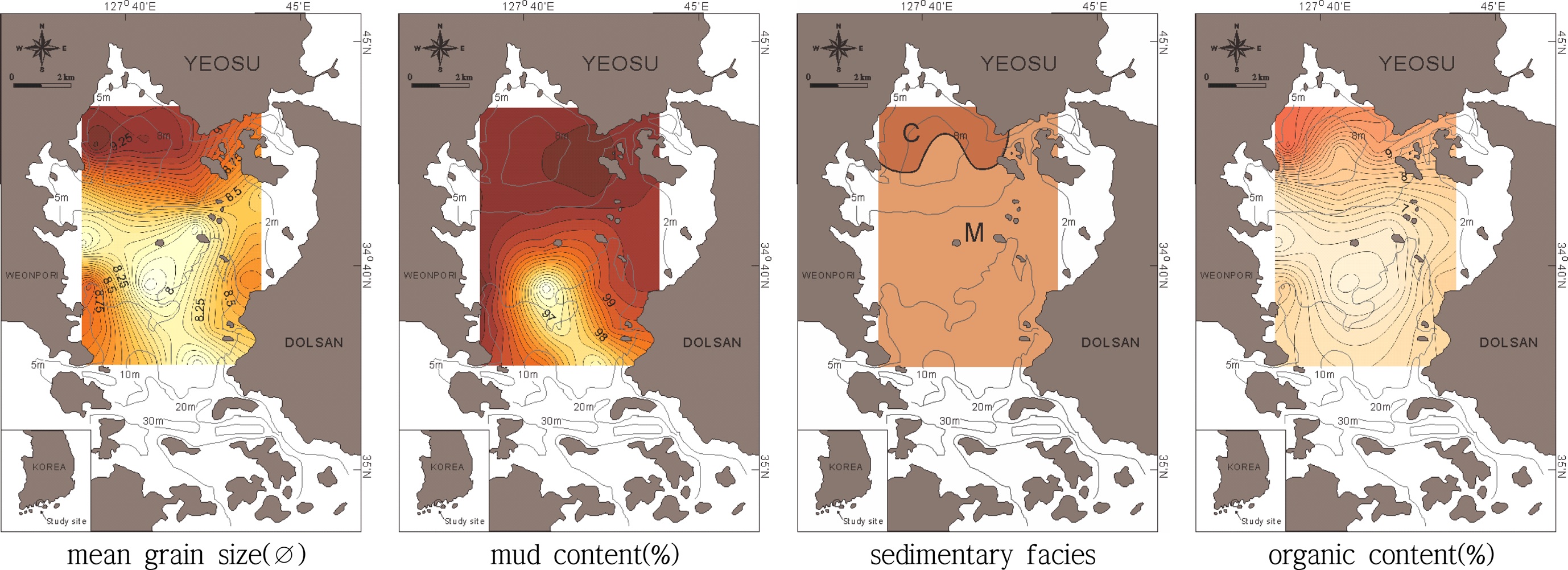
가막만 자연 서식지 해역의 평균입도분포, 니질함량 분포, 입도상 및 유기물함량 분포는 Fig. 2와 같다. 자연서식지해역의 표층퇴적물 입도조성을 전체적으로 살펴보면 sand 함량은 평균 0.93±1.08%, silt 함량은 45.43±0.41%. clay 함량은 53.64±9.94%로 나타났으며, 8.53±0.47Ø의 평균입도를 보이는 등 세립질 퇴적물이 절대적으로 우세한 환경이었다. 퇴적상의 분포를 살펴보면 북서 내만역의 일부 정점을 제외한 대부분의 정점에서 mud 퇴적상이 나타났다. 표층퇴적물의 유기물 함량은 평균 7.46±1.39%였으며, 최대값은 북서 내만역의 정점 2에서 11.05%, 최소값은 만 중앙부 구릉의 정점 9에서 5.89%로 나타났다. 즉 가막만의 표층퇴적물은 전체적으로 세립질 퇴적물로 이루어져 있으나, 상대적으로 가막만 북서 내만역이 다른 해역에 비해 점토질 함량이 매우 높았으며, 표층퇴적물의 유기물함량도 높았다. 그리고 만 중앙부 구릉역에서 상대적으로 실트질 함량이 높았으며, 유기물함량 역시 상대적으로 낮은 편이었다.
가막만의 양식장해역의 평균입도와 mud 함량, 입도상 및 유기물 함량은 Table 1과 같다. 양식장해역의 표층퇴적물의 입도조성을 살펴보면 sand 함량은 평균 0.96±0.95%, silt 함량은 37.57±9.17%, clay 함량은 61.46±9.5%로 나타났으며, 9.14±0.79Ø의 평균입도를 보였다. 퇴적상의 분포를 살펴보면 11257호와 10835호, 10863호의 양식장을 제외한 대부분의 정점에선 clay 퇴적상이 나타났고, 이를 제외한 양식장에선 대부분 mud 퇴적상을 나타내었다. 표층퇴적물의 유기물함량은 평균 8.54±0.78%였으며, 최대값은 정점 10089E에서 10.68%, 최소값은 정점 11257C에서 7.29%로 나타났다. 전반적으로 자연 서식지 해역의 정점들보다 점토질 함량이 높아 평균입도가 높은 값을 보이고 있으며(p<0.05), 표층퇴적물의 유기물함량 역시 자연서식지 해역보다 높은 값을 보였다(p<0.05).
기존의 가막만 조사 결과에서도 본 조사결과와 마찬가지로 북서 내만역이나 국동항 입구역 등지에서 표층퇴적물 내 유기물 함량이 다른 해역에 비해 매우 높게 나타났다(Yoon et al.[2007]; KORDI[2012]). 특히 북서 내만역은 과도한 양식활동에 따른 과잉의 유기물 공급, 육상으로부터 생활하수 및 산업폐수 유입, 분지형태의 지형적 특성에 의한 물질의 장기체류로 유기오염이 매우 심각하게 나타나는 것으로 보고되고 있다 (Noh et al.[2006]).
특히 하계 북서 내만역에서는 빈산소수괴가 형성되거나 황화물이 고농도로 발생하고 있었으며, 동계에는 저층수의 용존산소 농도는 회복되었지만 표층퇴적물 내에 많은 양의 유기물과 황화물이 존재하고 있음을 밝혔다.
3.2 저서다모류군집
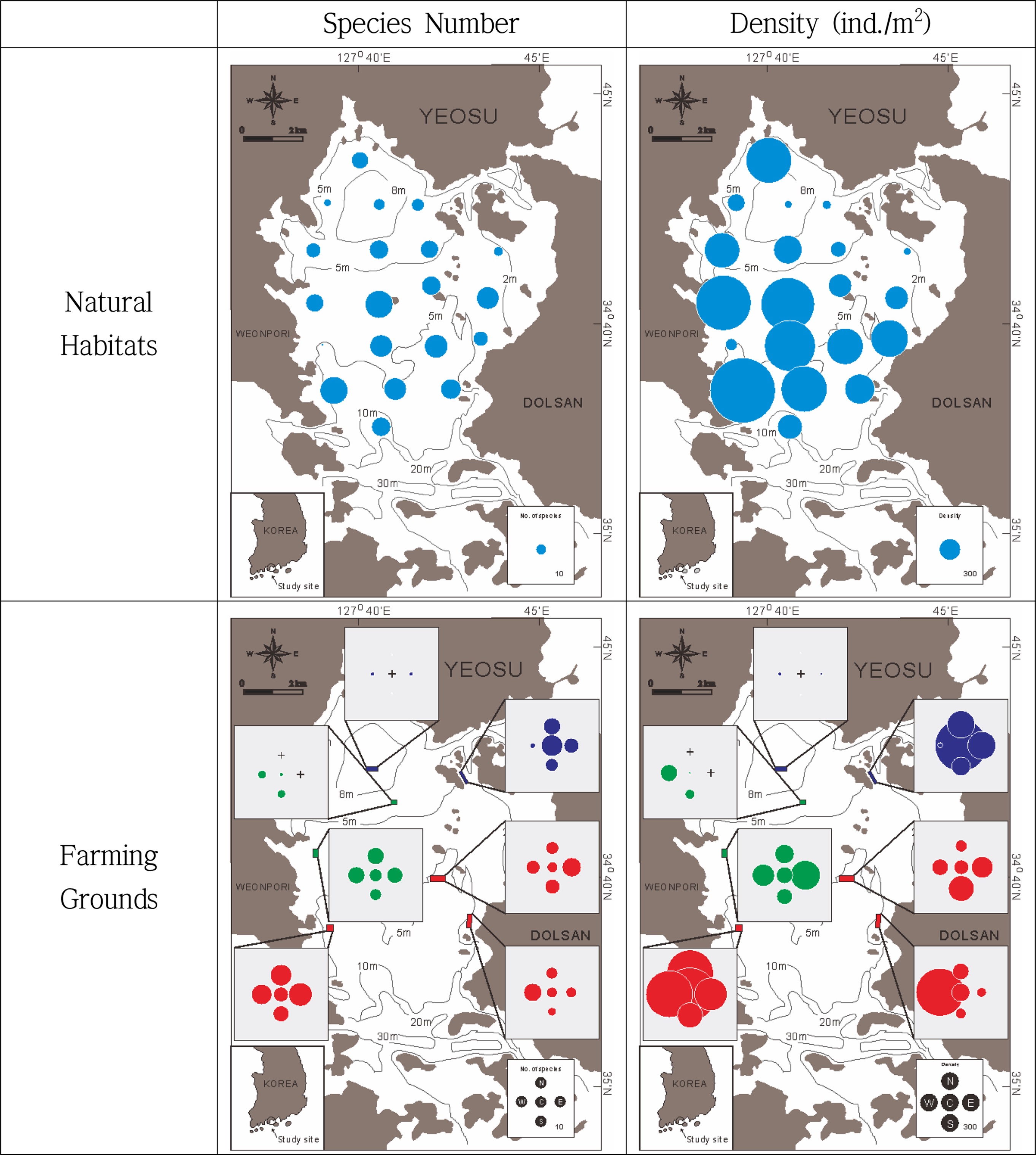
자연서식지 해역 및 양식장 해역의 조사정점에서 채집된 저서다모류의 제반 생태적 특성은 Table 2와 같으며, 출현종수와 서식밀도 분포는 Fig. 3과 같다. 자연서식지 해역의 총출현종수는 51종, 정점당 평균출현종수는 17 spp./0.2 m2, 평균서식밀도는 439 ind./m2로 나타났다. 반면 7개 양식장 해역에서의 총출현종수는 43종, 평균 출현종수는 11 spp./0.1 m2, 평균 서식밀도는 335 ind./m2로 나타났다. 즉 자연서식지 해역이 양식장 해역보다 출현종수와 평균서식밀도가 높았다(p<0.05).
본 조사에서 확인된 저서다모류군집의 출현종수는 기존의 가막만 연구 결과에 비해 낮은 값을 보이고 있다. 즉 조사정점의 수 및 조사 시기, 횟수의 차이는 있지만 Shin[1995]의 84종, Koo et al.[2004]의 78종, Yoon et al.[2007]의 119종, Yoon et al.[2008]의 95종에 비해 확연히 낮은 낮이었다. 특히 양식장 해역에서의 출현종수는 자연서식지 해역에 비해 낮은 값임을 확인할 수 있었다. 반면 서식밀도는 기존의 조사 결과에서도 변동 폭이 매우 심하여, 본 조사 결과로서의 정확한 상태를 판단할 수는 없었다.
자연서식지 해역에서 출현종수 및 서식밀도는 대체로 만 중앙의 구릉을 중심으로 북쪽에 위치한 정점들(북서 내만역 및 대경도 인근 해역)이 남쪽에 위치한 정점들보다 비교적 적게 나타났다. 반면 양식장 해역의 경우, 양식장 간, 그리고 동일 양식장 내에서의 정점 위치에 따라 출현종수 및 서식밀도의 편차가 매우 심하게 나타났다. 북서 내만역에 위치하는 담치양식장 11285호와 피조개양식장인 10735호에서는 생물이 출현하지 않거나 1종만이 출현하는 등 무생물 해역을 보였다. 이 2개 양식장을 제외한 나머지 양식장들에서는 상대적으로 출현종수 및 서식밀도가 높았다. 그러나 대경도 인근의 담치양식장 10089호와 굴양식장 10905호, 10863호의 경우 정점간 출현종수 및 서식밀도의 편차가 매우 심하였다. 종다양성지수를 비롯한 제반 생태지수는 양 해역간 차이가 심하지 않았다(p<0.05). Pearson and Rosenberg[1978]에 의하면 유기물함량이 적을 때 보다 오히려 좀 더 높았을 때 서식밀도가 증가하며, 유기물 오염이 진행되기 시작하면 일부 기회주의종에 의해 서식밀도가 급격히 증가하며, 지나치게 많은 양의 유기물이 유입될 경우 종 다양성과 생물량은 급감하게 된다고 하였다. Fig. 3과 같이 가막만 저서다모류 군집 분포는 단적으로 이러한 패턴을 잘 보여주고 있다. 즉 가막만 북서 내만역은 유기물 함량이 상당히 높게 유지되는 해역이기 때문에 (Fig. 2), 자연서식지 해역에서는 저서다모류의 출현종수 및 서식밀도가 낮은 값을 보이고 있으며, 특히 북서 내만역 양식장의 경우에는 유기물함량이 과다하게 높기 때문에 무생물 해역이거나 거의 저서다모류가 출현하지 않고 있다. 그리고 가막만 동쪽에 위치한 굴, 담치양식장의 경우 인근의 자연서식지 해역 정점들보다 출현종수 및 서식밀도가 높은 것도 저층 유기물 함량의 증가로 인한 것으로 보인다.
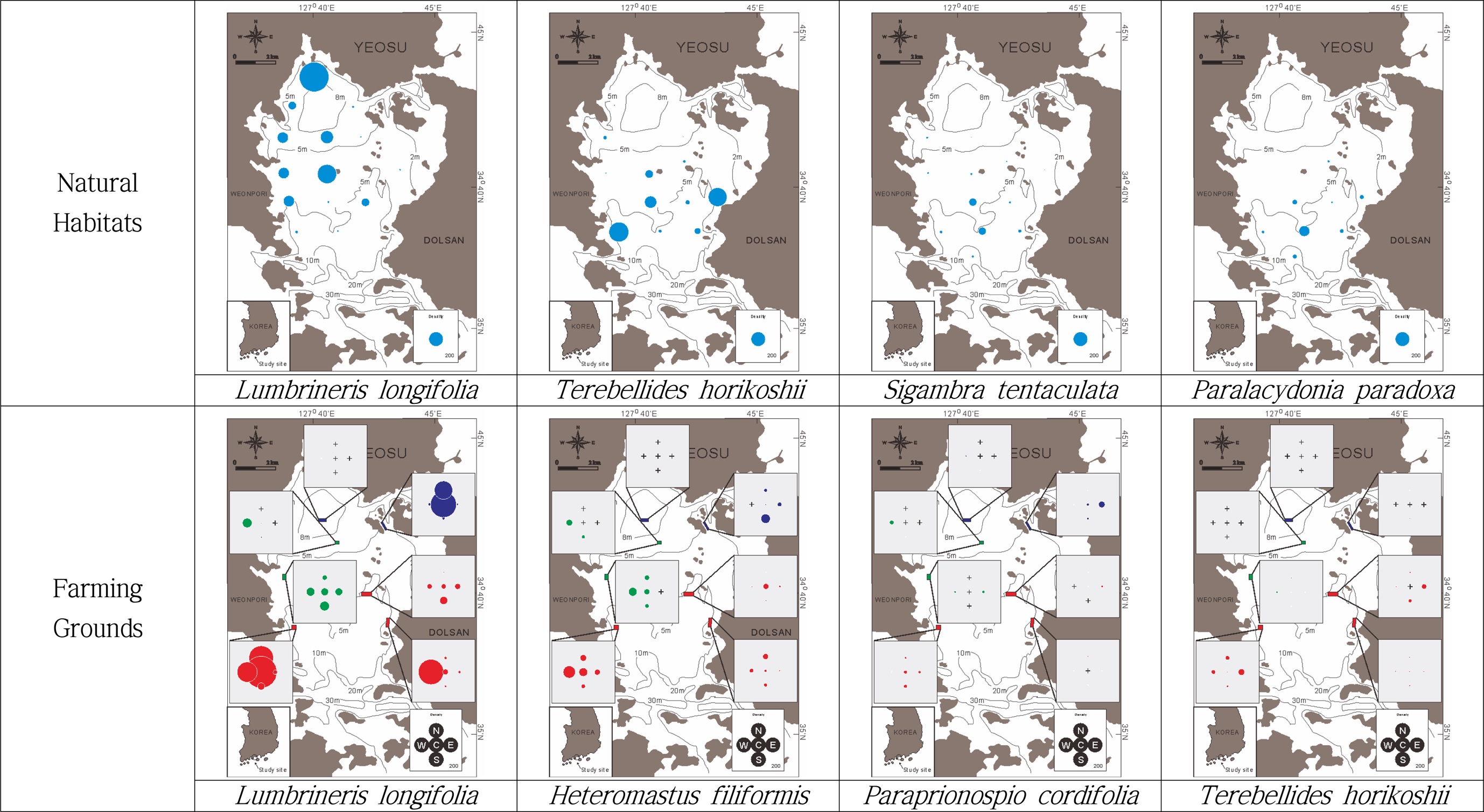
자연서식지(비양식장) 해역의 조사정점에서 채집된 저서다모류 중 개체수의 5% 이상 출현한 종은 총 6종으로 전체 다모류 중 57.1%를 차지하였다(Table 3). 제1우점 다모류는 Lumbrineris longifolia로 전체 다모류 중 20.21%를 점유하였고, 평균 서식밀도는 98 ind./m2이었다. 다음은 Terebellides horikoshii (13.70%, 14 ind./m2, Sigambra tentaculata (6.28% 6 ind./m2), Paralacydonia paradoxa (6.22%, 6 ind./m2), Nephtys oligobranchia (5.42%, 5 ind./m2), Praxillella affinis(5.31% 5 ind./m2)의 순으로 출현하였다. 반면 양식장 해역에서 채집된 저서다모류 중 개체수의 5% 이상 출현한 종은 총 4종으로 전체 다모류 중 52.2%를 차지하였다. 제1 우점 다모류는 Lumbrineris longifolia로 전체 다모류 중 27.34%를 점유하였고, 평균 서식밀도는 110 ind./m2 이었다. 다음은 Heteromastus filiformis (14.14%, 66 ind./m2), Parapriono cordifolia (5.37% 27 ind./m2), Terebellides horikoshii (5.37%, 28 ind./m2)의 순으로 출현하였다. 양식장과 자연서식지 해역에서의 제1 우점종은 L. longifolia로 동일하나, 제2 우점종부터는 다른 종들로 구성되어 있다. 특히 국내에서 유기물오염해역에서 다량 출현하는 기회주의종으로 잘 알려진 종인 H. filiformis와 P. cordifolia가 양식장 해역의 주요 우점종으로 출현하고 있는 점은 특기할 만한 현상이다.
자연서식지 해역과 양식장 해역에서의 각 우점종들의 서식밀도 분포는 Fig. 4와 같다. 자연서식지 해역의 경우 제1우점종인 L. longifolia는 가막만 북서 내만역을 중심으로 한 해역에서 집중적으로 출현하고 있다. 반면 T. horikoshii를 비롯한 그 외 우점종들은 가막만 중앙부 구릉 이남 해역에서 출현하는 등 제1우점종인 L. longifolia와는 분포 구역이 확연히 차이가 났다.
Density (ind./m2) distribution of dominant polychaetes in natural habitats and farming grounds in Gamak Bay.
양식장에서의 우점종 분포는 자연 서식지 해역에서의 우점종 분포와는 다른 양상을 보이고 있었다. 가막만 북서 내만역에 위치하는 양식장에서는 앞에서 언급한 바와 같이 저서동물의 출현량이 극히 적기 때문에 우점종들 역시 거의 출현하지 않았으며, 가막만 중앙부 구릉 및 이남 해역에 위치한 양식장에서 집중적으로 출현하였다. 양식장 및 자연 서식지 해역에서의 공통적으로 제1우점종인 L. longifolia는 북서 내만역의 경우 자연서식지 해역에서는 대량 출현하였지만 양식장 해역에서는 출현하지 않은 반면, 중부 이남해역의 경우 자연서식지 해역에서는 거의 출현하지 않았으나, 양식장에서는 주요 우점종으로 출현하였다. 두 번째 우점종인 H. filiformis는 북서 내만역 양식장을 제외하고는 대부분의 양식장에서 주요 우점종으로 출현하고 있었다. P. cordifolia와 T. horikoshii 역시 대부분의 양식장에서 소량이지만 출현하고 있었다.
자연서식지 해역과 양식장해역에서 제1 우점 다모류는 Lumbrineris longifolia로 동일하게 나타났다. L. longifolia는 유기물 오염에 저항력이 강하다고 알려져 있으며(Pearson and Rosenberg[1978]), 수괴의 흐름이 약하고, 니질 퇴적상을 나타내는 반폐쇄성 만 등에서 우점한다. 본 연구에서 북서 내만역의 자연서식지(비양식장) 해역에서 L. longifolia의 서식밀도가 만 중앙 구릉부 남쪽 해역에 비해 높게 나타났다. 즉 가막만의 북서 내만역은 정체성의 해수 특성을 가지며(Lee and Cho[1990]), clay 함량이 매우 높은 세립질 퇴적상이며, 퇴적물 내 유기물 함량이 상당히 높게 나타나는 등 L. longifolia가 우점 서식하기 좋은 조건을 갖추고 있음을 알 수 있다. 가막만에서 L. longifolia가 주요 우점종임은 여러 연구에서도 확인된 바 있다(Shin[1995]; Yoom et al.[2007], [2008]; KORDI[2012]). 제1우점종을 제외하면 양식장과 자연서식지의 우점종들은 차이를 보였다. 자연서식지해역의 경우 T. horikoshii, S. tentaculata, P. paradoxa, N. oigobranchia, P. affinis의 순서로 우점하였고, 양식장의 경우 H. filiformis, P. cordifolia, T. horikoshii의 순으로 우점하였다. 이러한 주요 우점종은 Seo et al.[2012]의 조사 결과와 유사하였다. 특히 양식장 해역에서 우점 출현하는 H. filiformis, P. cordifolia는 국내에서 기회주의종으로 잘 알려져 있으며, 유기물 오염이 심화된 곳에서 대량 서식하는 잠재적 유기물오염지시종으로 알려져 있는 종들이다. 참고로 가막만 북서 내만역의 경우 범세계적으로 유기물오염지시종으로 잘 알려진 Capitella capitata의 계절 변동이 극심한 해역으로 특히 동계-춘계에 C. capitata가 극우점 출현하는 것으로 보고되고 있으나(Yoon et al.[2008]; KORDI[2012]), 본 조사는 초여름과 추계에 실시되었기에 C. capitata가 대량 출현하는 시기와 조사시기가 달라 채집되지 않은 것으로 보인다.
자연서식지(비양식장) 해역 20개 조사정점과 7개 양식장 35개 조사정점을 대상으로 실시한 집괴분석 및 nMDS 분석 결과를 보면(Fig. 5), 양식장 해역과 자연서식지 해역의 조사 정점들이 뚜렷하게 구분되는 것을 확인할 수 있다. 양식장과 자연서식지를 포함한 전체 조사정점은 크게 5개의 정점군으로 구분되었으며, 대체적으로 양식장해역의 정점들과 자연서식지 해역의 정점들은 서로 다른 정점군을 이루었다. 정점군 A, 정점군 C는 자연서식지 해역의 정점으로만 이루어져 있고, 정점군 E(E1, E2, E3)는 양식장 정점들로만 구성되어 있다. 정점군 B는 양식장 정점과 자연서식지 정점들이 혼재되어 있다. 정점군 D의 경우 2개의 자연서식지 해역 정점을 제외하고는 주로 양식장 정점들로 이루어져 있다. 즉 정점군 A, 정점군 B, 정점군 C는 주로 자연서식지 해역의 정점군들에 의해 결정되었으며, 정점군 D와 정점군 E는 양식장 해역의 정점들로 주로 구성되어 있다. 정점군 A는 지역상으로는 가막만 중앙 구릉부 이남 해역의 정점들로 이루어져 있으며, 정점군 B는 중앙 구릉부 이북의 가막만 북서 내만역에 위치하는 정점들이 중심이었다. 반면 가막만 북동쪽 해역(대경도 인근 해역)의 정점들은 정점군 C와 정점군 D에 포함되어 있다. 참고로 자연서식지 해역만을 대상으로 군집분석을 실시한 결과 정점군 C와 정점군 D는 하나의 정점군으로 통합되었다(Jang[2016]).
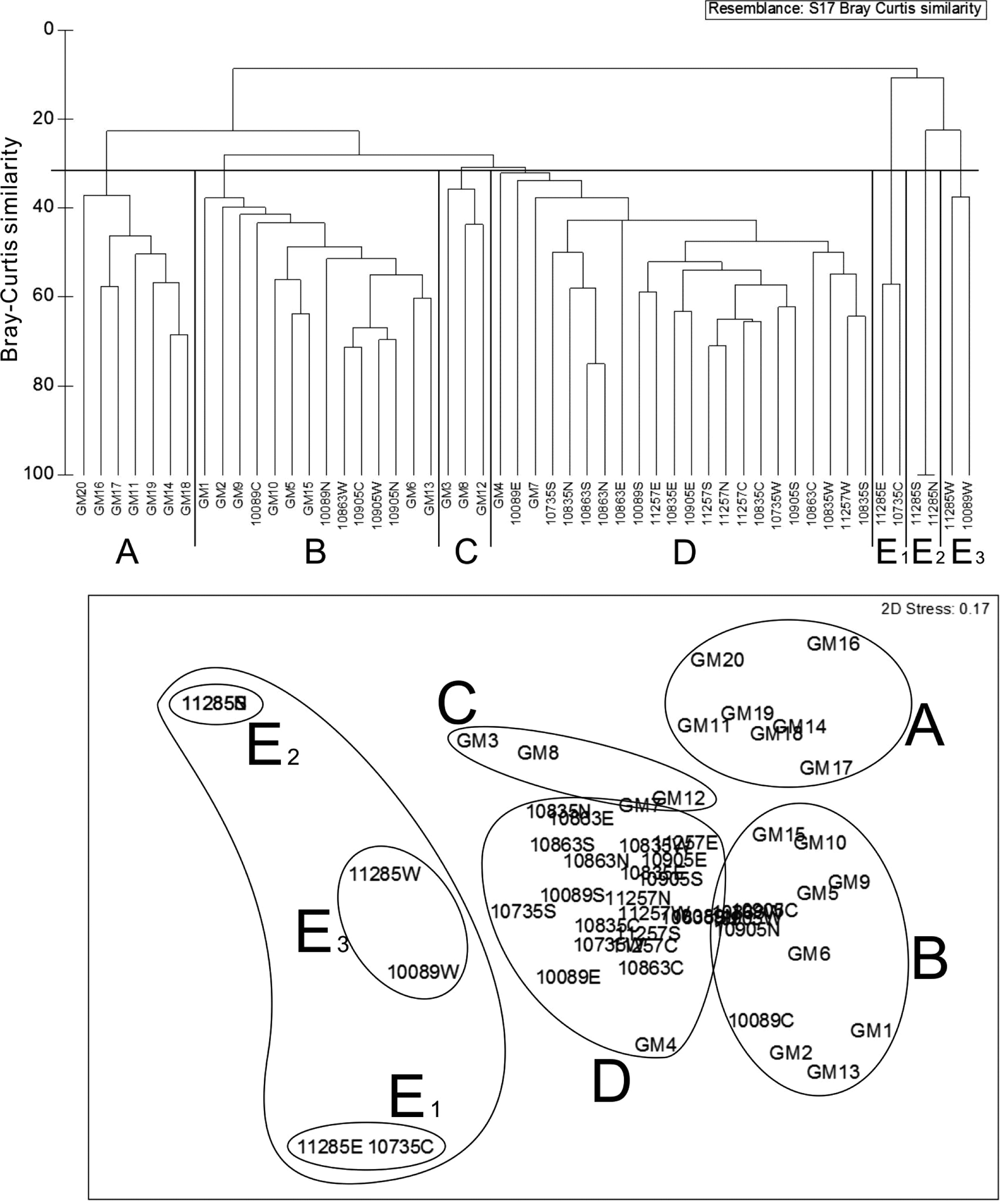
Dendrogram of cluster analysis and non-multidimensional scaling ordination (nMDS) plot of the sampling sites based on the species composition of benthic polychaetous communities in Gamak Bay.
각 정점군의 저서환경 및 저서다모류군집의 특징을 요역 정리하면 Table 4와 같다. 여기서 정점군 E(E1, E2, E3)는 2개의 조사지점 씩으로만 이루어진 경우이기 때문에 이를 제외하고 정점군 특성을 정리하였다. 정점군 A는 상대적으로 가장 수심이 깊고, 유기물함량이 낮으며, 주요 우점종들의 구성이 다른 정점군들과는 큰 차이를 보이고 있으며, 정점당 출현종수가 가장 많아 저서다모류군집의 다양성이 상대적으로 높았다. 정점군 B는 유기물 함량이 가장 높은 정점군이었으며, L. longifolia의 기여도가 매우 높았다. 이 정점군은 다모류 평균 서식밀도가 매우 높고, 다양도지수가 비교적 낮게 나타나는 등 특정 종의 우점이 매우 심한 정점군이었다. 주로 양식장 해역의 정점들로 집중 구성된 정점군 D의 경우, clay 함량이 상대적으로 높아 평균입도가 가장 높은 값을 보이고 있으며, 유기물함량 역시 매우 높았다. 주요 우점종은 L. longifolia와 H. filiformis 이었다. 특징적으로 정점군 B, 정점군 D와 같이 양식장과 자연서식지 해역 모두 유기물의 함량이 높게 나타난 정점군에서는 L. longifolia가 크게 우점하였으며, 반면 유기물함량이 상대적으로 높지 않은 정점군 A, 정점군 C에서는 L. longifolia가 아닌 다른 종들이 주요 우점종으로 출현하였다.

Characteristics of benthic environment and polychaetous community of each affinity group divided by cluster analysis and nMDS in Gamak Bay.
가막만 저서다모류 군집은 지리적으로 만 입구역, 만 중앙역, 북서 내만역 등에 종조성이 차이가 나는 군집이 형성되어 있는 것으로 밝혀져 왔다(Shin[1995]; Yoon et al.[2007], [2008]; KORDI[2012]). 이는 본 연구의 자연서식지 해역에서의 군집분석 결과와 일치하고 있다. 이러한 군집 분포는 북서 내만역을 중심으로 한 용존산소 농도의 변동, 유기물함량의 상대적 농도 분포와 같은 저서환경 교란이 반영된 결과라고 언급되고 있다 (Shin[1995]; Yoon et al.[2007], [2008]; KORDI[2012]).
3.3 저서환경과 저서다모류군집간 관계
가막만 내 자연서식지(비양식장) 해역 조사정점의 저서환경요인(수심, 평균입도, mud 함량, sand 함량, 유기물함량)과 저서다모류군집(출현종수, 우점종, 서식밀도, 다양도지수, 풍부도지수, 균등도지수, 우점도지수, 건강도지수)간 Pearson 상관관계를 살펴보면 Table 5와 같다. 평균입도와 유기물함량은 높은 양의 상관관계를 보였으며, 출현종수는 평균입도와 유기물함량에 높은 음의 상관관계를 보였다. 유기물함량과 우점종들 간의 상관관계를 살펴보면 L. longifolia를 제외한 나머지 우점종들은 유기물함량과 음의 상관관계를 보였고, S. tentaculata의 경우 비교적 높은 음의 상관관계를 보였다. 출현종수와 서식밀도는 T. horikoshii와 높은 양의 상관관계를 보였으며, H. filiformis와 S. tentaculata는 다양도지수와 높은 양의 상관관계를 보였다. L. longifolia는 균등도지수와 높은 음의 상관관계를, 우점도지수와는 높은 양의 상관관계를 보였다.

Pearson’s correlation coefficients between benthic environmental factors and ecological characteristics of polychaetous community in Gamak Bay.
가막만 내 양식장 해역 조사정점의 저서환경요인과 저서다모류군집간 Pearson 상관관계를 살펴보면, 퇴적상과 유기물함량 사이의 상관관계는 비교적 낮게 나타났고, 출현종수와 서식밀도 또한 유기물 함량과 비교적 낮은 상관관계를 보였다. 유기물함량과 우점종들 간의 상관관계를 살펴보면 L. longifolia는 비교적 높은 양의 상관관계를 보였지만 나머지 우점종들은 낮은 상관관계를 보였다. 출현종수와 서식밀도는 모든 우점종들에서 높은 양의 상관관계를 보였으며 이중 L. longifolia는 서식밀도와 가장 높은 양의 상관관계를 보였다. 이에 L. longifolia는 우점도지수와도 높은 양의 상관관계를 보였다. T. horikoshii와 H. filiformis는 다양도지수와 높은 양의 상관관계를 보였다.
두 해역간 Pearson 상관계수의 차이를 살펴보면, 자연서식지 해역의 경우 유기물함량과 평균입도간 0.876의 매우 높은 상관계수를 보였으며, 사질함량과는 음의 관계(니질함량과는 양의 관계)를 보이는 등 일반적인 저서환경의 특징을 잘 보여주고 있다. 반면 양식장해역은 유기물함량과 평균 입도간 상관계수가 -0.283으로 나왔으며, 사질함량과 양의 관계(니질함량과 음의 관계)를 보이는 등 퇴적상과는 전혀 관련성이 없는 것으로 나타났다. 즉 양식장 해역의 퇴적물내 유기물은 양식생물의 배설물 등에 기원한 유기물의 비정상적인 공급으로 인하여 퇴적상과는 무관함을 단적으로 잘 보여주고 있다. 뿐만 아니라 출현종수와 서식밀도는 자연서식지 해역에서는 니질함량, 평균입도, 유기물함량과 정확하게 음의 관계를 보이고 있으나, 양식장 해역에서는 이러한 관계가 성립되지 않고 있다. 그리고 자연서식지 해역에서는 제1우점종인 L. longifolia를 제외한 나머지 우점종들은 유기물함량과 역관계를 보이고 있으나, 양식장 해역에서는 모든 우점종들과 낮은 값이기는 하지만 양의 관계를 보였다. 즉 양식장 해역에서 유기물함량과 같은 저서환경 요인은 자연 서식지 해역에서의 상황 및 저서동물군집의 형성 및 유지 반응 기작과는 전혀 다르게 작용하고 있음을 확인할 수 있다.
자연서식지 해역의 저서 퇴적환경요인과 저서다모류군집 간의 관계를 파악하기 위하여 주성분분석을 실시한 결과, 각 항목별 인자부하량(factor loading)의 분포는 Fig. 6과 같다. 제1주성분과 제2주성분의 누적기여율은 60.38% 이었으며, 제1주성분에서 6.596으로 높은 고유값(eigenvalue)을 보였다. 제1주성분은 전체 분산에 대해 41.22%의 기여율을 보였으며, mud 함량과 평균입도, 유기물함량과 높은 역 상관관계를 보였고, 출현종수와 서식밀도, S. tentaculata, P. paradoxa와 높은 정 상관관계를 보였다. 제2주성분은 전체 분산에 대해 19.15%의 기여율을 보였으며 제1주성분과 유사한 양상을 보였다.
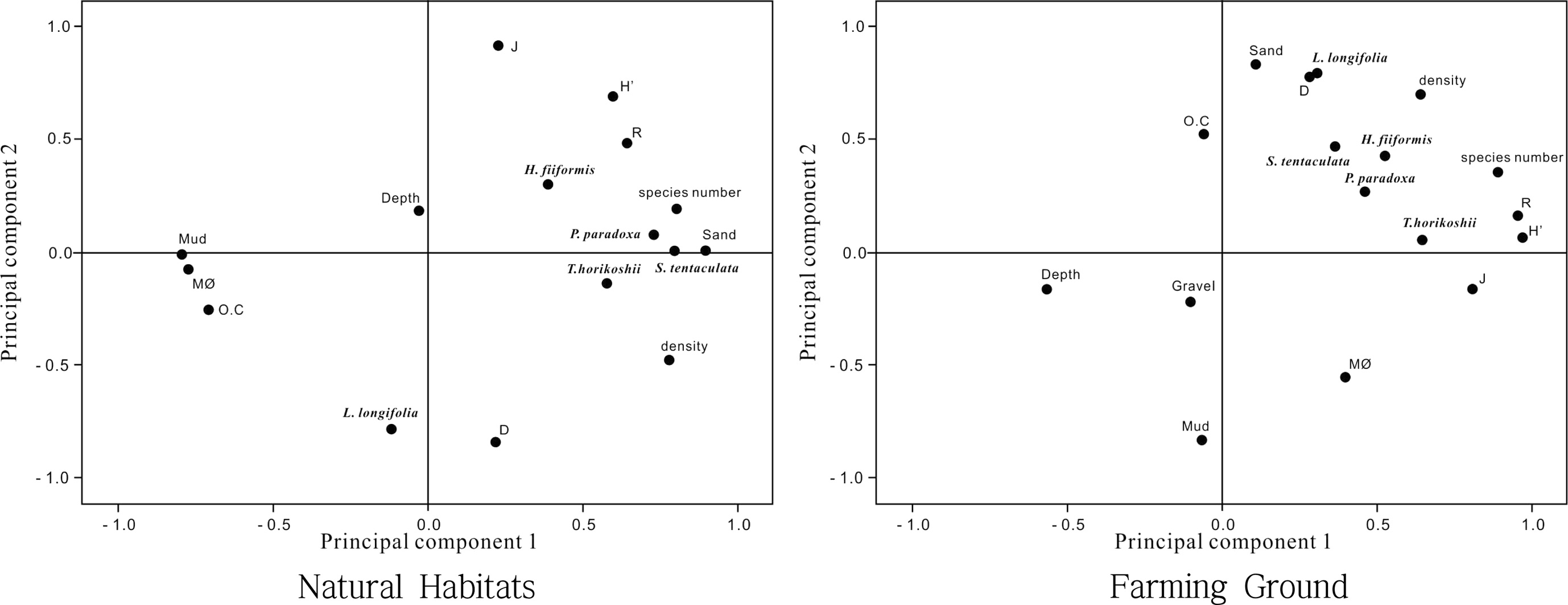
Distribution of factor loading by PCA in Gamak Bay. (MØ : mean grain size, O.C : organic content, H' : Diversity, R : Richness, J : Eveness, D : Dominance).
양식장 해역의 정점을 대상으로 주성분분석을 실시한 결과, 제1주성분과 제2주성분의 누적기여율은 66.09% 이었으며, 제1주성분에서 6.872으로 높은 고유값(eigenvalue)을 보였다. 제1주성분은 전체 분산에 대해 40.42%의 기여율을 보였으며, mud 함량과 유기물과 역 상관관계를 보였으나 평균입도와 출현종수, 서식밀도, 생태지수, 우점종들과는 정 상관관계를 보였다. 반면, 제2주성분은 전체 분산에 대해 17.54%의 기여율을 보였으며, mud 함량과 평균입도와는 높은 역 상관관계를 보였고, 유기물함량과 출현종수, 서식밀도, 다양도지수, 풍부도지수, 우점도지수, L. longifolia, T. horikoshii, H. filiformis, S. tentacualta, P. paradoxa와는 정 상관관계를 보였다.
Yoon et al.[2008]의 연구에서도 가막만(본 연구의 자연서식지 해역) 저서다모류군집 구조에 큰 영향을 미치는 주요 환경요인으로 총 유기탄소와 산휘발성화합물, 그리고 수심 등을 들었는데, 이는 본 연구의 결과와도 잘 일치하고 있다. 그러나 양식장해역에서는 저서환경 요인과 다모류군집구조 간에 상호 관련성이 매우 약하거나 없는 것으로 본 조사에서 나타나고 있는데, 이는 양식장에서의 과다한 유기물 유입이 다모류군집의 종조성 및 군집구조에 큰 영향을 미쳐 자연 서식지 해역에서와 같은 일반적인 패턴이 형성되지 않고 있음을 의미한다.
Acknowledgments
본 논문의 완성을 위해 심도 있는 심사를 해주신 두 분 심사위원께 감사를 드립니다. 이 논문은 2016년 해양수산부 재원으로 한국해양과학기술진흥원의 지원을 받아 수행된 연구입니다(내만 빈산소수괴 해소기술개발).
References
- Baldó, F., García-Martín, S.F., Drake, P., and Arias, A.M., (1999), “Discrimination between disturbed coastal ecosystems by using macrobenthos at different taxonomic levels”, Bol. Inst. Esp. Oceanogr, Vol. 15(No. 1-4), p489-493.
-
Bilyard, G.R., (1987), “The value of benthic infauna in marine pollution monitoring studies”, Mar. Poll. Bull, Vol. 18, p581-585.
[https://doi.org/10.1016/0025-326X(87)90277-3]

-
Bray, J.R., and Curtis, J.T., (1957), “An ordination of upland forest community of southern Wisconsin”, Ecol. Monogr, Vol. 27, p325-349.
[https://doi.org/10.2307/1942268]

-
Engle, V.D., Summers, J.K., and Gaston, G.R., (1994), “A benthic index of environmental condition of Gulf of Mexico estuaries”, Estuaries, Vol. 17(No. 2), p372-384.
[https://doi.org/10.2307/1352670]

-
Folk, R.L., and Ward, W.C., (1957), “Brazos river bar: a study in the significance of grain size parameters”, J. Sed. Petol, Vol. 27, p3-26.
[https://doi.org/10.1306/74D70646-2B21-11D7-8648000102C1865D]

-
Frouin, P., (2000), “Effects of anthropogenic disturbances of tropical soft-bottom benthic communities”, Mar. Ecol. Prog. Ser, Vol. 194, p39-53.
[https://doi.org/10.3354/meps194039]

- Gray, J.S., (1974), “Animal-sediment relationships”, Oceanogr. Mar. Biol. Ann. Rev, Vol. 12, p223-261.
-
Grebmeier, J.M., Feder, H.M., and Mcroy, C.P., (1988), “Pelagicbenthic coupling on the shelf of the northern Bering and Chukchi Seas. I. Food supply source and benthic biomass”, Mar. Ecol. Prog. Ser, Vol. 48, p58-67.
[https://doi.org/10.3354/meps048057]

- Hargrave, B.T., (1994), Modelling benthic impacts of organic enrichment from marine aquaculture, Canada Technical Report on Fisheries and Aquatic Science, Report No. 1949, Bedford Institute of Oceanography, Dartmouth, Nova Scotia.
- Hong, J.S., and Yoo, J.W., (1996), “Salinity and sediment types as sources of variability in the distribution of the benthic macrofauna in Han River estuary and Kyonggi Bay”, J. Korean Soc. Oceanogr, Vol. 31, p217-231.
- Jang, S.Y., (2016), Comparison of benthic healthiness between farming ground and non-farming ground in Gamak Bay, MS Thesis, Chonnam National University, p73.
- KOEM, (2013), Environment Conservation Sea Area (Benthic environments) Gamak Bay, Deugryang Bay, Wando-Doam Bay, Hampyung Bay.
-
Koo, B. J., Je, J.G., and Shin, S.H., (2004), “Benthic pollution assessment based on macrobethic community structure in Gamak Bay, southern coast of Korea”, Ocean and Polar Res, Vol. 26(No. 1), p11-22.
[https://doi.org/10.4217/OPR.2004.26.1.011]

- KORDI, (2012), Ecological responses in the hypoxic condition in southern coast of Korea for ecosystem management, BSPE98661-10046-3.
- Lee, K.H., and Cho, K.D., (1990), “Distribution of the temperature and salinity in Kamak Bay”, Bull. Korean Fish. Soc, Vol. 23(No. 1), p25-39.
- Lim, H.S., and Choi, J.W., (2001), “Community structure of subtidal macrobenthos in Hampyung Bay during autumn in 1997, south west cost of Korea”, J. Korean Fish. Soc, Vol. 34, p326-339.
- Lim, H.S., Choi, J.W., Je, J.G., and Lee, J.H., (1992), “Distribution pattern od macrozoobenthos at the farming ground in the western part of Chinhae Bay, Korea”, Bull. Korean Fish. Soc, Vol. 25(No. 2), p115-132.
-
MacFarlane, G.R., and Booth, D.J., (2001), “Estuarine macrobenthic community structure in the Hawkesbury River, Australia: relationships with sediment physicochemical and anthropogenic parameters”, Env. Monit. Ass, Vol. 72, p51-78.
[https://doi.org/10.1023/A:1011959721146]

-
McNaughton, S.J., (1968), “Structure and function in California grassland”, Ecology, Vol. 49, p962-972.
[https://doi.org/10.2307/1936547]

- Mrgalef, R., (1958), “Information theory in ecology”, Gen. Syst, Vol. 3, p157-175.
- Noh, I.H., Yoon, Y.H., Kim, D.I., and Park, J.S., (2006), “The spatiotemporal distribution of organic matter on the surface sediment and its origin in Gamak Bay, Korea”, J. Korean Soc. Mar. Env. Eng, Vol. 9(No. 1), p1-13.
- Pearson, T.H., and R. Rosenberg, (1978), “Macrobenthic succession in relation to organic enrichment and pollution of the marine environment”, Oceanogr. Mar. Biol. Ann. Rev, Vol. 16, p229-311.
-
Pelou, E.C., (1966), “The measurement of diversity in different types of biological collection”, Theoret. Biol, Vol. 13, p131-144.
[https://doi.org/10.1016/0022-5193(66)90013-0]

-
Pohle, G., Frost, B., Findlay, R., (2001), “Assessment of regional benthic impact of salmon mariculture within the Letang Inlet, Bay of Fundy”, ICES J. Mar. Sci, Vol. 58, p417-426.
[https://doi.org/10.1006/jmsc.2000.1039]

- Rhoads, D.C., and Young, D.K., (1970), “The influence of depositfeeding organism on the sediment stability and community trophic structure”, J. Mar. Res, Vol. 25, p150-178.
-
Sanders, H.L., (1958), “Benthic studies in Buzzards Bay. I. Animal- sediment relationships”, Limnol. Oceanogr, Vol. 3(No. 3), p245-258.
[https://doi.org/10.4319/lo.1958.3.3.0245]

-
Sanders, H.L., (1960), “Benthic studies in Buzzards Bay. III. The structure of the soft-bottom community”, Limnol. Oceanogr, Vol. 5, p138-153.
[https://doi.org/10.4319/lo.1960.5.2.0138]

-
Seo, J.Y., Park, S.H., Lee, J.H., and Choi, J.W., (2012), “Structural change in macrozoobenthic communities due to summer hypoxia in Gamak Bay, Korea”, Ocean Sci. J, Vol. 47(No. 1), p27-40.
[https://doi.org/10.1007/s12601-012-0003-9]

- Shannon, C.E., and Weaver, W., (1963), The mathematical theory of communication, University of Illinois Press, Urbana, p125.
- Shin, H.C., (1995), “Benthic polychaetous community in Kamak Bay, southern coast of Korea”, J. Korean Soc. Oceanogr, Vol. 30(No. 4), p250-261.
-
Tsutsumi, H., (1995), “Impact of fish net pen culture on the benthic environment of a cove in south Japan”, Estuaries, Vol. 18, p108-115.
[https://doi.org/10.2307/1352286]

-
Warwick, R.M., (1986), “A new method for detecting pollution effects on marine macrobenthic communities”, Mar. Biol, Vol. 92, p557-562.
[https://doi.org/10.1007/BF00392515]

-
Yokoyama, H., (2002), “Impact of fish and pearl farming on the benthic environments in Gokasho Bay: evaluation from seasonal fluctuations of the macrobenthos”, Fish. Sci, Vol. 68, p258-268.
[https://doi.org/10.1046/j.1444-2906.2002.00420.x]

- Yoon, S.P., Kim, Y.J., Jung, R.H., Moon, C.H., Hong, S.J., Lee, W.C., and Park, J.S., (2008), “Benthic environments and macrobenthic polychaete community structure in the winter of 2005- 2006 in Gamak Bay, Korea”, 「The Sea」J. Korean Soc. Oceanogr, Vol. 13(No. 1), p67-82.
- Yoon, S.P., Jung, R.H., Kim, Y.J., Kim, S.S., Lee, J.S., Park, J.S., Lee, W.C., and Choi, W.J., (2007), “Characteristics of benthic environment and polychaete communities of Gamak Bay, Korea”, 「The Sea」J. Korean Soc. Oceanogr, Vol. 12(No. 4), p287-304.