김 활성처리제가 김엽체 색소에 미치는 영향
초록
김의 성장시기에 따라 김 활성처리제를 처리한 직 후 김엽체의 색소함량에 대해 연구하였다. 김활성처리제의 처리농도는 무기산 3개, 유기산 3개 농도를 혼합하여 총 6개의 실험구로 선정하였다. 김 엽체에서의 6종류 색소가 검출됐고, 그 중 phycoerythrin, phycocyanin, chlorophyll a가 주요 색소였다. 김활성처리제 사용시 색소 함량은 성장시기에 따라 농도의 변화를 보였고, 12월에는 모든 처리구에서 90%이상 색소함량이 감소하였으나, 2월에는 무기산 농도가 높을수록 색소의 함량이 감소되는 경향을 나타내었다. 이러한 결과는 김활성처리제의 낮은 pH로 인한 분자구조 변성에 의한 것으로 판단되었다. 아울러 2월에는 김엽체의 색소함량이 감소됨과 동시에 해수의 fucoxanthin의 농도가 동시에 증가하는 결과도 보여, 김엽체에 부착한 규조류의 제거에 영향을 주었을 것으로 판단되었다. 특히 2월 무기산 활성처리제 사용 후 해수중 Melosira sp.나 Stephanopyxis sp.의 생물량이 처리 농도에 따라 증가하는 것으로 보아, 김 엽체에 부착한 규조류의 특징에 따라 활성 처리제의 효율에 영향을 줄 수 있음을 알 수 있었다. 결과적으로, 김활성처리제는 김엽체에 부착한 생물종에 따라 효율의 차이를 볼 수 있으며, 본 연구에서의 높은 활성처리제 효율은 김 엽체에 부착한 규조류의 생태적 특징에 기인된 것으로 판단되며, 아울러 무기산 농도가 높을수록 김엽체의 주요색소가 더 많이 감소 될 수 있음을 알 수 있었다.
Abstract
The pigments content of Porphyra were investigated after acid treatment according to growth stage of Porphyra. Six experimental group were selected for the acid treatments. It was detected that 6 types of pigments and phycoerythrin, phycocyanin, chlorophyll-a were major pigments in Porphyra. The concentration of pigment was decreased by more than 90% in all experimental group and the content of pigment was decreased with increasing concentration of inorganic acid. The pigment concentration was temporarily decreased due to the molecular structure modification and the low pH of the acid treatment. The content of fucoxanthin in seawater was increased at the same time as the pigment content of Porphyra was decreased, and it was the removal effect of attached diatoms. Melosira sp. and Stephanopyxis sp. were dominant species after inorganic acid treatments, that was indicated the removal efficiency by it depending on the characteristics of attached diatom on Phophyra. Therefore, it was that the acid treatment could remove the attached diatoms on the february, and that the higher the inorganic acid concentration, the more the major pigments in the Porphyra can be reduced.
Keywords:
Porphyra yezoensis, acid treatment, Phycoerythrin, Phycocyanin, chlorophyll-a키워드:
방사무늬김, 김활성처리제, 피코에르트린, 피코시아닌, 클로로필 a1. 서 론
수산물 수출 주력상품 중 하나로 연간 수출량이 증가하는 추세다. 김 양식 규모에서 전라남도가 김 양식어장 총면적의 90% 이상으로 가장 높으며, 이중 해남군의 김 양식어장 면적은 7,806 ha로 가장 넓은 김 양식장이 분포한다. 국내 주요 김 양식 종은 방사무늬김과 돌김류이며(Park[2012]), 양식 종을 개선하려는 노력이 있었으나 양식규모가 커질수록 다양한 갯병이 발병하여 김엽체의 퇴색, 품질 저하, 생산량 감소를 야기시켜왔다.
김 양식의 생산성에 영향을 주는 주요 요인은 해적생물인 파래 또는 규조류의 부착이며, 해적생물은 김의 성장을 저해한다(Kang[1972]; Kim[2010]). 이러한 문제를 해결하기 위해 김에 비해 내산성이 약한 해적생물 특성을 이용한 산처리(Kang and Shin[2002])와 그 외 해적생물과 구분되는 김의 생리적 활성 차이를 고려한 온도변화 부류식 양식, 물리적 노출 기법이 개발되어 왔다(Kim[2010]). 이러한 방법 중에서 산처리를 활용한 방법이 김 양식에 주로 활용되어 왔다.
과거 산처리는 주로 무기산으로 처리해 왔고, 이러한 방법은 해적생물 구제에 효과적이나 산처리된 김엽체의 갯병 감염률도 높아질 수 있다. 뿐만 아니라 무분별한 무기산 이용으로 인해 해양환경이 오염될 수 있어 이를 보완하기 위해 1980년대 이후 무기산과 유기산을 복합한 김 활성처리제 사용을 고시하였다(NFRDI[2008]). 해양수산부고시 제 2015~00호에 따르면 무기산 사용 함량은 1997년에 3%, 2000년에 5%까지 허용을 하였고, 현재는 무기산 9.5%, 유기산은 15% 이상 포함할 수 있도록 고시되어있다. 반면, 고시된 무기산과 유기산의 함량의 조정은 주로 어민의 요구에 따른 것으로, 무기산과 유기산 비율에 따른 김 엽체 및 해양환경에 미치는 영향에 대한 모니터링이 필요한 실정이다.
따라서, 본 연구에서는 김 양식장에서 김 활성처리제의 사용시기와 무기산/유기산 비율에 따라 김 엽체의 색소에 어떠한 변화를 줄 수 있는지에 대해 조사하였고, 아울러 김 엽체에서 부착한 규조류에 미치는 영향을 분석해 보고자 하였다.
2. 재료 및 방법
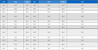
현장 조사는 2015년 12월과 2016년 2월에 해남군 어란리에서 조사를 실시하였다. 김 활성처리제 처리 직 후 김 엽체 색소변동을 알아보기 위해 김 1줄(80 m×2)당 실험구 한 개를 설정하여 총 7개의 실험구를 설정하였다. 김 활성처리제를 사용하지 않은 대조구와, 농도별 무기산 처리제 3개, 농도별 유기산 처리제 3개를 설정하였다. 무기산 처리제는 35% 염산을 희석하여 0.5%, 0.7%, 1.2%로 사용하였고, 각 무기산 처리제의 pH는 0.97, 0.80, 0.68이였다. 유기산 처리제는 9.5% 염산에 5%, 10%, 15% 구연산(5%, 10%, 15%로 표기)을 혼합하여 사용하였고, 각 유기산 처리제의 pH는 0.90, 0.91, 0.91이였다. 김 활성처리제 처리는 어선에서 김 발을 처리제안에 담갔다 건지는 방식으로 처리했다. 수온과 염분은 수질다항목 측정기(YSI-6600)를 사용하여 각 실험구 당 4회 조사하였다.
김 엽체 색소분석은 활성처리제 처리한 직후 김을 채집하여 실험실에서 동결 건조하여 3반복 분석했다. PE와 PC는 건조된 김 엽체 0.1 g에 0.1M phosphate buffer(pH 6.8) 5 ml를 넣어 4 oC 냉암소에서 12시간 이상 추출 후 상등액을 분취하여 분광광도계(Shimadzu, UV-1800)에서 흡광도를 측정하였고, 식은 (1),(2)와 같다(Beer and Eshel[1985]).
| (1) |
| (2) |
Chl-a와 lutein, zeaxanthin, alloxanthin은 건조된 김 엽체 0.1 g을 100% 아세톤 7ml 첨가 후 내부표준물질 canthaxanthin 100 μl를 첨가하여 4 oC 냉암소에서 24시간 추출 후 상등액 1 ml 를 분취하여 HPLC용 water 300 μl와 혼합하여 ACQUITY UPLC H-Class (Water Corp., Milford, MA, USA)를 이용하여 분석하였다. 용매조건 및 농도계산은 해양환경공정시험기준(2014)과 동일한 조건으로 분석하였고(Table 1), 용매조성은 ACQUITY UPLC Columns Calculator를 이용하여 UPLC column에 맞게 전환하여 사용했다.
해수 중 식물플랑크톤 색소와 식물플랑크톤 분석은 Niskin 채수기로 표층해수를 채수 후 실험실로 옮겨 수행하였다. 색소분석은 유리 섬유 여과지(47mm GF/F filter paper, 공경 0.7 μm)를 이용하여 여과 후 100% 아세톤 5 ml 첨가 후 내부 표준물질 canthaxanthin 50 μl를 첨가하여 4 oC 냉암소에서 24시간 추출하여 상등액 1 ml를 분취하여 HPLC water 300 μl와 혼합하여 UPLC로 분석하였고, 분석조건은 김 엽체 색소분석과 동일하다. 김활성 처리 전후 해수의 식물플랑크톤은 200배 또는 400배 비율로 광학현미경(Leica DM2700, Germany) 상에서 검경하여 정량 및 정성분석 하였다.
3. 결과 및 고찰
조사기간인 2015년 12월부터 2016년 2월동안 각 성장단계의 평균 수온은 2015년 12월에 9.18 oC, 2016년 2월에 6.86 oC이다(Fig. 2). 시기에 따른 대조구 김 엽체의 총 색소 농도는 12월에 10.40mg g-1.dry, 2월에 14.59 mg g-1.dry를 보였다. 김의 탈색의 원인 중 하나는 낮은 수온으로 알려졌다(Sano[1955]). Porphyra yezoensis의 수온에 따른 농도별 NH4+의 흡수율은 15 oC>10 oC이고, 5 oC에서는 거의 흡수를 하지 못했다(Kraemer et al.[2004]). 김엽체의 N 함량이 많을수록 phycoerythrin(PE)의 함량이 높다고 알려졌다(Hiroyuki[2002]).
평균 염분은 12월에 31.93, 2월에 33.15이다(Fig. 2). 김의 생장에 적합한 염분은 21.69~32.5로 34.4이상에서는 광합성이 저하된다고 알려졌다(Iwasaki[1965]). 조사기간동안 평균 염분은 34.4를 넘지 않아서 김의 광합성 활동에 영향을 미치지 않았을 것으로 보인다.
김 양식어장에서 김 엽체 색소 중 phycoerythrin(PE), phycocyanin(PC), chlorophyll a(chl-a)가 전체 색소량의 약 90.6%를 차지한 주요한 색소였다. 김은 클로로필 a(chlorophyll a, chl-a), 피코에리트린(phycoerythrin, PE), 피코시아닌(phycocyanin, PC), 루테인(lutein) 등의 색소를 가지는 것으로 보고되어(Kang and Koh[1977]), 김 양식어장에서의 김 엽체 색소의 구성도 유사한 것으로 나타내었다. 반면, 김 양식어장에서의 김 엽체 색소구성 비율은 시기와 활성처리제의 종류에 따라 서로 다르게 나타났다.
PE는 12월 대조구에서 6.50 mg g-1.dry로 전체 색소의 62.5%를 차지했다(Fig. 3,4). 무기산처리제에서 30배 무기산처리제에서는 대조구에 비해 약 98.9%까지 PE 농도가 감소했다. 유기산의 농도가 제일 높은 15% 유기산처리제에서 대조구에 비해 98.9%까지 감소한 값을 보였다. 2월 대조구에서는 7.55 mg g-1.dry로, 전체 색소의 51.7%를 차지했다. 70배 무기산처리제에서는 농도의 변화가 거의 없었고, 50배, 30배 무기산처리제에서는 98.7%까지 농도가 감소했다. 유기산처리제는 모든 실험구에서 90%이상의 감소를 보였다. 김 생산 이후 건조김의 가공에서 색소 함량이 김 엽체의 색택에 중요한 역할을 하고 결과적으로 색소의 유지가 김의 품질은 최종 결정하는 요인이 된다(Saitoh et al.[1975]; Aruga and Miura[1984]). 해남군에서 양식된 김 엽체의 색소 농도는 Chl-a 4mg/g, PE 6mg/g, 특히, PE, Chl-a는 김의 주요 색소이며, 이들은 낮은 pH에서 변성될 수 있다(Ramirez et al.[2000]; Munier et al.[2014]; Puckett et al.[1973]; Ronen and Galun[1984]).

Ratio of Porphyra pigment content in each inorganic acid treatment (A) and organic acid treatment (B).
김 엽체의 PE 함량은 김의 수확시기에 따라 차이를 보이고, 활성처리제를 사용한 김 엽체는 대조구에 비해 최소 5.8%에서 최대 98.9%까지 PE이 감소되었다. PE과 PC등을 포함한 phycobiliportein은 광합성 보조색소로, 엽록소가 흡수하지 못하는 영역의 가시광선을 효과적으로 흡수하고(Lobban and Harrison[1994]; Dawes[1997]), 홍조류에서 주요한 색소이다. Phycobiliportein의 스펙트럼 특성은 pH에 따른 단백질 분자구조 변성에 의해 변한다. PE은 내산성이 불안정하기 때문에 PE의 종류인 R-PE는 pH 2에서 스펙트럼이 왜곡되고, R-PE과 B-PE은 pH 2에서 형광이 97%까지 감소되고, 낮은 pH에서 퇴색을 일으킨다(Ramirez et al.[2000]; Munier et al.[2014]). 활성처리제를 처리한 김엽체가 대조구에 비해 PE 색소함량이 감소하는 것은 pH 1이하인 활성처리제의 사용으로 인한 것으로 유추된다.
김 엽체의 다른 주요색소인 PC은 12월 대조구에서 2.23mg g-1.dry로 전체 색소의 21.5%를 차지했다(Fig. 3,4). 무기산처리제에서는 염산의 농도가 높을수록 PC의 농도가 감소하였고, 30배 무기산처리제에서는 약 98.2%까지 농도가 감소했다. 5%, 10% 유기산처리제는 대조구에 비해 70%정도 감소된 농도를 보였고, 15%에서는 98.2% 감소된 농도를 보였다. 2월 대조구는 2.46mg g-1.dry로, 전체 색소의 16.9%를 차지했다. 무기산처리제는 26.0~98.8%까지 농도가 감소하였고, 유기산처리제는 93.9~98.8%까지 농도가 감소하였다.
김 엽체의 주요색소이자 광합성 색소인 Chl-a는 12월 대조구에서 1.49 mg g-1·dry로 전체 색소의 14.3%를 차지했다(Figs. 3,4). 대조구에 비해 무기산처리제는 98.7~99.3%까지 감소했고, 유기산처리제는 99.3~100%감소했다. 2월 대조구에서 4.04 mg g-1·dry로 27.7%를 차지했다. 대조구에 비해 무기산처리제는 78.0~100%까지 감소했고, 유기산처리제는 99.2~99.8% 감소했다.
연구기간동안 대조구에서 김 엽체의 chl-a는 김이 성장하면서 농도가 증가하였다. 이는 김 엽체에 규조류의 부착으로 인한 것으로 유추된다. 2월에 대조구의 chl-a는 12월 보다 증가하였고, 2월에서 활성처리제를 처리한 김 엽체의 chl-a는 대조구에 비해 감소하였다. 그리고 2월에 표층 해수의 식물플랑크톤 색소인 chl-a와 fucoxanthin의 농도가 대조구에 비해 활성처리제를 처리한 해수에서 증가하였다(Fig. 5). Fucoxanthin은 규조류의 biomarker이다. Chl-a와 fucoxanthin이 높은 상관성을 보이면 식물플랑크톤 군집 중 규조류가 주요한 군집이라는 것을 의미한다(Wysocki et al.[2006]). Chl-a와 fucoxanthin이 높은 양의 상관성(p<0.01)을 보여서(Fig. 6), 표층 해수에서 규조류가 식물플랑크톤의 주요군집으로 보인다. 구연산을 유기산처리제로 사용한 선행연구에 따르면 유기산처리제 처리 후 건강한 엽체의 규조류 탈락율은 60%이상으로 나타났다(Park and Kim[2013]). 선행연구와 활성처리제를 처리한 표층해수의 증가한 fucoxanthin의 농도를 보아 활성처리제 처리 후 김엽체의 chl-a의 감소는 김에 부착된 규조류의 탈락에 의한 것으로 보인다.

Concentration of algal pigments chlorophyll a and fucoxanthin in the surface water by each inorganic acid treatment (A).
김 활성처리제 처리 후 해적생물의 구제율은 활성처리제 종류에 따라 다르지만, 파래의 제거율은 무기산처리제는 약 94%, 유기산 처리제는 종류에 따라 88~93%를 보였다(Kang and Shin[2002]).
반면, 12월에서 활성처리제를 사용한 김엽체의 chl-a농도가 대조구에 비해 감소한 것은 활성처리제의 낮은 pH로 인한 것으로 유추된다. 12월에는 활성처리제를 처리한 김엽체의 chl-a가 감소하였지만 표층해수의 chl-a와 fucoxanthin의 농도가 증가하지 않았다. Chl-a는 pH 6.5이하가 되면 분자구조가 변하여 pheophytin a로 변한다. 낮은 pH에서 chl-a가 분해되고(Puckett et al.[1973]; Ronen and Galun[1984]), 이끼를 극도로 낮은 pH(1.0-2.0)에 담그면 클로로필 분해된다고 알려졌다(Garty et al.[1992]). 연구에서는 pH 1이하인 김 활성처리제를 사용하였기 때문에 강한 산성을 가진 김 활성처리제로 인한 chl-a의 분조구조의 변성으로 인해 활성처리제를 처리한 김 엽체의 chl-a 농도가 감소된 것으로 보인다.
활성처리제 사용 전후 해양 식물플랑크톤 구성 중 주요 우점종 Melosira sp., Stephanopyxis sp., Paralia sulcata의 분포를 조사하였다(Fig. 6-8). 12월 조사에서 Paralia sulcata가 주요 우점종으로 나타났으나, 활성처리제 후 해수 중 식물플랑크톤에는 차이를 보이지 않았다(P<0.05). 반면, 2월 조사에서 Melosira sp., Stephanopyxis sp.가 우점한 환경에서는 무기산 활성처리제를 처리한 후 해수 중 이들의 생물량이 급격히 증가하는 것을 볼 수 있었다. Paralia sulcata는 부착성 규조류로 주로 저층에 서식하며, 이들의 생태적 특징으로 조간대에 습지를 형성하는 지역의 과거환경을 예측하는 지질학적 표본으로 활용되고 있다(Sawai[2001]). 2월에 상대적으로 대조구의 생물량이 많았으나, 산처리 이후에도 김 엽체에서 탈락되는 개체가 적은 것은 Paralia sulcata의 강한 부착 특징에 기인된 것으로 판단된다. 반면, Melosira sp.나 Stephanopyxis sp.는 기회 부착종(opportunistic periphyton)으로 환경에 따라 기질에 부착하거나 해수 중에 부유하는 생활을 병행한다(Alverson and Theriot[2003]). 본 연구결과에서는 무기산의 농도에 따라 김 엽체에서 탈락되는 효과가 점차 증가하나, 유기산의 농도에는 효율의 차이를 볼 수 없는 것으로 나타났다. 따라서 본 연구에서는 김양식어장의 김 엽체에 부착한 생물종에 따라 활성처리제의 효율에 차이를 줄 수 있는 것을 확인 할 수 있었으며, 향후 김 활성처리제의 사용 시기의 선정에 매우 중요한 자료로서 활용될 수 있음을 보였다.

Variation of Melosira sp. in the sea water in each inorganic acid treatment (A) and organic acid treatment (B); % values are indicated the composition ratio of total phytoplankton biomass.

Variation of Stephanophyxis sp. in the sea water in each inorganic acid treatment (A) and organic acid treatment (B); % values are indicated the composition ratio of total phytoplankton biomass.
4. 결 론
본 연구에서는 김 활성처리제를 처리한 직 후 김엽체의 주요색소인 chl-a와 fucoxanthin 함량이 감소됨을 알 수 있었다. 이러한 결과는 무기산과 유기산을 이용한 김 활성처리제가 김엽체에 부착한 규조류 등의 해적생물 제거에 도움이 될 수 있다는 것으로 판단되었다. 이는 김활성처리제의 사용 후 해수 중의 chl-a와 fucoxanthin 농도가 일시적으로 증가하는 것으로 입증 될 수 있었다. 아울러 무기산 활성처리제 사용 후 해수중 Melosira sp.나 Stephanopyxis sp.의 생물량이 처리 농도에 따라 증가하는 것으로 보아, 김 엽체에 부착한 규조류의 특징에 따라서도 활성처리제의 효율에 영향을 줄 수 있음을 알 수 있었다.
References
-
Alverson, A. J., and Theriot, E. C., (2003), “Taxon sampling and inferences about diatom phylogeny”, J. Phycology, 39(S1), p1.
[https://doi.org/10.1111/j.0022-3646.2003.03906001_1.x]

- Aruga, Y., and Miura, A., (1984), “In vivo absorption and pigment contents of the two types of color mutants of Porphyra”, Jap. J. Phycol, 32, p242-250.
-
Beer, S., and Eshel, A., (1985), “Determining phyoerythrin and phycocyanin concentrations in aqueous crude extracts of red algae”, Aust. J. Mar. Freshw. Res., 36, p785-792.
[https://doi.org/10.1071/mf9850785]

- Dawes, C. J., (1997), Marine botany, second edition, John Wiley and Sons Inc., NY, p480.
-
Du, Y. J., Hayashi, S., and Sen, S. L., (2014), “Impact of laver treatment practices on the geoenvironmental properties of sediments in the Ariake sea”, Mar. Pollut. Bull., 81(1), p41-48.
[https://doi.org/10.1016/j.marpolbul.2014.02.027]

- Garty, J., Karary, Y., and Harel, J., (1992), “Effect of low pH, heavy metals and anions on chlorophyll degradation in the lichen Ramalina duriaei (de not.)”, Bagl. Environ. Exp. Bot., 32(3), p229-241.
- Hiroyuki, M., (2002), “Relationship between phycoerythrin and nitrogen content in Gloiopeltis furcata and Porphyra yezoensis”, Algae, 17(2), p89-93.
- Iwasaki, H., (1965), “Studies on the physiology and ecology of Porphyra tenera”, J. Fac. Fish & Anim. Husb., Hiroshima Univ., 6(1), p171-193.
- Kang, J. W., and Koh, N. P., (1977), “Seaweed culture”, Tae Hwa Co., Ltd, Busan, p24-41.
- Kang, J. W., (1972), “Diseases of the cultivated porphyra at culture beds with special reference to the effects of fertilizer plant effluents”, Bull. Kor. Fish, 5(2), p39-44.
- Kang, S. P., and Shin, J. A., (2002), “An experiment of acid treatments for Porphyra cultivation”, Bul., fisheries Sci. Inst., Yeosu Natl. Univ., p109-126.
- Kim, S. O., (2010), “A development of cultivar and implication for disease prevention in the Porphyra farms”, Domestic doctor, Mokpo Natl. Univ., 10, p103-104.
-
Kraemer, G. P., Carmona, R., Chopin, T., Neefus, C., Tang, X., and Yarish, C., (2004), “Evaluation of the bioremediatory potential of several species of the red alga Porphyra using short-term measurements of nitrogen uptake as a rapid bioassay”, J. Appl. Phycol., 16(6), p489-497.
[https://doi.org/10.1007/s10811-004-5511-2]

-
Lobban, C. S., and Harrison, P. J., (1994), “Seaweed ecology and physiology”, Cambridge Univ. Press, Cambridge, p366.
[https://doi.org/10.1017/cbo9780511626210]

-
Munier, M., Jubeau, S., Wijaya, A., Morancais, M., Dumay, J., Marchal, L., and Fleurence, J., (2014), “Physicochemical factors affecting the stability of two pigments: R-phycoerythrin of Grateloupia turuturu and B-phycoerythrin of Porphyridium cruentum”, Food Chem., 150, p400-407.
[https://doi.org/10.1016/j.foodchem.2013.10.113]

- NFRDI, (2008), “A Study on the effects of activator(acid treatment) on environment in Porphyra aquaculture farm”, Report of NFRDI, p140.
- Park, J, H., (2012), “Estimation of mass balance and carrying capacity in Porphyra farm”, Domestic master, Pukyoung Natl. Univ., p13-14.
-
Park, S. W., and Kim, D. H., (2013), “Effects of commercial activating treatment agent on cultured Porphyra yezoensis thalli”, J. Fish Pathol., 26(3), p275-282.
[https://doi.org/10.7847/jfp.2013.26.3.275]

- Puckett, K. J., Nieboerm, E., Flora, W. P., and Richardson, D. H. S., (1973), “Sulphur dioxdie: its effect on phytotoxicity”, New Phytol., 72(1), p141-154.
- Ramirez, O. A., Merrill, J. E., and Smith, D. M., (2000), “pH affects the thermal inactivation parameters of R-phycoerythrin from Porphyra yezoensis”, J. Food Sci. Chicago, 65(6), p1046-1051.
-
Ronen, R., and Galun, M., (1984), “Pigment extraction from lichens with dimethyl sulfoxide(DMSO) and estimation of chlorophyll degradation”, Environ. Exp. Bot., 24(3), p239-245.
[https://doi.org/10.1016/0098-8472(84)90004-2]

- Saitoh, M., Araki, S., Sakurai, T., and Oohusa, T., (1975), “Variations in contents of photosynthetic pigments, total nitrogen, total free amino acids and total free sugars in dried lavers obtained at different culture grounds and harvesting times”, Jap. Soc. Fish. Sci., 41, p368-370.
- Sano, T., (1955), “Studies on the colour changes of cultured lavers, On the change of hydrochrome”, Bull. Tohoku Reg. Fish Res. Lab, 4, p243-261.
-
Sawai, Y., (2001), “Distribution of living and dead diatoms in tidal wetlands of northern Japan: relations to taphonomy”, Palaeogeogra., Palaeoclimatolo., Palaeoecolog., 173, p125-141.
[https://doi.org/10.1016/s0031-0182(01)00313-3]

-
Wysocki, L. A., Bianchi, T. S., Powell, R. T., and Reuss, N., (2006), “Spatial variability in the coupling of organic carbon, nutrients, and phytoplankton pigments in surface waters and sediments of the Mississippi River plume”, Estuar. Coast. Shelf Sci., 69(1), p47-63.
[https://doi.org/10.1016/j.ecss.2006.03.022]