Vibrio fischeri를 이용한 유해물질 생태독성 평가
 ; Jongyoung Kim3
; Jongyoung Kim3 ; Hyunjung Jo3
; Hyunjung Jo3 ; Hyeryeon Song3
; Hyeryeon Song3 ; Seuk Cheon2
; Seuk Cheon2 ; Dongmin Seo4
; Dongmin Seo4 ; Moonjin Lee5
; Moonjin Lee5 ; Juseong Lee3, †
; Juseong Lee3, †
초록
해양 또는 연안에서의 해상운송 위험·유해물질의 사고 및 유출 방지를 위하여 상시 배출 감시 시스템이 필요하다. 생물 감지 시스템구축의 기초자료 제공을 위하여 해양성 발광박테리아(Vibrio fischeri)를 이용한 Hazardous and Noxious Substances(HNS)의 생태독성을 평가하였다. 구리, 주석 등 중금속 6종을 포함한 금속류 11종, 핵산, 페놀 등 유기화합물질 12종과 독성이 강한 시안을 포함한 총 24종의 개별 물질에 대해 평가를 하였다. 금속 11종 및 무기화합물인 시안화물에 대한 독성평가 결과 노출시간 30분을 기준으로 바나듐, 바륨, 구리, 주석, 망간, 은, 아연, 안티몬 및 알루미늄의 EC50값은 0.0318~0.73 mg/L 범위로 나타났다. 니켈의 30분 노출 EC50값은 1.39 mg/L, 붕소의 경우는 EC50값이 243.6 mg/L로 나타났다. EC50값에 따른 독성 범위는 붕소의 경우 toxic(+)으로 분류되었으며, 나머지 10개의 금속류는 very toxic(++) 수준으로 평가되었다. 무기화학 물질인 시안화물의 경우 30분 노출 EC50값은 0.975 mg/L로 very toxic(++) 수준으로 평가되었다. 금속류의 독성도는 주석>안티몬>알루미늄> 바륨>바나듐>구리>망간>아연>은>니켈>붕소 순으로 나타났다. 노출시간 30분을 기준으로 에틸 벤젠 등 조사대상 12종의 유기화학물질의 EC50값은 1.855∼51,667 mg/L 범위를 보였다. 이는 금속류의 EC50 값 0.0318~243.6 mg/L에 비하여 농도도 높고 범위도 넓은 것으로 나타났다. 유기화학물질의 독성도는 에틸 벤젠>자일렌>톨루엔>사이클로헥세인> 페놀>벤젠> 1,2-디클로로 에탄>아세트산 에틸>부탄>헥산>이소프로필알코올> 메탄올 순으로 나타났다. 금속류의 독성 평가에서 붕소, 바륨, 구리, 아연, 알루미늄의 경우는 30분 노출 시 EC50값이 노출시간 5분 혹은 15분의 EC50값에 비하여 낮게 나타나 이들 금속류는 반응 완결에 노출시간이 더 필요한 것으로 판단된다. 시안화물의 경우 역시 반응완결에 시간이 더 필요한 것으로 나타났다. 노출 시간에 따른 유기화학물질의 EC50값의 변동에서 아세트산 에틸 등 9개 물질의 경우는 노출시간 5분, 15분 및 30분의 EC50값 중 노출시간 5분 EC50값이 낮아 노출 초기 독성도가 더 높은 것으로 나타났다. 다양한 유해물질에 대한 독성 평가 값은 향후 발광발테리아를 이용한 HNS모니터링 및 영향 평가 등에 있어서 활용될 수 있는 기초자료가 될 것으로 판단된다.
Abstract
Korea Ecotoxicity assessment was conducted for the purpose of monitoring the leakage of Hazardous and Noxious Substance (HNS) and mixed toxicity evaluation. Ecotoxicity was evaluated by using Vibrio fischeri for total of 24 individual substances. The substances were consisted of 11 metals including 6 heavy metals such as Tin and Copper, 12 organic substances such as Hexane and Phenol, and Cyanide. Vibrio fischeri was exposed to 11 metals and inorganic Cyanide for 30 minutes. The EC50 of the metals including Vanadium, Barium, Copper, Tin, Manganese, Silver, Zinc, Antimony, and Aluminium was measured in the range of 0.0318~0.73 mg/L. EC50 value of Nickel was 1.39 mg/L and EC50 of Boron was 243.6 mg/L. The toxicity level of Boron was classified as toxic(+) and other 10 metals were graded as very toxic(++). For the inorganic chemical Cyanide, EC50 value at 30 minutes was 0.975 mg/L and toxicity level was graded as very toxic(++). The toxicity of metals was evaluated in order of Tin > Antimony > Aluminum > Barium > Vanadium > Copper > Manganese > Zinc > Silver > Nickel > Boron. based on the exposure time of 30 minutes, the EC50 values of 12 organic compound ranged from 1.855 to 51,667 mg/L. The organic compound was found the concentration was higher and the range was wider than the EC50 values of the metal. The toxicity of organic chemicals was evaluated in the order of Benzene> Xylene>Toluene>Cyclohexane> Phenol>Benzene>1,2-Dichloro Ethane>Ethyl Acetate>Butane >Hexane>Isopropyl Alcohol>Methanol. In the toxicity evaluation of metals, the EC50 value at 30 minutes of Boron, Barium, Copper, Zinc and Aluminium was lower than the EC50 at 5 minutes or 10 minutes. It was considered requiring more time to complete reaction. In the case of cyanide, it was also found that more time was required for the completion of the reaction. In the variation of EC50 of organic compounds according to exposure time, the EC50 of 9 organic compounds such as Ethyl Acetate were low at 5 minutes of exposure time among the EC50 of 5 minutes, 15 minutes and 30 minutes of exposure time. Ecotoxicity assessment for varius hazardous substance is expected to be a baseline data that can be used for HNS monitoring and impact assessment in the future.
Keywords:
Ecotoxicity, Toxicity assesment, Luminescent bacteria, Vibrio fscheri, Hazardous substance, HNS키워드:
생태독성, 독성평가, 발광박테리아, 해양성 발광박테리아, 위험물질, 유해물질1. 서 론
가속화되는 산업발달로 인해 다양한 오염물질이 환경으로 지속적으로 배출되고 있다. 농약, 유기물, 중금속, 항생제, 나노물질 등은 환경으로 배출 시 토양과 수생태계를 오염시키고 그곳에 서식하는 생물에 영향을 미쳐 생태계교란 등의 환경문제를 야기하기도 한다(Hong et al.[2020]; Lee et al.[2020]; Binaeian et al.[2012]; Kong et al.[2015]; Efremova Aaron et al.[2019]; Yanga et al.[2021]; Laetz et al.[2009]).
2021년 기준 우리나라에서 유통되는 화학물질의 종류는 약 46,000종(NCIS), 2018년 기준 국내 화학물질의 유통량은 638.2 백만톤으로 조사되었다. 수입량은 332백만톤, 수출량은 120.2 백만톤으로 수출입 물동량은 452.2 백만톤으로 나타났다(https://kosis.kr).
2015년 기준 국내의 해상 유통 위험·유해물질(HNS; Hazardous and Noxious Substances)은 약 6천여 종 251백만 톤으로 전 세계 해상 운송량의 약 19% 정도로 보고하고 있다(Kim et al.[2015]; Lee et al.[2020]). 이는 위험·유해물질 중 많은 양이 해상을 통해 운송되고 있음을 시사하고 있으며, 2006~2013년 동안 전 세계적으로 총 305건, 321종의 해상 HNS 유출사고가 보고되었다(Kim et al.[2015]).
HNS는 종류와 물리화학적 성질이 다양하여 해양유출사고 시 효과적인 대응 방안 마련이 쉽지 않은 상황이다.
우리나라의 경우 HNS는 해양환경관리법 상 유해액체물질 545종(X류 71종, Y류 352종, Z류 122종)과 국가긴급방제계획에 포함되는 위험·유해물질 68종이 지정되어있다. HNS사고와 관련하여 국제유조선선주오염연맹(ITOPF; International Tanker Owners Pollution Federation Limited)는 황산, 수산화나트륨 등과 산·알칼리 물질, LNG·LPG와 같은 가스상 물질, 페놀 등 유기물질 등 20가지를 가장 위험도가 높은 물질로 지정하였다(ITOPF[2014]).
해양을 통하여 운송되고 있는 위험물질은 해양환경관리법 및 국가긴급방제 계획에서 지정한 물질(HNS) 이외에도 위험물선박운반 및 저장규칙에서 지정한 위험물질 중에는 금속물질도 존재하는데 이들 중 일부는 금속분말 이나 금속덩어리도 있지만 대부분은 다른 물질과 결합된 금속화합물질이다.
92개의 자연발생원소 금속 및 준금속류 중 약 30개 정도가(B, Al, V, Mn, Ni, Cu, Ag, Sn, Sb, Ba 등) 사람에게 땭=nü{잠재적으로 독성을 갖는 것으로 보고하고 있다(Morais et al.[2012]). 육상에서 폐수배출시설의 경우 생태독성의 주요원인 물질로 염·유기화합물 및 중금속 등을 제시하였으며, 생태독성 발현원인이 염(31.4%), 유기화합물(25.7%), 중금속(22.8%) 3가지가 전체 생태독성 원인물질의 80%를 차지하는 것으로 보고하고 있다(ME[2011]).
환경으로 배출되는 위험·유해물질에 대하여 물질별로 대응하는 모니터링 방법은 화학물질 종류 대비 현실적 한계가 있어 이를 보완하기 위하여 생태독성평가방법이 함께 이용되고 있다(USEPA[2005]). 생태독성평가방법은 오염물질에 대하여 생물이 반응하는 독성의 영향을 상대적 강도로 비교하는 기법(USEPA[1985])이다. 화학물질에 대한 안정성 확인이 중요한 환경 문제로 부각되고 있는 시점에 생태독성평가기법은 오염물질이 생태계에 미치는 중요 정보를 제공하며(Jang et al.[2017]) 화학분석 대비 노동 및 비용절감과 생물반응에 근거한 통합독성분석방법으로 환경독성에 대한 객관적 평가수단으로 인정받고 있다(Lee et al.[2008]).
생물독성 평가는 DNA 손상, 효소활성 등 분자 수준의 평가 방법, 유전자 재조합, 세포 분석 등 세포 수준의 평가 방법, 개체 생활사의 일부를 이용하는 방법, 발광미생물, 식물플랑크톤, 동물플랑크톤, 단각류, 갑각류, 이매패류, 어류 등 개체에 대한 영향 측정방법, 군집 조사와 같은 생태계 영향조사 방법 등으로 다양하다(Lee et al.[2008]).
해양에서 사고 등에 의한 위험·유해물질의 유출시 독성평가 시험시간이 짧고 적용 범위가 다양한 생물을 이용하여 빠른 결과의 도출이 필요하다. 따라서 해양수산부 해양환경공정시험기준(별표 4, 제21항)에서 해양 퇴적물의 독성평가에 적용되고 있는 해양성 발광박테리아(Vibrio fischeri, ISO 11348)를 평가 대상 생물로 선정하였다.
V. fischeri의 발광성은 집단-의존(quorum sensing) 기전으로 박테리아가 자기유도물질을 생산하여 방출하고 자기유도물질은 유전자를 발현시켜 세포집단 밀도를 급격히 증가시켜 발광 등을 촉진시키는 작용이다. 이러한 발광반응은 luciferase 효소에 의하여 촉진된다. 아래와 같이 장쇄지방족 알데하이드가 산화되고 플라빈모노뉴튜클레오타이드(FMNH2)가 환원되어 루시페란(FMN), 알데하이드 산화형 및 물이 생성되며, 490 nm에서 남-청색의 초과자유에너지가 생산된다(Scheerer et al.[2006]; Shukla et al.[2020]).
생물발광을 위한 전자전달계의 활성도는 탄소와 에너지 대사의 중심 반응에 의해 유도되는 과정으로 전자전달계에 대한 혼란의 발생은 생물발광에 영향을 미친다. 이 발광변화량의 측정은 전자전달계에 혼란, 즉 유해성을 평가하는 것에 대한 직접적이고 빠른 평가 방법이다(Scheerer et al.[2006]).
발광박테리아 독성평가기법은 상업화된 키트 형태로 판매되고 있으며, 상대적으로 짧은 시간에 많은 시료의 독성을 검사할 수 있고, 반복성과 감도가 좋으며, 비용 경제적인 방법으로 알려져 있다(Yang et al.[2016]; Klapötke et al.[2021]). 또한, 중금속, 유기금속 및 유기화합물 등과 같은 유해물질의 독성, 하천수, 기수 및 해수와 같은 공공수역과, 하수, 폐수, 오수 및 방류수와 같은 배출수, 지하수 및 공극수와 슬러지, 폐기물 및 해양배출물질, 퇴적물 및 준설물질 및 토양의 독성 평가에 이용되고 있으며(Lee et al.[2008]; Abbas et al.[2018]), 최근에는 나노물질의 독성(Baniamerian et al.[2018]), 약용식물의 효능 평가(Shukla et al.[2020])에도 사용되고 있는 것으로 알려져 있다.
본 연구는 HNS 등과 같은 해상운송위험·유해물질의 해양 혹은 연안에서 사고 등에 따른 유출 감시 및 혼합독성 평가에 활용하기 위하여 구리, 주석 등 중금속 6종을 포함한 금속류 11종, 핵산, 페놀 등 유기화합물질 12종과 독성이 강한 시안을 포함한 총 24종의 개별 물질에 대한 생태독성자료 산출을 목적으로 하고 있다.
2. 재료 및 방법
2.1 독성평가 대상물질
독성평가 대상 물질은 Table 1과 같다. 금속류 11종의 독성 평가에 사용된 혹은 화합물은 Vanadium, Boron, Cupper, Tin, Silver, Zinc, Nickel, Antimony, Alluminium은 각각 표준물질(KANTO, AAS; Atomic Absorption Spectrochemical analysis)을 사용하였으며, Barium은 표준물질 (SIGMA, AAS) 및 Magnesium은 표준물질(MERK, SRM; Standard Reference Material)을 Cyanide은 표준물질(SIGMA, IC; Ion Chromatography)을 사용하여 독성평가시험에 사용하였다.
독성평가 대상 유기화합물 12종은 Table 2와 같다. Butane은 1-Butanol(SAMCHUN, SG; Special Grade), Isopropyl Alcohol은 2-Propanol(SAMCHUN, SG), Ethyl Acetate(J.T.Baker, HPLC; High Performance Liquid Chromatography), Hexane은 n-Hexane(SAMCHUN, SG), Methanol(KANTO, GR; Guaranteed Reagent), Phenol(SAMCHUN, SG), Cyclohexane(SAMCHUN, SG), Xylene(SAMCHUN, SG), Benzene(SAMCHUN, EP; Extra Pure), Toluene(SAMCHUN, SG), Ethyl Benzene(SAMCHUN, SG), 1,2-Dichloro Ethane(SAMCHUN, SG)을 사용하여 독성평가시험에 사용하였다.
2.2 시험생물 및 배양시약
본 연구에서 독성시험에 사용된 시험생물 및 관련시약은 Modernwater 社(USA)에서 제공되는 Microtox LX 제품을 이용하였다. 시험생물은 동결건조된 Microtox acute reagent(AZF686018A)를 사용하였고, 발광박테리아 활성화 시약은 Reconstitution solution(AZF686016), 삼투압을 조정하는 Osmotic adjusting solution(22% NaCl, AZF686019) 및 시료와 시약을 희석하는 Diluent(2% NaCl, AZF686011)을 사용하였다. Microtox acute reagent는 냉동보관 하였으며(-20℃) 사용 전에 Reconstitution solution을 넣어 온도 5℃ well plate에 5분간 유지시킨 후 독성평가에 사용하였다.
2.3 시험조건 및 장비
V. fischeri의 독성에 대한 평가를 위한 시험 조건은 Table 3과 같다. 독성측정 장비는 Microtox LX을 사용하였다. 정도 관리는 수질오염공정시험기준에 제시된 표준독성물질 ZnSO4·7H2O를 사용하여 15분 EC50 허용범위 3~10 mg/L를 충족하는지에 대한 정도 관리를 실시하였다. 그결과 동일 농도 3회 수행시 각각 EC50은 3.978, 5.059 및 7.268 mg/L로 시험법에서 제시된 허용범위를 충족하였다.
독성물질에 대한 급성독성시험은 활성화된 발광박테리아를 대상 물질에 5~30분간 노출 후 발광 변화를 측정하였다. 독성시험결과는 독성측정 장비는 Microtox LX에서 계산된 EC50값을 제시하였다.
2.4 독성값 산출
EC50 값에 근거한 독성도의 상대비교를 위하여 각 개별 금속 및 유기물질의 독성은 식 (1)에 의하여 산출 하였다(Tongur and Yildiz[2020]).
| (1) |
3. 결과 및 고찰
3.1 독성 기준
고에너지 소재인 RDX, ammonium perchlorate, 및 azide salt의 수중 독성평가를 수행한 연구에서(Klapötke et al.[2021]) EC50값의 독성기준을 제시하였다. V. fischeri 30분 노출에 대한 EC50값을 기준으로 독성의 수준을 0.10 g/L ≤ EC50 범위는 very toxic(++), 0.10g/L < EC50<1.00g/L은 toxic(+), 1.00g/L ≤ EC50은 less toxic(-)으로 나타냈다.
Lepidium sativum, D. magna 및 V. fischeri를 이용한 독성평가 연구에서 뇌전증 치료제인 Carbamazepine의 TU값의 대한 독성 기준을 제시하였다. TU 값을 기준으로한 급성독성 분류시스템에서는 아래와 같이 독성 수준을 분류하였다(Tongur and Yildiz[2020]).
3.2 독성평가
V. fischeri를 이용한 금속 11종 및 무기화합물 Cyanide에 대한 독성평가 결과는 Table 5와 같다. 노출시간 30분을 기준으로 Vanadium, Barium, Copper, Tin, Manganese, Silver, Zinc, Antimony 및 Aluminium의 EC50값은 0.0318~0.73 mg/L 범위로 나타났다. EC50값이 1mg/L 이하인 경우는 급성독성분류시스템(Tongur and Yildiz[2020])에서 독성도 TU가 100 이상이다. 이는 Class IV의 Very toxic의 수준을 상회하는 고고독성으로 분류되어 진다.
Nickel의 30분 노출 EC50값은 1.39 mg/L, TU 100 이상으로 급성독성 분류시스템에서 ClassⅣ의 Very toxic의 수준이었으며, Boron의 경우는 EC50 243.6 mg/L, TU 0.41로 산정되어 Class II의 slightly toxic 수준으로 나타났다. Boron의 경우 EC50 243.6 mg/L로 EC50값으로 분류한 독성기준을 적용하면(Klapötke et al.[2021]), toxic(+) 수준에 속하는 것으로 분류 되었으며, 그 이외 10개의 금속류는 EC50값이 100 mg/L 이하인 very toxic(++) 수준으로 평가되었다. 금속류의 독성도는 Tin>Antimony>Aluminum>Barium>Vanadium>Copper>Manganese>Zinc>Silver>Nickel>Boron 순으로 나타났다.
무기화학물질인 Cyanide의 경우 30분 노출 EC50값은 0.975 mg/L로 very toxic(++) 수준으로 나타났고, TU 102.56로 급성독성분류시스템에서 Class IV의 Very toxic의 수준을 상회하는 고고독성으로 평가되었다.
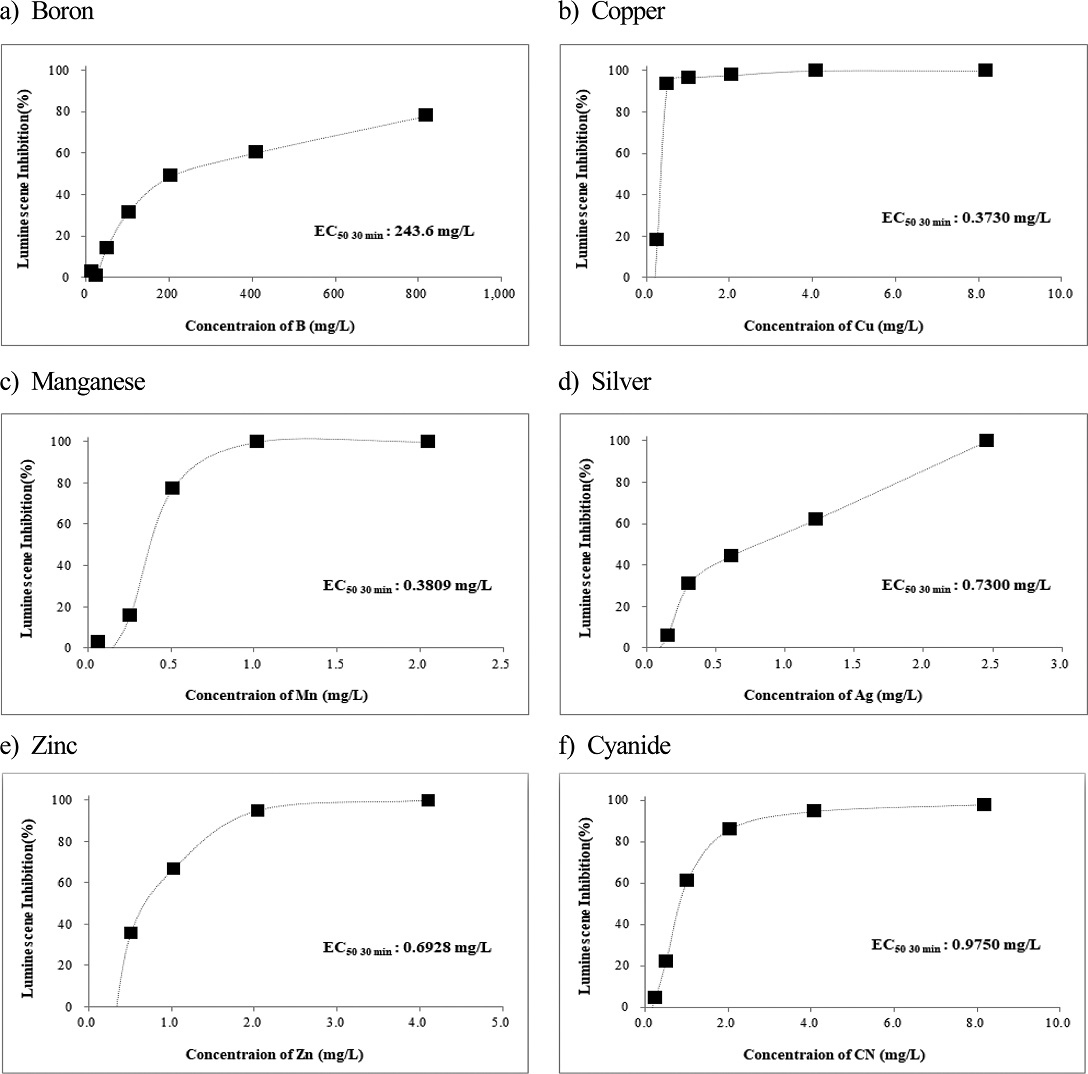
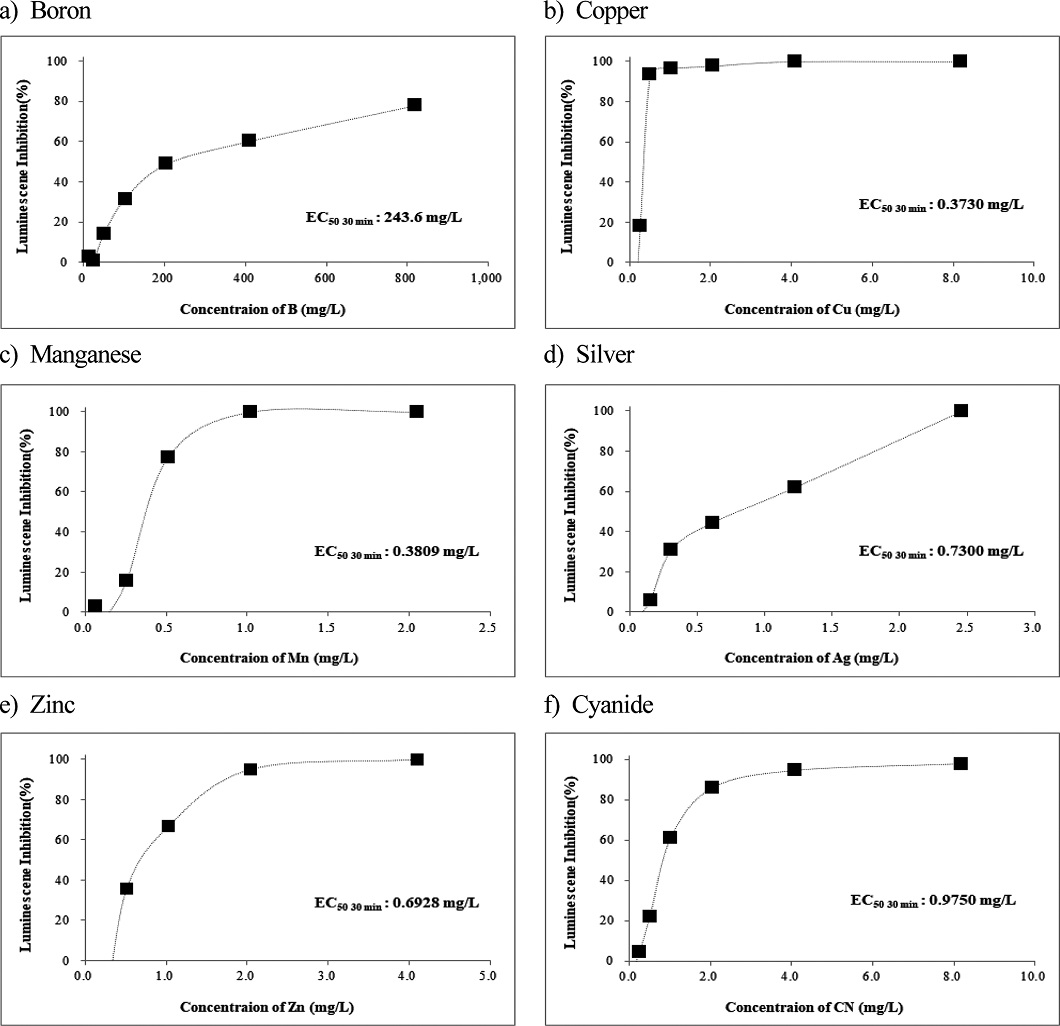
본 연구에서 독성평가 대상 물질 중 Boron을 제외한 금속류 10종과 무기화학물질인 Cyanide는 고독성수준을 초과하는 고고독성으로 평가 되었다. 각 금속의 EC50값을 산출하기 위한 금속 농도와 억제효과에 대한 양-반응관계 실험 결과는 Fig. 1과 같다.
Vanadium (V)은 정상세포성장에 필요한 미량금속으로 1 mg/L 농도 이상에서 독성을 보였다(Xu et al.[2015]). 캐나다의 Athabasca 지역 기름모래 역청의 미량금속 독성연구에서 녹조류 Pseudokirchneriella subcapitata와 Scenedesmus quadricauda 2종에 대한 Vanadium의 EC50는 각각 3.24 mg/L, 4.12 mg/L로 보고하였다(Schiffer and Liber[2017]). 토양에서 2종의 미생물과 3종의 식물을 대상으로 한 연구에서 Vanadium의 EC50값을 0.8~15 mg/L 범위로(Larsson et al.[2013]), D. magna에 대한 EC50값은 1.2 mg/L(Okamoto et al.[2014])로 보고하였다. 본 연구에서 Vanadium의 30분 기준 EC50값은 0.2512 mg/L로 평가되었다.
Boron은 유리류, 비료, 농약, 세라믹 등에 널리 쓰이며, 환경으로 유입은 풍화작용이나 하수의 배출 등에 의한다. 세균에 대한 Boron의 급성 및 만성독성이 농도 범위는 8~340 mg/L 범위로 대부분 값은 18 mg/L 이내를 보였으며, 몇몇 무척추동물의 경우는 EC50값(24, 48 시간) 범위는 95~1,376 mg/L로 대부분의 값은 100~200 mg/L로 나타났다(https://www.greenfacts.org/en/boronl-2/boron-1.htm). D. magna에 대한 EC50값은 0.013 mg/L(Okamoto et al.[2014])로 보고하였다. 본 연구에서 Boron의 30분 기준 EC50값은 243.6 mg/L로 산출되었다.
오일과 가스 생산 용수에 존재하는 Barium에 대한 생태독성 조사한 연구에서 용존바륨(Barium sulfate)에 대한 물벼룩(Ceriodaphnia dubia)의 EC50값은 17 mg/L (McKnight et al.[2018])로 나타났다. 또한 50종의 금속에 대한 물벼룩(D. magna)에 대한 급성독성시험에서 바륨에 대한 EC50값은 11 mg/L 임을 보고하였다(Okamoto et al.[2014]). 본 연구에서 30분 기준 Barium에 대한 EC50값은 0.2412 mg/L로 산정되었다.
V. fischeri를 중금속과 휴믹산의 독성상호작용 연구에서 Copper의 EC50값을 0.5 mg/L, Zinc에 대한 EC50값은 1.49 mg/L로(Tsiridis et al.[2006])나타났다, 농약과 구리의 독성 상호작용 평가 연구에서 EC50값을 0.18 mg/L로(Kungolos et al.[2006]), 살충제와 중금속의 혼합독성연구에서 Copper의 15분 EC50값을 0.53 mg/L로 제시하였다(Yin et al.[2019]). 본 연구에서 Copper와 Zinc의 15분 EC50값은 각각 0.7001, 1.060 mg/L로 평가되었다.
Triclosan의 독성영향 연구에서 30분 기준으로 EC50값을 Cu2+ 16.409(16.134~16.684)mg/L, Zn2+ 22.787(18.479~27.095)mg/L를 보고하였고, 선행연구결과로 Cu2+의 경우 0.25~36 mg/L, Zn2+은 0.488~13.4 mg/L로 제시하였다(Kim et al.[2014]). D. magna에 대한 EC50값은 0.013 mg/L(Okamoto et al.[2014])로 보고하였다. 본 연구에서 30분 EC50값은 0.373 mg/L로 평가되었다.
은나노물질연구에서 D. magna의 48 h. 급성독성으로 AgNO3의 EC50값을 0.0023 mg/L로(Asghari et al.[2012])로, 다른 연구에서는 0.00091 mg/L(Okamoto et al.[2014])로 나타났다. 또한 그람음성세균인 Pseudomonas putida mt-2의 EC50값은 0.175 mg/L(Hachicho et al.[2014])로 보고하였다. 본 연구에서 Silver에 대한 30분 EC50값은 0.73 mg/L로 평가되었다.
금속류에 대한 D. magna의 EC50 연구에서 Nickel의 EC50값을 0.65 mg/L(Okamoto et al.[2014]), 일본 강을 대상으로한 생물학적 이용 모델개발연구에서 용존 Nickel의 D. magna에 대한 EC50은 0.52~4.0 mg/L 범위였음을 보고하였다(Mano and Shinohara[2020]). 본 연구에서 Nickel에 대한 30분 EC50값은 1.390 mg/L로 D. magna의 EC50 범주에 포함되는 것으로 평가되었다.
오스트리아의 아열대와 열대해역에서 말미잘(Exaiptasia pallida)에 대한 Aluminum의 EC50값은 28℃에서는 2.270 mg/L, 24℃에서 8.870 mg/L 이었으며(Trenfieldabc et al.[2017]), D. magna에 대한 EC50값은 3.9 mg/L(Okamoto et al.[2014])로 보고하였다. 본 연구에서 Aluminum의 30분 EC50값은 0.2091 mg/L로 평가되었다.
미생물 생장에 대한 Antimony의 저해효과 연구에서 Escherichia coli, Bacillus subtilis 및 Streptococcus aureus에 대한 EC50값을 각각 555, 18.4, 및 15.8 mg/L로 보고하였고(An and Kim[2009]), 금속염에 대한 생태독성 연구에서 D. magna에 대한 EC50값은 4.1 mg/L(Okamoto et al.[2014])로 보고하였다. 본 연구에서 Antimony에 대한 30분 노출 EC50값은 0.0651 mg/L로 타 세균과 물벼룩에 비하여 높은 독성을 나타내었다.
산업폐수에서 Cyanide와 Thiocyanates의 광화학분해연구에서 V. fischeri의 Cyanide에 대한 15분 노출 EC50값을 약 2 mg/L로 보고하였다(Mediavilla et al.[2019]). 본 연구에서 Cyanide의 15분 EC50값은 약 1.52 mg/L로 평가되었다.
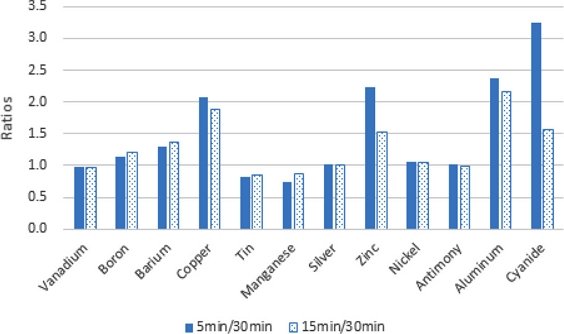
Vanadium, Silver, Nickel 및 Antimony의 경우 독성 평가에서 30분 노출 시 EC50의 값이 노출시간 5분 혹은 15분의 EC50값과 거의 유사하게 나타났다. 노출시간 경과에 따른 독성도의 증가를 보이지 않았으며, 위의 금속들은 독성반응이 빠르고 노출시간이 경과해도 초기 독성효과가 지속되거나 혹은 회복되는 특성을 갖는 것으로 생각된다.
반면 Boron, Barium, Copper, Zinc, Aluminium의 경우는 Fig. 2에서와 같이 노출시간 5분, 15분의 EC50값이 노출시간 30분 EC50값에 비하여 각각 1.3~2.4배, 1.4~2.2배 정도로 높게 나타나 반응 완결에 시간이 더 필요한 것으로 나타났다. Cyanide의 경우에는 노출시간 5분, 15분의 EC50값이 노출시간 30분 EC50값에 비하여 각각 3.25배, 1.56배 정도로 높아 이 물질의 경우 역시 반응 완결에 시간이 더 필요한 것으로 나타났다.
중금속의 광 저해반응은 세포의 사멸보다는 효소반응에 영향을 미치는 기작과 관련이 있는데, 중금속의 독성은 가수분해 시 형성된 화학종과 자유금속이온 농도 등, 용액내 존재 이온들 사이의 전기적 상호 작용이 세균에 대한 반응을 늦추는 것으로 알려져 있다. 세포막을 통과하는 유리 금속종의 확산이 지연되면 짧은 시간(5분 혹은 15분) 내에 반응이 완결되지 않을 수 있음을 보고하였다(Kungolos et al.[2006]; Petala et al.[2005]).
V. fischeri를 이용한 유기화학물질 12종에 대한 독성평가 결과는 Table 5와 같다. 노출시간 30분을 기준으로 Ethyl Benzene 등 조사대상 12종의 유기화학물질의 EC50값은 1.855~51,667 mg/L 범위를 보였다. 금속류의 EC50값 0.0318~243.6 mg/L에 비하여 농도도 높고 범위도 넓은 것으로 나타났다.
EC50값이 1 mg/L 이하로 급성독성분류시스템(Tongur and Yildiz[2020])에서 TU가 100 이상인 Class IV의 Very toxic의 수준을 상회하는 고고독성으로 평가된 물질은 없었으며, Ethyl Benzene과 Xylene의 경우 EC50값이 각각 1.855, 5.049 mg/L로 TU 값이 각각 53.90, 19.81로 산정되어 EC50값과 급성독성분류시스템 기준으로 very toxic 수준으로 평가되었다. Phenol, Cyclohexane 및 Toluene의 경우는 EC50값이 각각 49.02, 42.45 및 32.26 mg/L로 very toxic 수준으로 나타났으며, TU 값이 각각 2.040, 2.356 및 3.099로 산정되어 급성독성분류시스템 기준으로 toxic 수준으로 평가되었다.
Benzen의 경우 EC50값이 255 mg/L로 toxic 수준으로, TU 값이 각각 0.44로 급성독성분류시스템 기준으로 Class II의 slightly toxic 수준으로 평가되었다. 1,2-Dichloro Ethane 등 7개 화학물질은 EC50값이 1,096~51,448 mg/L 범위로 TU 값은 0.0913~0.0019 범위로 산정되었다. EC50값으로는 less toxic 수준으로 급성독성 분류시스템 기준으로 Class II의 slightly toxic 수준으로 평가되었다.
유기화학물질의 독성도는 Ethyl Benzene>Xylene>Toluene>Cyclohexane>Phenol>Benzene>1,2-Dichloro Ethane>Ethyl Acetate>Butane>Hexane>Isopropyl Alcohol> Methanol 순으로 나타났다. 독성강도가 낮게 평가된 1,2-Dichloro Ethane, Ethyl Acetate, Butane 및 Hexane은 EC50값이 1,000~10,000 mg/L로 TU 값이 0.1~0.01 범위이고, Isopropyl Alcohol, Methanol은 10,000 mg/L 이상으로 TU 값이 0.01 이하로 나타나 독성정도가 낮은 것으로 나타났다.
V. fischeri를 이용한 Glycerol ethers의 생태독성연구에서 Methanol, Benzene, Toluene, Phenol 및 Xylene에 대한 30분 노출 EC50값의 조사결과를 각각 101,068, 108, 32, 31, 9 mg/L로 제시하였다(Garcia et al.[2015]). EC50값이 큰 Methanol과 Benzene에서는 실험결과에 약 2배정도 차이를 보였으나, Toluene, Phenol 및 Xylene에서는 유사한 결과를 보였다. 각 유기화학물질의 EC50값을 산출하기 위한 유기화학물질과 억제효과에 대한 양-반응관계 실험 결과는 Fig. 3과 같다.
발암물질로 잘 알려져 있는 PAHs의 발광박테리아 EC50값의 범위는 023~33.40 mg/L 정도로 알려져 있지만(Hwang et al.[2021]), 본 연구에서 실험한 유기화합물질의 EC50값의 범위는 5.049~51,667 mg/L로 PAHs보다 낮은 EC50값을 나타냈다. 해상운송위험·유해물질의 유통량을 고려한다면 향후 지속적인 관리가 필요할 것으로 사료된다.
노출시간에 따른 유기화학물질의 EC50값의 비율 변동은 Fig. 4와 같다. 노출시간에 대한 EC50값의 비율변동을 보면 Isopropyl Alcohol 및 Methanol의 경우에는 노출시간 5분의 및 15분의 EC50값이 노출시간 30분의 EC50값보다 높게 나타나 독성에 대한 반응시간이 더 긴 것으로 나타났다. 이들 물질의 경우는 30분 독성 TU 값이 각각 0.0042, 0.0019로 독성 영향이 아주 낮게 평가된 물질이다. Ethyl Acetate 등 9개 물질의 경우는 노출시간 5분, 15분의 EC50값이 독성 노출시간 30분의 EC50값 보다 낮게 나타났으며 노출시간 5분 EC50값이 가장 낮아 노출 초기 독성도가 높은 것으로 평가되었다.
V. fischeri에 대한 유기물의 독성은 노출시간보다는 이온화상수, 물리화학적인 준위, 화학적 반응기, 이온화 및 물질관련 물분화상수 등에 기인되며, 유기물이 V. fischeri의 표면 수용기, 세포막의 손상 혹은 세포구성물질과 반응하는 비가역적 반응에 의하여 짧은 시간에 세포의 사멸이 유도되는 것으로 추측된다고 보고하였다(Yang et al.[2016]).
하수처리장 방류수를 대상으로한 생태 독성연구에서 일반적으로 Cu와 Pb의 수치가 높을 경우 생태독성 수치가 높았으며 오염물질의 농도 변화가 생태독성 평가에도 영향을 미침을 확인할 수 있었음을 보고하였다(Seo et al.[2013]). 이러한 결과로부터 현장에서 독성의 감시를 위하여서는 감시대상 현장의 수질에 대한 사전정보가 필수 사항이라 하겠다.
수환경에서 생태독성은 탁도, 색도, 경도, 온도, 유기물 등 여러 요인에 의하여 영향을 받는 것으로 알려져 있으며, 혼재된 물질 간에도 상호작용에 의한 독성이 다르게 나타나는 것으로 알려져 있다(Kováts et al.[2012]). 구리와 아연의 경우 해양과 담수에서 낮은 농도로 존재하며, 수생생물의 필수 미량원소이지만 독성을 갖는다. 수환경에서 구리와 아연의 독성에 영향을 미치는 요인을 경도와 알카리도, 용존유기물, 입자상물질, pH, 염도(구리의 경우)등을 제시하고 있다(https://www.waterquality.gov.au/guidelines).
수환경에서 독성물질 배출에 대한 감시와 독성의 원인 분석을 위하여서는 대상 수체에 대한 화학 분석과 함께 수환경에서 생태독성을 갖는 물질들을 확인하고 독성에 대한 여러 간섭 요인이 배제된 기저 상태에서 각 물질에 대한 고유 생태독성 값은 반드시 필요한 자료이다.
독성평가 시에 측정된 개별물질의 EC50값은 각 물질의 독성도 비교에 사용되며, 그 물질에 대한 독성의 기준이 된다. 혼합물질의 독성평가 시에는 물질 혼합 시 독성의 상승효과 혹은 감쇄 효과 등을 평가 하는 기준이 되기도 한다(Tongur and Yildiz[2020]). 혼합물질의 독성평가의 경우에는 개별물질의 EC50값으로 혼합물질내의 각 물질의 EC50과 독성 기여도 산정의 기준이 되며 혼합독성지수(MTI, mixed toxicity index)(Wang et al.[2011]) 산출의 출발점이 된다(Adnan et al.[2021]; Wilkinson et al.[2015]).
생태독성 시험법을 이용하여 오염물에 대한 생태독성평가 시 생물종에 따라 오염물의 독성에 대한 민감도가 상이할 수 있다(Mankiewicz-Boczek et al.[2008]). 따라서, 단일생물을 이용한 평가보다는 다양한 방법에 근거한 오염물 독성 평가 접근법이 필요하며, 생물종에 따라 상이한 민감도에 의한 생물 검정 결과의 상호보완에 따른 통합평가법은 오염물질 혹은 환경오염의 모니터링에 더욱 적절한 정보를 제공해 줄 것으로 판단된다(Kungolos et al.[2006]).
이러한 이유로 표준 화학물질과 그들의 혼합물 독성 평가에서 좀 더 많은 정보와 연구들이 요구되며 생물 상호간의 교차검증의 적용이 필수불가결한 사항이라 생각된다(Kudłak et al.[2011]).
4. 결 론
해양성 발광박테리아(Vibrio fischeri)를 이용하여 구리, 주석 등 중금속 6종을 포함한 금속류 11종, 핵산, 페놀 등 유기화합물질 12종과 독성이 강한 시안을 포함한 총 24종의 개별 물질에 대한 생태독성을 평가하였다.
V. fischeri에 의한 금속류 및 무기물질에 대한 생태독성 평가 결과 동일종에서는 유사한 결과를 보였으며 타 영양단계의 생물보다는 V. fischeri에 의한 평가 결과에서 대부분 독성도가 높은 것으로 나타났다. 유기물의 독성 평가에서는 반응시간 5분이내에 독성이 검출 되었다.
해양사고에 따른 HNS의 유출 혹은 해양배출시설로부터 배출되는 유해물질 등의 감시를 위한 수단으로서 V. fischeri의 이용이 타당한 것으로 판단된다. V. fischeri은 타 영양단계의 생물보다 측정시간, 독성민감도, 유지관리 등의 측면에서 편의가 높은 방법이다. 실제 해양환경에 적용하기 위해서는 단일독성 뿐 아니라 혼합독성에 대한 평가도 필요며, 향후에 있을 유출감시 모니터링에 있어 독성 평가 결과를 기초자료로 활용할 수 있을 것으로 사료된다.
Acknowledgments
이 논문은 2022년도 해양수산부 재원으로 해양수산과학기술진흥원의 지원을 받아 수행된 연구입니다(20210660, 해양산업시설 배출 위험유해물질 영향평가 및 관리기술 개발).
References
-
Abbas, M., Adil, M., Syed Ehtisham-ul-Haque, Munir, B., Yameen, M., Ghaffar, A., Shar, G.A., Tahir, M.A. and Iqbal, M., 2018, Vibrio fischeri bioluminescence inhibition assay for ecotoxicity assessment: A review, Sci. of the Total Environ., 626, 1295-1309.
[https://doi.org/10.1016/j.scitotenv.2018.01.066]

-
Adnan, N.A., Halmi, M.I.E., Abd Gani, S.S., Zaidan, U.H., Abd Shukor, M.Y., 2021, Comparison of joint effect of acute and chronic toxicity for combined assessment of heavy metals on photobacerium sp.NAA-MIE, Int. J. Environ. Res. Public Health, 18, 6644.
[https://doi.org/10.3390/ijerph18126644]

-
An, Y.J. and Kim, M.J., 2009, Effect of antimony on the microbial growth and the activities of soil enzymes, Chemosphere, 74(5), 654-659.
[https://doi.org/10.1016/j.chemosphere.2008.10.023]

-
Asghari, S., Johari, S.A., Lee, J.H., Kim, Y.S., Jeon, Y.B., Choi, H.J., Moon M.C. and Yu, I.J., 2012, Toxicity of various silver nanoparticles comparedto silver ions in Daphnia magna J. of Nanobiotechnol, 10(14).
[https://doi.org/10.1186/1477-3155-10-14]

-
Baniamerian, H., Safavi, M., Alvarado-Morales, M., Tsapekos, P., Angelidaki, I., and Shokrollahzadeh, S., 2018, Photocatalytic inactivation of Vibrio fischeri using Fe2O3-TiO2-based nanoparticles. Environ. Res., 166, 497-506.
[https://doi.org/10.1016/j.envres.2018.06.011]

-
Efremova Aaron, S., Trajkovska, K.T., Cekovska, S. and Aaron, J.J., 2019, Establishment of an EC50 database of pesticides using a Vibrio fischeri bioluminescence method, The journal of biological and chemical luminescence, 1-4.
[https://doi.org/10.1002/bio.3628]

- Binaeian, E., Safekordi, A.A., Attar, H., Saber, R., Chaichi, M.J. and Kolagar, A.H., 2012, Comparative toxicity study of two different synthesized silver nanoparticles on the bacteria Vibrio fischeri, African J. of Biotechnol., 11(29), 7554-7564.
-
García, J.I., Pires, E., Aldea, L., Peralesc L.L.E. and Giner, B., 2015, Ecotoxicity studies of glycerol ethers in Vibrio fischeri : checking the environmental impact of glycerol-derived solvents, Green Chem., 17, 4326
[https://doi.org/10.1039/C5GC00857C]

-
Hachicho, N., Hoffmann, P., Ahlert, K. and Heipieper, H.J., 2014, Effect of silver nanoparticles and silver ions on growth and adaptive response mechanisms of Pseudomonas putida mt-2, FEMS Microbiol Lett, 355, 71-77.
[https://doi.org/10.1111/1574-6968.12460]

-
Hong, Y.J., Liao, W., Yan, Z.f., Bai, Y.C., Feng, C.L., Xu, Z.X., and Xu, D.Y., 2020, Progress in the Research of the Toxicity Effect Mechanisms of Heavy Metals on Freshwater Organisms and Their Water Quality Criteria in China, J. of Chem.(Hindawi), 2020(12).
[https://doi.org/10.1155/2020/9010348]

- ITOPF, TIP 17, 2014, Response to marine chemical incidents, Technical information papers, 1-16.
-
Jang, H.J., Lee, M.H., Lee, E.J., Yang, X., and Kong, I.C., 2017, Toxicity Evaluation of Metals and Metal-oxide Nanoparticles based on the Absorbance, Chlorophyll Content, and Cell Count of Chlorella vulgaris, Clean Technol., 23(1), 27-33.
[https://doi.org/10.7464/ksct.2017.23.1.027]

-
Kim, J.S., Kim, I.H., Lee, W.M., Lee, H.I. and Kim, S.G., 2014, A Effect of Heavy Metal to Toxicity of Triclosan Focused on Vibrio fischeri Assay, J. Kor. Soc. Environ. Eng., 36(3), 153-161.
[https://doi.org/10.4491/KSEE.2014.36.3.153]

-
Kim, T.W., Kim, Y.R., Jo, S.E., Son, M.H., Lee, M.J., and Oh, S.W., 2015, Marine Ecotoxicological Evaluation on HNS Spill Accident: Nitric Acid Spill Case Study, J. of the Korean Soc. of Mar. Environ. & Saf., 21(6), 655-661.
[https://doi.org/10.7837/kosomes.2015.21.6.655]

-
Klapötke, T.M., Scharf, R., Stierstorfer, J. and Unger C.C., 2021, Toxicity Assessment of Energetic Materials by Using the Luminescent Bacteria Inhibition Test, Propellants Explos. Pyrotech, 46, 114-123.
[https://doi.org/10.1002/prep.202000044]

-
Kong, I.C., Shi, Y.T., Lee, M.K. and Kang I.M., 2015, Bioassessment of Heavy Metals, Nanoparticles, and Soils Contaminated with Metals using Various Bioassays, Econ. Environ. Geol., 48(3), 261-271.
[https://doi.org/10.9719/EEG.2015.48.3.261]

-
Kováts, N., Refaey, M., Varanka, B., Reich, K., Ferincz, Á. and Ács, A., 2012, Comparison Of Conventional and Vibrio fischeri bioassays for the assessment of municipal wastewater toxicity, Environ. Eng. and Manag. J., 11(11), 2073-2076.
[https://doi.org/10.30638/eemj.2012.258]

-
Kudłak, B., Wolska, L. and Namiesnik, J., 2011, Determination of EC50 toxicity data of selected heavy metals toward Heterocypris incongruens and their comparison to “direct-contact” and microbiotests, Environ. Monit. Assess, 174, 509-516.
[https://doi.org/10.1007/s10661-010-1474-8]

-
Kungolos, A., Tsiridis, V., Samaras, P. and Tsiropoulos, N., 2006, Toxic and interactive toxic effects of agrochemical substances and copper on Vibrio fischeri, WIT Transactions on Ecology and the Environment, 99, 485-491.
[https://doi.org/10.2495/RAV060481]

-
Laetz, C.A., Baldwin, D.H., Collier, T.K., Hebert, V., Stark, J.D., and Scholz, N.L., 2009, The Synergistic Toxicity of Pesticide Mixtures: Implications for Risk Assessment and the Conservation of Endangered Pacific Salmon, Environmental Health Perspectives, 117(3).
[https://doi.org/10.1289/ehp.0800096]

-
Larsson, M. A., Baken, S., Gustafsson, J.P., Hadialhejazi, G., and Smolders, E., 2013, Vanadium bioavailability and toxicity to soil microorganisms and plants. Environ Toxicol Chem, 32, 2266-2273.
[https://doi.org/10.1002/etc.2322]

-
Lee, K.S., Lee, S.J., Wang, C.K. and Choi, Y.G., 2020, Pattern of Heavy Metals in a Continuous Toxicity Monitering System Using Bioluminescent Bacteria, J. Korean Soc. Environ. Eng., 42(4), 66-74.
[https://doi.org/10.4491/KSEE.2020.42.2.66]

-
Mankiewicz-Boczek, J., Na/ecz-Jawecki, G., Drobniewska, A., Kaza, M., Sumorok, B., Izydorczyk, K., Zalewski, M., and Sawicki, J., 2008, Application of a microbiotests battery for complete toxicity assessment of rivers, Ecotoxicol. and Environ. Saf., 71, 830-836.
[https://doi.org/10.1016/j.ecoenv.2008.02.023]

-
Mano, H and Shinohara, N., 2020, Acute Toxicity of Nickel to Daphnia magna: Validation of Bioavailability Models in Japanese Rivers Water, Air, & Soil Pollut., 231(459).
[https://doi.org/10.1007/s11270-020-04842-1]

-
McKnight, K., Binet, M., Adams M., Apte, S.C. and Golding, L.A., 2018, Toxicity of dissolved and precipitated forms of barium to a freshwater alga (Chlorella sp. 12) and water flea (Ceriodaphnia dubia), Environ.Toxicol.Chem., 37, 1632-1642.
[https://doi.org/10.1002/etc.4107]

- ME, 2011, Ecotoxicity Reduction Guidebook for Wastewater Discharge Facilities.
-
Mediavilla, J.J.V., Perez, B.F., Cordoba, M.C.F., Espina, J.A. and Ania, C. O., 2019, Photochemical Degradation of Cyanides and Thiocyanates from an Industrial Wastewater, Molecules, 24(7), 1373.
[https://doi.org/10.3390/molecules24071373]

-
Morais, S, Costa, F.G. and Pereira M. L., 2012, Environmental Health-Emerging Issues and Practice, chapter Heavy Metals and Human Health, 227-246.
[https://doi.org/10.5772/29869]

-
Okamoto, A., Yamamuro, M. and Tatarazako, N., 2014 Acute toxicity of 50 metals to Daphnia magna, J. Appl. Toxicol., 35, 824-830.
[https://doi.org/10.1002/jat.3078]

- Petala, M., Tsiridis, V., Kyriazis, S., Samaras, P., Kungolos, A. and Sakellaropoulos, G.P., 2005, Evaluation of to toxic response of Heavy metals and organic pollutants using microtox acute toxicity test, Proceedings of the 9th International Conference on Environmental Science and Technology Rhodes island, Greece, 1-3.
-
Scheerer S., Gomez, F., and Lloyd, D., 2006, Bioluminescence of Vibrio fischeri in continuous culture: optimal conditions for stability and intensity of photoemission, J. of Microbiol. Methods, 67, 321-329.
[https://doi.org/10.1016/j.mimet.2006.04.010]

-
Schiffer, S. and Liber, K, 2017, Toxicity of aqueous vanadium to zooplankton and phytoplankton species of relevance to the athabasca oil sands region, Ecotoxicol.and Environ. Saf., 137, 1-11.
[https://doi.org/10.1016/j.ecoenv.2016.10.040]

-
Seo, B.W., Lee, J.H., Lee, Y.H. and Kang, S.H., 2013, Variation of hazardous substances in sewage ecotoxicological assessment, J. of Korean Soc. of Water and Wastewater, 27(5), 603-610.
[https://doi.org/10.11001/jksww.2013.27.5.603]

-
Shukla, D.M., Bajwa, V., Gajic, D. and Saxena P.K, 2020, Quorum sensing inhibition in Vibrio fischeri: An efficient system to assess antibacterial properties of medicinal plants and their volatile compounds, Integr Food Nutr Metab, 7, 1-9.
[https://doi.org/10.15761/IFNM.1000281]

-
Wilkinson, A.D., Collier, C.J., Flores, F. and Negri, A.P., 2015, Acute and additive toxicity of ten photosystem-II herbicides to segrass, Sci. Rep., 5, 17443.
[https://doi.org/10.1038/srep17443]

- Lee, K.T., Park, G.S. and Kim, P.J., 2008, Development of Marine Toxicity Standard Method for Marine Luminescent Bacteria: Introduction of N-Tox test, J. of the Korean Soc. of Oceanogr., 13(2), 156-163.
-
Tongur, S., and Yildiz, S., 2020, Toxicological evaluation of carbamazepine active pharmaceutical ingredient with Lepidium sativum, Daphnia magna and Vibrio fischeri toxicity test methods, Desalination and Water Treatment, 201, 438-442.
[https://doi.org/10.5004/dwt.2020.25969]

-
Trenfieldabc, M.A., Damb, J.W.V., Harfordc, A.J., Parryde, D., Stretenb, C., Gibba, K. and Damc, R.A., 2017, Assessing the chronic toxicity of copper and aluminium to the tropical sea anemone Exaiptasia pallida, Ecotoxicol. and Environ. Saf., 139, 408-415.
[https://doi.org/10.1016/j.ecoenv.2017.02.007]

-
Tsiridis, V., Petala, M., Samaras, P., Hadjispyrou, S., Sakellaropoulos, G. P. and Kungolos A., 2006, Interactive toxic effects of heavy metals and humic acids on Vibrio fischeri, Ecotoxicol. and Environ. Saf., 63(1), 158-167.
[https://doi.org/10.1016/j.ecoenv.2005.04.005]

- USEPA, 1985, Terms of the environment: Glossary, abbreviations and acronyms, 65.
- USEPA, 2005, Technologies and techniques for arly Warning Systems to monitor and evaluate drinking water quality, A Stateof-the-art review, Research report, EPA/600/R-05/156.
-
Wang H., Li, Y., Huang, H., Xu, X., and Wang, Y., 2011, Toxicity evaluation of single and mixed antifouling biocides using the strongylocentrotus intermedius sea urchin embryo test, Environ. Toxicol. and Chem. 30(3), 692-703.
[https://doi.org/10.1002/etc.440]

-
Xu, X., Xia, S, Zhou, L. and Zhang, Z., 2015, Bioreduction of vanadium(V) in groundwater by autohydrogentrophic bacteria: Mechanisms and microorganisms, J. of Environ. Sci., 30.
[https://doi.org/10.1016/j.jes.2014.10.011]

-
Yang, X., Yani, J., Wang, F., Xu, J., Liu, X., Ma, K, Hu, X. and Ye, J., 2016, Comparison of organics and heavy metals acute toxicities to Vibrio fischeri, J. Serb. Chem. Soc., 81(6), 697-705.
[https://doi.org/10.2298/JSC151124011Y]

-
Yanga, Q., Gaoa, Y., Kea, J., Showb, P.L., Gea, Y., Liua, Y., Guoa, R., and Chena, J., 2021, Antibiotics: An overview on the environmental occurrence, toxicity, degradation, and removal methods, Bioengineered, 12(1), 7376-7416.
[https://doi.org/10.1080/21655979.2021.1974657]

- Yin, H.Y., Zhao, Y., Zheng, Y., Bao, C., Huang, X.X., Ding, Y.J. and Cai, Q., 2019, Joint toxicity of binary complexes of cartap, spirotetramat, copper, and cadmium to Vibrio fischeri, J. of Agro-Environ. Sci., 38(9), 2080-2085.
-
Hwang, K., Lee, J., Kwon, I., Park, S.Y., Yoon, S.J., Lee, J., Kim, B., Kim, T., Kwon, B.-O., Hong, S., Lee, M.J., Hu, W., Wang, T., Choi, K., Ryu, J., Khim, J.S., 2021. Large-scale sediment toxicity assessment over the 15,000 km of coastline in the Yellow and Bohai seas, East Asia. Sci. of The Total Environ. 792, 148371.
[https://doi.org/10.1016/j.scitotenv.2021.148371]